Актемра или эфлейра что лучше
Эффективность тоцилизумаба у пациентов с COVID-19, госпитализированных в ОРИТ: ретроспективное когортное исследование
Изучить эффективность более раннего или позднего применения тоцилизумаба, т.е. до или после начала искусственной вентиляции легких (ИВЛ), в профилактике смерти у больных тяжелой COVID-19 ассоциированной пневмонией, которым потребовалась госпитализация в отделения реанимации и интенсивной терапии (ОРИТ) для респираторной поддержки.
Материалы и методы
В ретроспективное когортное исследование включали пациентов с тяжелой COVID-19 пневмонией, госпитализированных в связи с ухудшением оксигенации в ОРИТ российских лечебных учреждений с 16 марта по 5 мая 2020 г. Всем пациентам проводилась стандартная терапия, а часть больных получили также тоцилизумаб внутривенно в дозе 400 мг. Госпитальную летальность от любых причин сравнивали между группами пациентов, которым вводили и не вводили тоцилизумаб, с помощью модели логистической регрессии с поправкой на возраст и пол.
В исследование были включены 328 пациентов (57,0% мужчин, медиана возраста 59 лет), 159 из которых получили по крайней мере одну инфузию тоцилизумаба. Препарат применяли у 83 (60,1%) из 137 больных, находившихся на оксигенотерапии или неинвазивной вентиляции легких (более раннее введение), и 76 (39,8%) из 191 интубированного пациента (позднее введение). Ни более раннее, ни позднее введение тоцилизумаба не привело к снижению риска смерти по сравнению с соответствующими контрольными группами больных, не получавших ингибитор интерлейкина-6 (скорректированные по возКЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ И ТЕРАПИЯ, 2020, 29 (4) расту и полу отношения шансов составили 2,370, 95% ДИ 0,969-5,798; р=0,059, и 0,996, 95% ДИ 0,539-1,839; р=0,989, соответственно).
Более раннее введение тоцилизумаба у неинтубированных пациентов с тяжелой COVID-19 пневмонией и поздняя инфузия препарата после начала ИВЛ не привели к снижению летальности от всех причин.
Число пациентов с COVID-19 во многих странах продолжает быстро увеличиваться, а общее число зарегистрированных в мире случаев инфекции в ноября 2020 г. превысило 60 млн. Хотя в большинстве случаев инфекция, вызванная SARSCoV-2, характеризуется благоприятным течением, у 5-10% госпитализированных больных с вирусной пневмонией развивается острый респираторный дистресс синдром (ОРДС), требующий респираторной поддержки в отделении реанимации и интенсивной терапии (ОРИТ) 2. В российских ОРИТ летальность больных с ОРДС, вызванным SARS-CoV-2, составила в среднем около 65%, а основными предикторами неблагоприятного исхода были пожилой возраст, мужской пол и некоторые сопутствующие заболевания, в том числе ожирение, сахарный диабет 2 типа и коронарная болезнь сердца [4]. Летальность была достаточно низкой у пациентов, находившихся на оксигенотерапии (10,1%), и значительно уве личивалась у больных, которых приходилось переводить на неинвазивную (36,8%) и особенно искусственную (76,5%) вентиляцию легких.
Причиной развития быстро прогрессирующего поражения легких при COVID-19 считают гипериммунный воспалительный ответ, сопровождающийся выбросом различных цитокинов [5]. Ранее синдром выделения цитокинов, или «цитокиновый шторм», был описан при первичном и вторичном гемофагоцитарном лимфогистиоцитозе и синдроме активации макрофагов, а также при CAR-T-клеточной терапии онкологических заболеваний [6]. Хотя «цитокиновый шторм» упоминается практически во всех статьях, посвященных COVID-19, общепринятые критерии его диагностики до сих пор отсутствуют. На практике синдром выброса цитокинов предполагают у пациентов с SARS-CoV-2 пневмонией 3-4 стадии (т.е. с поражением более 50% легочной ткани), сопровождающейся снижением SpO2≤93%, стойкой лихорадкой и повышением содержания лабораторных маркеров воспаления, в том числе С-реактивного белка (до 100-400 мг/л и более), ферритина, фибриногена, интерлейкина (ИЛ)-6, а также Dдимера. R. Caricchio и соавт. при анализе лабораторных показателей и клинических проявлений более чем у 500 пациентов c COVID-19 пришли к выводу, что существующие критерии синдрома выброса цитокинов, такие как HScore и др., не позволяют идентифицировать это осложнение SARS-CoV-2 инфекции, и предложили собственные критерии, отражающие (1) воспаление, (2) гибель клеток и повреждение ткани и (3) преренальные электролитные нарушения (табл. 1). Эти критерии позволяли с достаточной точностью предсказать более длительную госпитализацию и летальность [7]. Следует отметить, что к числу критериев синдрома выброса цитокинов авторы отнесли увеличение абсолютного количества нейтрофилов, которое, по-видимому, указывает на важную роль врожденного иммунитета в развитии «цитокинового шторма» при COVID-19 и во многих случаях не является признаком вторичной бактериальной инфекции, требующим назначения антибиотиков.
| Необходимые критерии (все) | Значения |
| Симптомы COVID-19 | + |
| ПЦР на SARS-CoV-2 | ± |
| Матовые стекла на КТ | + |
| Ферритин | >250 нг/мл |
| СРБ | >46 мг/л |
| И (один показатель из каждого кластера) | |
| Кластер I | |
| Альбумин | 11400 в мм 3 |
| Кластер II | |
| АЛТ | >60 Ед/л |
| АСТ | >87 Ед/л |
| D-димер | >4930 нг/мл |
| ЛДГ | >416 Ед/л |
| Тропонин I | >1,09 нг/мл |
| Кластер III | |
| Анионный разрыв | 106 ммоль/л |
| Калий | >4,9 ммоль/л |
| Азот мочевины/креатинин | >29 |
Предполагаемая роль синдрома выброса цитокинов в патогенезе тяжелого поражения легких и других органов при COVID-19 послужила основанием для изучения эффективности различных антицитокиновых средств, в том числе ингибиторов интерлейкина (ИЛ)-6 (тоцилизумаба, сарилумаба, олокизумаба), ИЛ-1 (канакинумаба, анакинры) и янус-киназ (тофацитиниба, барицитиниба). Хотя ни один из перечисленных препаратов официально не зарегистрирован для лечения СOVID-19, во многих странах ингибиторы ИЛ-6 применяют в клинической практике (off-label) у больных с наиболее тяжелым течением этого заболевания. Дополнительным доводом в пользу возможной эффективности ингибиторов ИЛ-6 при COVID-19 послужил и тот факт, что в 2017 г. тоцилизумаб был зарегистрирован для лечения угрожающего жизни синдрома высвобождения цитокинов, вызванного химерным антигенным рецептором (CAR) T-клеток у пациентов с гемобластозами [8].
Первые сообщения об успешном опыте применения тоцилизумаба у больных с тяжелым течением COVID19 были опубликованы китайскими исследователями уже вскоре после начала пандемии SARS-CoV-2 инфекции [14,15]. В последующем эффективность препарата была продемонстрирована в многочисленных наблюдательных исследованиях, которые проводились в разных странах, в том числе России [16,17]. По данным недавно опубликованного мета-анализа 10 исследований (n=1358), введение тоцилизумаба у пациентов с тяжелым течением COVID-19 ассоциировалось со снижением смертности по сравнению с таковой в контрольной группе больных, которым не вводили ингибитор ИЛ-6 [18]. В то же время эффективность тоцилизумаба в профилактике неблагоприятных исходов COVID-19 не была подтверждена в нескольких недавно завершенных рандомизированных контролируемых исследованиях [19].
Результаты терапии у пациентов с COVID-19 могут зависеть от сроков введения противовоспалительных препаратов [20]. Соответственно, целью ретроспективного когортного исследования было изучение эффективности более раннего или позднего применения тоцилизумаба, т.е. до или после начала искусственной вентиляции легких (ИВЛ), в профилактике смерти у больных тяжелой COVID-19 ассоциированной пневмонией, которым потребовалась госпитализация в ОРИТ для респираторной поддержки.
Материал и методы
Дизайн исследования и критерии отбора пациентов. Ретро спективное когортное исследование проводилось в Федеральном дистанционном консультативном центре анестезиологии и реаниматологии для взрослых, созданном по приказу Минздрава РФ 16.03.2020 на базе Первого МГМУ им. И.М. Сеченова (Сеченовский Университет). В центр по интернет поступают заявки на консультацию больных с тяжелым течением COVID-19, госпитализированных в ОРИТ лечебных учреждений Москвы, Московской области и других регионов Российской Федерации. В ретроспективное исследование включали пациентов, которым консультанты центра рекомендовали введение тоцилизумаба, учитывая наличие двусторонней пневмонии, поражающей более 50% легочной ткани (т.е. 3-4 стадии) и требующей респираторной поддержки, особенно при наличии повышенной концентрации СРБ. Окончательное решение о введении тоцилизумаба принимали лечащие врачи. Следует отметить, что консультанты центра не имели информации о доступности ингибиторов ИЛ-6 в соответствующих регионах Российской Федерации и лечебных учреждениях и, соответственно, не могли предсказать, будет ли пациенту введен тоцилизумаб или нет.
Пациенты, включенные в исследование, были распределены на две когорты с учетом уровня респираторной поддержки (оксигенотерапия/неинвазивная вентиляция легких или ИВЛ) на момент инфузии тоцилизумаба или получения заявки на консультацию, если ИЛ-6 в конечном итоге не вводился.
Все пациенты подписывали информированное согласие на применение тоцилизумаба и других «экспериментальных» препаратов для лечения COVID-19 в лечебном учреждении.
Процедуры и исходы. На основании полученных заявок на консультацию регистрировали демографические показатели и сопутствующие заболевания, диагностированные до развития COVID-19 (артериальная гипертония, ишемическая болезнь сердца [ИБС], инсульт в анамнезе, фибрилляция предсердий, ожирение, сахарный диабет, бронхиальная астма, хроническая обструктивная болезнь легких [ХОБЛ], ревматические аутоиммунные заболевания, злокачественные опухоли, диагностированные в течение последних 5 лет, гемобластозы, ВИЧ-инфекция). Критериями диагноза ИБС считали острый инфаркт миокарда и/или вмешательства на коронарных артериях (стентирование или аортокоронарное шунтирование) в анамнезе. Ожирение диагностировали на основании индекса массы тела: 2 – нормальная масса тела, 25,0-29,9 кг/м 2 – избыточная масса тела, ≥30,0 кг/м 2 – ожирение. При анализе частоты ревматических заболеваний учитывали только аутоиммунные заболевания, такие как ревматоидный артрит, системная красная волчанка, системная склеродермия, псориатический артрит, анкилозирующий спондилит, системные васкулиты.
Лечение COVID-19 проводилось в соответствии с временными рекомендациями Минздрава РФ. С марта по май 2020 г. в качестве противовирусных препаратов чаще всего применяли гидроксихлорохин/хлорохин, азитромицин и лопинавир/ритонавир, реже – интерферон-β, в то время как глюкокортикостероиды в начала вспышки инфекции не рекомендовались. Доза тоцилизумаба составляла 400 мг внутривенно. Допускалось введение второй дозы препарата по решению лечащих врачей.
Результаты
C 16 марта по 5 мая 2020 г. были получены заявки на консультацию 2066 пациентов с COVID-19, которые были госпитализированы в ОРИТ в связи с ухудшением оксигенации (рис. 1). В этой выборке 328 больным (57,0% мужчин, медиана возраста 59 лет) было рекомендовано введение тоцилизумаба. Относительно невысокая частота назначения ингибитора ИЛ-6 объяснялась тем, что в начале вспышки SARS-CoV-2 инфекции в Российской Федерации данных о возможной эффективности препарата было недостаточно.
159 из 328 пациентов получили по крайней мере одну дозу препарата 400 мг (у 21 была выполнена вторая инфузия в той же дозе с интервалом около 24 ч), в то время как оставшимся 169 больных не вводили ингибитор ИЛ-6, как правило, из-за отсутствия препарата в лечебном учреждении. Тоцилизумаб был введен 83 (60,1%) из 137 больных, которым проводились оксигенотерапия или неинвазивная вентиляция легких (НИВЛ) на момент инфузии или отправки заявки лечебным учреждением (более раннее введение тоцили зумаба), и 76 (39,8%) из 191 интубированного пациента (позднее введение тоцилизумаба) (рис. 1). В первой когорте тоцилизумаб был введен через 6 дней (интерквартильный размах 3-9) после госпитализации, а во второй – через 2 дня (интерквартильный размах 1-4) после начала ИВЛ.
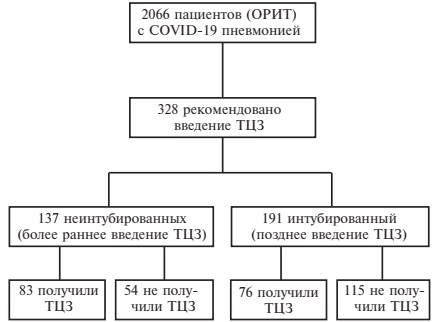
Группы больных, получивших или не получивших ингибитор ИЛ-6 на фоне оксигенотерапии или НИВЛ, были сопоставимы по возрасту и полу. У больных, которым вводили тоцилизумаб, частота некоторых заболеваний, которые могут ухудшить течение COVID-19, в том числе коронарной болезни сердца, инсульта в анамнезе и сахарного диабета 2 типа, была несколько выше, чем в группе сравнения, хотя разница не достигла статистической значимости (табл. 1). В когорте интубированных пациентов группы сравнения были сопоставимы как по демографическим показателям, так и по частоте всех сопутствующих заболеваний.
Во всей выборке летальность больных, получивших и не получивших тоцилизумаб, достоверно не отличалась (46,5% и 50,3%, соответственно, p=0,509). В обеих когортах основными причинами смерти были ОРДС (91,9% и 77,6%, соответственно), сердечно-сосудистые осложнения (5,4% и 12,9%) и тромбоэмболия легочной артерии (1,4% и 2,4%). Среди неинтубированных пациентов летальность была примерно в два раза ниже, чем среди больных, находившихся на ИВЛ (32,5% и 61,8%, соответственно; p
Обсуждение
В наблюдательном когортном исследовании у больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в ОРИТ, внутривенное введение тоцилизумаба в фиксированной дозе 400 мг не сопровождалось снижением летальности. Тоцилизумаб не увеличивал выживаемость ни у больных, находившихся на оксигенотерапии или НИВЛ, ни у пациентов, которым ингибитор ИЛ-6 вводили после начала ИВЛ. Более того, введение тоцилизумаба у неинтубированных пациентов ассоциировалось с увеличением потребности в ИВЛ. Последний результат мог частично объясняться несколько более высокой частотой некоторых сопутствующих заболеваний, ухудшающих течение COVID-19, в группе тоцилизумаба. В то же время группы интубированных пациентов, получивших и не получивших тоцилизумаб, были сопоставимы по демографическим показателям и частоте сопутствующих заболеваний. Соответственно, различия между группами не могли объяснить негативные результаты исследования в этой выборке.
Наши данные контрастируют с результатами многочисленных наблюдательных исследований, которые показали, что введение тоцилизумаба может привести к снижению потребности в ИВЛ и летальности больных с тяжелым течением COVID-19 ассоциированной пневмонии 22. В ретроспективном исследовании, проводившемся в 13 американских больницах, эффективность тоцилизумаба изучали у 630 больных с COVID-19, госпитализированных в ОРИТ для респираторной поддержки [24]. Основную группу составили 210 пациентов, которым вводили тоцилизумаб в дозе 400 мг внутривенно, контрольную – 420 больных, не получавших ингибитор ИЛ-6 и подобранных по демографическим и клиническим показателям. Во всей когорте, как и в нашем исследовании, преобладали люди пожилого возраста (в основном мужчины), страдавшие различными сопутствующими заболеваниями. Около 45% больных получали глюкокортикостероиды. Летальность в целом составила 57%, в том числе 49% в группе тоцилизумаба и 61% в контрольной группе. По данным регрессионного анализа Кокса, введение тоцилизумаба ассоциировалось с достоверным снижением риска смерти (отношение рисков 0,64, 95% ДИ 0,47-0,87; p=0,0040). Сходная ассоциация была выявлена также в подгруппах больных, находившихся на ИВЛ, и пациентов с исходным уровнем СРБ ≥150 мг/л.
В другом крупном ретроспективном американском исследовании STOP-COVID эффективность тоцилизумаба изучали у 3924 пациентов с COVID-19, поступивших в ОРИТ (62,8% мужчин, медиана возраста 62 года) [25]. 433 (11,0%) из них получили тоцилизумаб в течение первых 2 дней после госпитализации в ОРИТ. Больные группы тоцилизумаба были моложе пациентов группы сравнения (медианы 58 и 63 года, соответственно), чаще получали глюкокортикостероиды (18,7% и 12,6%) и чаще находились на ИВЛ (47,3% и 37,9%). Летальность во всей выборке составила 39,3%, в том числе 28,9% в группе тоцилизумаба и 40,6% в группе сравнения. Лечение ингибитором ИЛ-6 ассоциировалось с достоверным снижением риска смерти по сравнению с контролем (отношение рисков 0,71, 95% ДИ 0,56-0,92).
Статистически значимая ассоциация между введением тоцилизумаба (внутривенно в дозе 8 мг/кг в виде двух инфузий с интервалом 12 ч или подкожно в дозе 324 мг) и снижением риска перевода на ИВЛ или смерти (скорректированное отношение рисков 0,61, 95% ДИ 0,40–0,92; p=0,020) была выявлена и в итальянском исследовании у 544 больных с тяжелой COVID-19 ассоциированной пневмонией, 179 из которых получили ингибитор ИЛ-6 [21]. В этом исследовании доля больных, нуждавшихся в ИВЛ (18% и 16% в группах тоцилизумаба и сравнения, соответственно) и летальность (7% и 20%) были значительно ниже, чем в нашем исследовании, в том числе у пациентов, получивших более раннюю инфузию тоцилизумаба, и в описанных выше исследованиях. Таким образом, данные итальянских авторов позволяют судить об эффективности тоцилизумаба у пациентов с менее тяжелым течением COVID-19.
Заключение
В ретроспективном когортном исследовании у пациентов с тяжелой COVID-19 пневмонией, нуждавшихся в респираторной поддержке в ОРИТ, мы не выявили снижения летальности как при более раннем (до интубации), так и позднем (после начала ИВЛ) внутривенном введении тоцилизумаба в дозе 400 мг по сравнению с контрольными группами больных, получавших только стандартную терапию. Хотя полученные данные не позволяют отвергнуть эффективность тоцилизумаба, они согласуются с результатами нескольких рандомизированных клинических исследований, в которых изучался ингибитор ИЛ-6. В настоящее время продолжаются еще несколько рандомизированных контролируемых исследований, в частности RECOVERY, которые позволят оценить эффективность тоцилизумаба у пациентов с COVID-19 и возможные показания к его применению. Если по мнению врача больной с тяжелой COVID-19 пневмонией нуждается в противовоспалительной терапии, то лечение целесообразно начинать с дексаметазона, в то время как введение тоцилизумаба может обсуждаться при неэффективности глюкокортикостероидов.
Актемра или эфлейра что лучше
Результаты исследования, проведенного в 3 больницах Италии и опубликованного в журнале Lancet Rheumatology, продемонстрировали значимое снижение риска инвазивной ИВЛ или смерти у пациентов с тяжелым течением пневмонии, вызванной COVID-19, получавших ингибитор ИЛ-6 тоцилизумаб внутривенно (в/в) или подкожно (п/к) по сравнению со стандартным лечением.
Из 1351 госпитализированного пациента 544 (40%) имели тяжелую пневмонию, вызванную COVID-19, и были включены в ретроспективное наблюдательное когортное исследование. Включенные пациенты имели один из следующих признаков: наличие ЧДД 30 или более в минуту, SaO2 менее 93% при дыхании атмосферным воздухом, отношение PaO2 к FiO2 менее 300 мм рт.ст. в атмосферном воздухе в сочетании с инфильтрацией легких более 50% в течение 24-48 ч, согласно китайским рекомендациям по ведению COVID-19 (версия 6.0). Все пациенты получали стандартную терапию (т.е. кислородотерапия, гидроксихлорохин, азитромицин, антиретровирусные препараты и низкомолекулярный гепарин). Отобранная подгруппа пациентов (n=179) также получала тоцилизумаб. Критериями исключения применения тоцилизумаба были сопутствующая инфекция, отличная от COVID-19; соотношение PaO2/FiO2 более 300 мм рт.ст.; хроническое или текущее применение глюкокортикоидов; наличие в анамнезе тяжелых аллергических реакций на моноклональные антитела; нейтропения менее 500/мкл или тромбоцитопения менее 50×109; активный дивертикулит, воспалительные заболевания кишечника или другие симптоматические заболевания ЖКТ; тяжелое гематологическое заболевание, поражение почек или печени.
В результате 57 (16%) из 365 пациентов в группе стандартной терапии нуждались в ИВЛ, по сравнению с 33 (18%) из 179 пациентов, получавших тоцилизумаб (р=0,41; 16 (18%) из 88 пациентов, получавших в/в лечение, и 17 (19%) из 91 пациента, получавших п/к лечение). 73 (20%) пациента в группе стандартной терапии умерли, по сравнению с 13 (7%; р
Эфлейра® (нетакимаб)
Описание препарата
Лекарственная форма
Показания к применению
— Лечение бляшечного псориаза среднетяжелой и тяжелой степени у взрослых пациентов, когда показана системная терапия или фототерапия.
— Лечение активного анкилозирующего спондилита у взрослых пациентов при недостаточном ответе на стандартную терапию.
— Лечение активного псориатического артрита в режиме монотерапии или в комбинации с метотрексатом при недостаточном ответе на стандартную терапию.
Клинические исследования
Препарат Эфлейра® прошел все необходимые этапы доклинических испытаний. На этой стадии разработки были установлены высокая аффинность с IL17 человека, выраженная противовоспалительная активность и отсутствие токсичности.
В начале 2015 году стартовали клинические исследования препарата Эфлейра®. В настоящий момент на территории Российской Федерации и Республики Беларусь продолжаются клинические исследования III фазы в терапии псориаза, анкилозирующего спондилита, псориатического артрита.
Эффективность в терапии псориаза
Эффективность и безопасность препарата подтверждены результатами клинических исследований II и III фазы — BCD-085-2, BCD-085-2-ext и BCD-085-7 (PLANETA).
Исследование PLANETA (BCD-085-7) — международное многоцентровое рандомизированное двойное слепое клиническое исследование III фазы у больных среднетяжелым и тяжелым бляшечным псориазом. Это исследование проводилось на базе 22 аккредитованных лечебных учреждений России и 2 клинических центров в Республике Беларусь, всего в исследовании приняли участие 213 пациентов со среднетяжелым и тяжелым вульгарным псориазом. Общая продолжительность терапии и наблюдения в этом исследовании составляет 3 года.
Данные исследования показали, что более 80% пациентов, получавших лечение нетакимабом на неделях 0,1,2 и далее 1 раз в 4 недели, уже через 12 недель терапии достигли выраженного клинического ответа (PASI75), а каждый третий пациент достиг полного очищения кожи (PASI100).
Эффективность в терапии анкилозирующего спондилита:
Результаты Международного многоцентрового рандомизированного двойного слепого плацебо-контролируемого клинического исследования III фазы BCD-085-5/ASTERA продемонстрировали эффективность и безопасность нетакимаба у больных активным анкилозирующим спондилитом. Участниками исследования стали 228 больных с анкилозирующим спондилитом, сохраняющим свою активность, несмотря на прием стандартного лечения как минимум за месяц до скринингового обследования. Применение нетакимаба в дозе 120 мг приводило к выраженному терапевтическому эффекту: клинически значимое улучшение наблюдалось уже при первой оценке на 4-й неделе терапии; через 16 недель терапии отмечалось снижение выраженности остеита по данным МРТ как в позвоночнике, так и в крестцово-подвздошных суставах. Терапия нетакимабом хорошо переносилась пациентами, частота нежелательных явлений не отличалась от группы, принимающей плацебо.
Эффективность в терапии псориатического артрита:
Согласно результатам Международного многоцентрового рандомизированного двойного слепого плацебо-контролируемого клинического исследования III фазы BCD-085-8/PATERA 82,5% пациентов c псориатическим артритом достигают ответа ACR20 со стороны периферических суставов, и 83% — ответа PASI75 со стороны кожных проявлений к 24 неделе терапии нетакимабом.
У половины пациентов с активным псориатическим артритом, принимавших участие в клиническом исследовании нетакимаба, отмечалось улучшение состояния суставов и кожных проявлений уже на второй неделе терапии. А к 4 месяцу терапии у 39,2% пациентов заболевание достигало минимальной активности.
Безопасность
В рамках проведенных клинических исследований у пациентов с бляшечным псориазом препарат Эфлейра® показал благоприятный профиль безопасности. Явлений дозолимитирующей токсичности не выявлено. Большинство зарегистрированных нежелательных явлений (НЯ), связанных с приемом препарата Эфлейра®, имели легкую или среднюю степень тяжести, определяемую по СТСАЕ v.4.03., и не требовали прекращения терапии. Летальных исходов, связанных с терапией препаратом Эфлейра®, в ходе клинических исследований выявлено не было. Наиболее частой нежелательной реакцией в проведенных клинических исследованиях была нейтропения, большинство случаев которой были легкой или средней степени тяжести, носили транзиторный характер и не требовали дополнительной терапии. Часто встречались инфекции верхних дыхательных путей, лейкопения, гипербилирубинемия, повышение активности печеночных ферментов (АЛТ, АСТ), положительный результат исследования на комплекс Mycobacterium tuberculosis. Случаев воспалительных заболеваний кишечника, новообразований, связанных с терапией препаратом с МНН «Нетакимаб», зафиксировано не было. Перед назначением препарата Эфлейра® и в ходе терапии необходимо проводить стандартный скрининг для исключения туберкулезной инфекции, а также вирусных гепатитов В и С, ВИЧ..
Иммуногенность
В ходе клинических исследований формирование связывающих антител к препарату нетакимаб было зарегистрировано менее, чем в 0,5 % случаев. Нейтрализующих антител выявлено не было. Полученные данные демонстрируют низкую иммуногенность нетакимаба.