Альфа липоевая кислота для чего применяется
Альфа-липоевая кислота: показания к приему, цены, где можно купить
Элемент находится в отдельных продуктах, что не позволяет получать его в рекомендованных дозировках. Альфа-липоевая кислота чаще употребляется в биологически активных добавках, купить их можно в аптеках.
Содержание в продуктах
Показания к приему
Противопоказания к приему и побочные реакции
Общая информация
Кислота принимает участие во многих процессах, относится к условно-незаменимым. Человеческий организм вырабатывает ее в минимальных объемах, достаточных для предупреждения дефицита. Для получения рекомендованного количества пациент должен использовать БАДы или пищу, ее содержащую.
Организм использует алфа-липоевую кислоту:
для стабилизации липидного, углеводного обмена;
подавления свободных радикалов;
нормализации функциональности печени;
понижения уровня сахара в крови;
контролирования процессов расщепления аминокислот.
Естественный синтез вещества по мере старения уменьшается.
Содержание в продуктах
Ценность витамина связана с ограниченным количеством в отдельных овощах и мясной продукции. Получать необходимые объемы вещества сложно даже при разнообразии в питании. Наибольшие объемы альфа-липоевой кислоты находятся:
в томатах, зеленом горошке;
всех известных сортах капусты;
При достаточном употреблении указанных продуктов, прием добавок становится необязательным.
Польза АЛК
Клинические исследования доказали необходимость витамина для человеческого организма. При употреблении отмечаются следующие эффекты:
выработка важных для жизнедеятельности ферментов;
эвакуация токсических и вредных веществ;
улучшение функциональности пищеварительного отдела;
защита нервной и сердечно-сосудистой системы;
антиоксидантное действие, снижение активности процессов окисления;
предупреждение разрушения мышечных волокон;
замедление естественного старения, небольшой омолаживающий эффект;
ускоренное восстановление после спортивных тренировок.
Альфа-липоевая кислота используется для снижения массы тела, без прямого влияния на липидные клетки. Она применяется организмом для улучшения термогенеза, провоцирующего быстрый расход калорий. Потеря веса возможно при сочетании БАДа с тренировками и диетическим питанием. Он не подходит для увеличения мышечной массы.
Витамин необходим женщинам во время менопаузы, для повышения показателей фертильности и стабильной работы репродуктивного отдела. Он используется в косметологических целях, для разглаживания морщин и омоложения кожного покрова.
Показания к приему
Инструкция рекомендует к приему альфа-липоевую кислоту для профилактики и терапии:
цирроза, печеночных патологий;
отравлений, почечной дисфункции;
сахарного диабета, недостаточной работы сердца;
При спортивных тренировках витамин используется:
в роли антиоксиданта;
как средство для снижения последствий стресса;
для увеличения показателей выносливости и ускоренного восстановления.
В спорте вещество помогает снижать повреждения мышечной ткани, оказывает инсулиноподобный спектр действия. Из-за повышенного усвоения глюкозы в мышцах, наблюдается:
лучшее сохранение гликогена;
поддержка стабильных показателей сахара в крови;
ускоренные процессы, связанные с инсулином.
Спортсмены, регулярно принимающие элемент, чаще тренируются.
Противопоказания к приему и побочные реакции
Альфа-липоевая кислота относится к довольно безопасны средствам, но и у нее есть свои запреты на применения. Список противопоказаний представлен:
повышенной кислотностью желудочного сока;
аллергиями, индивидуальной непереносимостью компонентного состава;
несовершеннолетним возрастом (до 16 лет), беременностью, лактацией.
Запрещено употреблять БАД со спиртными напитками. Игнорирование правил провоцирует нарушения в скорости свертываемости крови и судорожный синдром.
Правила приема
Инструкция к каждому БАДу подробно описывает процесс терапии, в зависимости от назначения, могут отличаться дозировки. При лечении и подавлении осложнений, возникших на фоне диабета, используется от 600 мг до 1,8 г ежедневно. Манипуляции проходят за полчаса до приема пищи.
При спортивных тренировках объем зависит от конечной цели, показателей интенсивности нагрузок и пр. Средняя доза равна 200-500 мг. Использование большего количества не дает повышения эффективности, угрожает развитием побочных реакций.
Для профилактики назначается от 100 до 150 мг каждый день, до или после еды. Суточная дозировка может делиться на несколько процедур, при тренировках ее нужно использовать до начала занятий. Средняя время терапии равно 1,5-2 месяцам.
Варианты БАДов
Купить препараты можно в аптеках или специализированных магазинах спортивного питания. В последнем случае покупателям предлагаются разновидности с повышенными дозировками в каждой порции. Популярные добавки представлены:
Alpha Lipoic Acid (NOW) – в каждой капсуле содержится 250-600 мг кислоты. Средство характеризуется качеством и высокой скоростью усвоения активных компонентов. Цена начинается от 1450 руб.
Alpha Lipoic Acid (Solgar) – в каждой порции находится 120 мг витамина. Средняя цена равна 696 руб.
Alpha Lipoic Acid (Natrol) – стоимость начинается от 2281 руб. в каждой капсуле содержится 120 мг вещества.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Тиоктовая кислота: антиоксидантная терапия неврологических заболеваний
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Тиоктовая () кислота синтезируется ворганизме ивыполняет роль коэнзима вокислительном декарбоксилировании [17–19]. Она представляет собой этилендиаминовую соль кислоты, которая, являясь простетической группой мультиферментных комплексов, играет важную роль вметаболизме клетки. Тиоктовая () кислота— эндогенный антиоксидант (связывает свободные радикалы), ворганизме образуется при окислительном декарбоксилировании [18, 19]. Именно этим фактом, впервую очередь, обусловлен возрастающий интерес клиницистов ктиоктовой кислоте, что открывает новые возможности вприменении тиоктовой кислоты втерапии заболеваний ипатологических состояний, воснове которых лежит дисбаланс гомеостаза. Свойство нормализации клеточного метаболизма утиоктовой кислоты реализуется врезультате непосредственной инактивации свободных радикалов засчет ихсвязывания препарата [17]. Утиоктовой кислоты отмечены также свойства, потенцирующие противовоспалительное действие глюкокортикостероидов, ииммуностимулирующее действие. Кроме того, тиоктовая кислота близка пофармакологическим свойствам квитаминам группы Виобладает способностью уменьшать уровень сахара вкрови иувеличивать содержание гликогена впечени [18].
Использование тиоктовой кислоты в медицинской практике в большей степени связано с развитием представлений об «окислительном стрессе» и перекисном окислении липидов как о достаточно универсальном патогенетическом механизме повреждения клеток и тканей [24]. Антиоксидантный эффект тиоктовой кислоты обусловлен наличием двух тиоловых групп в молекуле (отсюда приставка «тио»), а также способностью связывать свободные радикалы и свободное тканевое железо (предотвращая его участие в перекисном окислении липидов) [10]. Тиоктовая кислота не только обладает самостоятельным антиоксидантным потенциалом, но и обеспечивает мощную поддержку работы других антиоксидантных звеньев в организме [23]. В этом отношении ее протективное действие тесно связано с гомеостазом в системе глутатиона и убихинона [8]. Выработка активных форм кислорода значительно возрастает при воспалении, иммунологических расстройствах, гипоксии, гипероксии, воздействии лекарств, излучений, дефиците антиоксидантов.
Тиоктовая кислота является одним из самых сильных антиоксидантов, используемых в лечении диабетической нейропатии [2, 25]. Тиоктовая кислота является коэнзимом ключевых ферментов цикла Кребса, что объясняет ее эффективность. Дополнительным преимуществом в механизме действия тиоктовой кислоты считается ее четко зафиксированный эффект утилизации глюкозы [15]. Высокая эффективность и патогенетическое действие тиоктовой кислоты доказаны многочисленными экспериментальными и клиническими исследованиями. В основе адекватного и рационального применения препаратов тиоктовой кислоты лежат результаты многочисленных исследований (ALADIN I, ALADIN II, ALADIN III, ORPIL, NATHAN, DECAN, SYDNEY), в которых отрабатывалась доза, кратность приема и длительность курса (табл. 1).
В рамках многоцентрового рандомизированного двойного слепого исследования (SYDNEY II) проведена оценка эффективности тиоктовой кислоты в терапии больных с диабетической полинейропатией (ДПН) [1, 3]. Исследование проводилось в период с 2004 по 2006 г., в нем приняли участие 87 пациентов с сахарным диабетом (СД) и типа, находившихся на стационарном (НУЗ ЦКБ № 1 ) и амбулаторном лечении (кафедра эндокринологии ГОУ ДПО РМАПО Росздрава). В ходе исследования SYDNEY сделано заключение, что внутривенное введение кислоты в течение 3 нед. вызывает достоверное ослабление мучительных для пациентов невропатических симптомов и неврологической объективной симптоматики. Учитывая дозозависимый эффект развития побочных явлений, оптимальной является дозировка 600 мг тиоктовой кислоты. Авторы сделали вывод: в результате комплексного исследования пациентов с СД и типа отмечено, что наиболее ранним поражения чувствительного нерва при СД является снижение потенциала действия. Уменьшение боли происходило со нед. приема тиоктовой кислоты в дозе 1800 мг/сут, с нед. приема — в дозе 1200 мг и только к нед. — на фоне приема 600 мг тиоктовой кислоты [3]. У пациентов с ДПН (n=24), участвующих в исследовании, при использовании тиоктовой кислоты в дозе 1800 мг/сут в течение 3 нед. уменьшались нейропатические симптомы и неврологический дефицит, по частоте развития побочных эффектов таковые сопоставимы с группой плацебо [29].
Инструкция по применению препарата Тиогамма® одобрена Фармакологическим государственным комитетом Минздрава России, перерегистрация (для таблетированных форм), (для инъекционных форм) [19]. Препарат назначается 1 р./сут 300–600 мг, принимают его не разжевывая, запивая небольшим количеством жидкости. Согласно данным исследования ALADIN I [28], действие кислоты на позитивные невропатические симптомы в дозах 600 и 1200 мг практически не отличается. В проведенном исследовании при клиническом внутривенном введении кислоты побочные эффекты (головная боль, тошнота, рвота) чаще развивались при дозировке 1200 мг (32,6%), чем 600 мг (19,8%), при введении плацебо (20,7%) [28]. Cделан вывод, что дозировка кислоты в 600 мг и с точки зрения клинической эффективности, и с учетом возможности развития побочных эффектов является оптимальной.
Клиническое использование тиоктовой () кислоты (в частности, Тиогаммы®) основано на множестве биохимических и физиологических эффектов этого вещества [6]. Основные механизмы действия Тиогаммы®, согласно изложенным в Методических рекомендациях (2004) [8], могут быть представлены следующим образом:
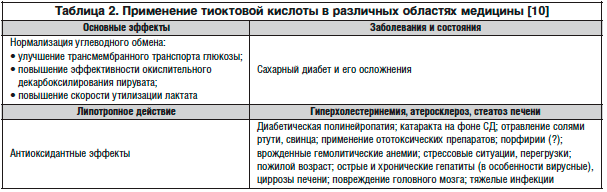
Основные показания к применению препарата Тиогамма® в лечении заболеваний, сопровождающихся неврологической симптоматикой, сфокусированы на диабетической и алкогольной полинейропатии [18]. В настоящее время тиоктовая () кислота, в частности Тиогамма®, является наиболее эффективным средством в лечении периферической полинейропатии, что подтвердили широкомасштабные многоцентровые многолетние исследования, такие как ALADIN Study ( Acid in Diabetic Neuropathy) [16]. Однако антиоксидантная активность тиоктовой кислоты используется во многих областях медицины [10] (табл. 2).
Тиоктовая () кислота является мощным липофильным антиоксидантом и по праву считается «золотым стандартом» патогенетического лечения диабетической полинейропатии (ДПН) [8]. В ряде исследований показано, что применение кислоты в дозе 600 мг/сут внутривенно или перорально в течение от 3 нед. до 6 мес. уменьшает в клинически значимой степени главные симптомы ДПН, включая боль, парестезии и онемение. Известно, что причиной снижения на 50–70% скорости инсулинзависимого трансмембранного переноса глюкозы при СД является окислительный стресс. Основанием для терапии ДПН препаратами тиоктовой () кислоты является тот факт, что при СД имеется дефицит кислоты, а кислота (обладающей мощным антиоксидантным эффектом), в свою очередь, повышает биодоступность глюкозы в инсулинозависимых и инсулинонезависимых тканях, увеличивает поглощение глюкозы периферическими нервами до нормального уровня, а также способствует возрастанию эндоневральных запасов глюкозы, что благоприятно сказывается на восстановлении энергетического метаболизма нервов. Считается, что назначение тиоктовой кислоты целесообразно при инсулинорезистентных формах СД [10]. Оптимальным в этом случае считается назначение в начале лечения внутривенного капельного введения раствора кислоты в течение 3 нед. (15 капельниц) с последующим приемом 600 мг препарата в виде таблеток (1 р./сут за 30–40 мин до еды) в течение 1–2 мес. [8].
Эффективность Тиогаммы® при ДПН убедительно продемонстрирована во многих клинических исследованиях. В Софийском медицинском университете (Болгария) Т. Танковой и соавт. (2000) проведено рандомизированное открытое исследование [7–9] по оценке эффективности препарата Тиогамма® по схеме назначения: после периода внутривенных инфузий препарат назначался внутрь. Использовалась постоянная доза 600 мг/сут, внутривенное введение осуществлялось в течение 10 дней, прием внутрь — еще 50 дней. Выраженный клинический эффект проявляется после первых 10 дней терапии. При сравнении с контрольной группой у пациентов, получавших Тиогамму®, на 40% снизилась интенсивность спонтанных болевых ощущений в ногах, на 35% возросла существенно сниженная до лечения вибрационная чувствительность, определявшаяся в различных зонах стопы. К концу курса терапии отмечена положительная динамика в уменьшении выраженности болевого синдрома по ВАШ, увеличении вибрационной чувствительности. Также получена положительная динамика показателей, характеризующих тяжесть поражения вегетативной нервной системы: за 60 дней терапии проявления вегетативной нейропатии сократились на 40% и в 2,5 раза уменьшилось падение систолического артериального давления при ортостатической пробе, что свидетельствует об улучшении функции вегетативной нервной системы.
В рамках другого моноцентрового рандомизированного двойного слепого исследования обследованы 120 больных СД и типа, из них 60 человек получали плацебо и 60 — кислоту (в дозе 600 мг в 225 мл физиологического раствора при времени внутривенного капельного введения 30–40 мин) [1]. Проведено изучение влияния данного препарата на клинические проявления ДПН, электромиографические (ЭМГ) показатели, показатели количественного сенсорного и автономного тестирования у 60 больных СД и типа. Длительность исследования составила 4 нед. Позитивные нейропатические симптомы были выбраны в качестве основного критерия клинической эффективности исследуемого препарата в связи с тем, что именно они в первую очередь нарушают качество жизни больного. Улучшение показателя дистальной латенции при свидетельствуют о том, что основные неприятные ощущения (боль, жжение, онемение, парестезии), ухудшающие качество жизни больного, уменьшались на фоне терапии кислотой, за счет улучшения функции периферических нервов. Таким образом, показана высокая эффективность препарата в отношении большинства изученных показателей состояния периферических нервов. Сделан вывод о том, что препараты тиокотовой () кислоты могут с успехом использоваться в лечении симптомной ДПН.
В исследовании и соавт. [13], проводимом в кабинете «Диабетическая стопа» Ижевского эндокринологического центра, обследовано 126 пациентов с впервые выявленным СД типа (скрининг), которым назначали препарат тиоктовой кислоты в течение 10 дней внутривенно по 600 мг, в последующем в таблетках по 600 мг ежедневно в течение 8–10 нед. По результатам исследования сделан вывод: препарат тиоктовой кислоты является высокоэффективным в терапии дистальной ДПН, улучшается клиническая симптоматика, состояние периферических нервов, уменьшается окислительный стресс, инсулинорезистентность.
В другом исследовании [14] 50 больным с диабетической и гипотиреоидной дистальной симметричной сенсомоторной полинейропатией назначался препарат Тиогамма® сначала в дозе 600 мг (что эквивалентно 1167,70 меглюминовой соли кислоты) внутривенно, капельно в течение 10 дней по 1 инъекции в день, скорость введения составляла не более 50 мг/мин. Также важно отметить, что отличительной особенностью препарата Тиогамма® является форма выпуска, которая позволяет вводить препарат внутривенно, капельно, не требуя предварительного разведения. Затем в течение 30 дней больные принимали Тиогамму® по 600 мг утром и натощак. В ходе исследования автор пришел к выводу, что среди всех форм ДПН наибольший эффект применения препарата Тиогамма® был отмечен при лечении острой сенсорной полинейропатии и радикулоплексопатии, при лечении прогрессирующей сенсомоторной полинейропатии применение Тиогаммы® также показало статистически значимый терапевтический результат. В отношении гипотиреоидной полинейропатии Тиогамма® показала высокую эффективность, в частности для снижения и устранения болевого синдрома, однако положительная динамика при лечении Тиогаммой® четко коррелировала с адекватной заместительной терапией тиреоидными гормонами.
В исследовании и соавт. (2006) [11] представлены результаты сравнения эффективности двух вариантов терапии ДПН препаратами тиоктовой кислоты: вариант — пероральный прием 1800 мг/сут (600 мг 3 р./сут) в течение 4 нед. (n=15) и вариант — пероральный прием 600 мг/сут в течение 3 мес. (n=15). В ходе исследования было показано, в обоих режимах применения препарат тиоктовой кислоты обеспечивает достоверное снижение выраженности нейропатических жалоб у больных СД с удовлетворительным уровнем компенсации углеводного обмена. По результатам исследования авторы пришли к заключению: «…выбор режима терапии ДПН с использованием препаратов тиоктовой кислоты индивидуален и зависит от конкретной ситуации: при выраженной болевой симптоматике — более короткий по продолжительности курс с высокой дозировкой препарата (1800 мг/сут в течение 4 нед.), при невыраженных симптомах — более длительный курс с меньшей суточной дозировкой (600 мг/сут в течение 3 мес.)…».
Исследования М. Senoglu и соавт. (2009) [27] показали эффективность кислоты в отношении таких клинических симптомов, как боль, парестезии, гипостезия у пациентов с компрессионной радикулопатией вследствие дискорадикулярного конфликта. Данные результатов проведенного исследования коррелируют с исследованием, в котором M. Ranieri и соавт. (2009) [26] оценивали эффективность дополнительного использования комбинации и кислоты в реабилитационной программе пациентов с дискогенной радикулопатией при сравнении с аналогичной группой пациентов, получавших только реабилитационную программу. Описан случай эффективного применения препарата тиоктовой кислоты (600 мг/сут. в течение 1 мес.) в составе комплексной терапии у больного с болезнью Лайма III стадии (нейроборрелиоз, изменения ЦНС, поражение ЧМН, периферическая полинейропатия нейроборрелиозом) [4].
Сотрудниками клиники неврологии и нейрохирургии лечебного факультета РГМУ (ныне РНИМУ) и соавт. (2001–2014) [20–22] проведен ряд исследований по оценке эффективности применения тиоктовой кислоты в терапии больных дисциркуляторной энцефалопатией (ДЭ) и при назначении в комплексной патогенетической терапии сосудистых когнитивных нарушений. На примере исследования 49 пациентов с ДЭ было показано [20], что при назначении препарата тиоктовой кислоты в режиме дозирования 600 мг 2 р./сут в течение 7 дней с переходом на 600 мг 1 р./сут в течение 53 дней перорально за 30 мин до еды позволяет добиться положительного эффекта к сут лечения (при дозе 1200 мг/сут), при снижении дозы до 600 мг/сут (с дня лечения) положительное влияние препарата на динамику неврологического статуса сохраняется и максимально выражено к сут. Отмечена положительная динамика в неврологическом и нейропсихологическом статусах больных ДЭ. По результатам исследования сделан вывод, что тиоктовая кислота эффективна не только при лечении пациентов с ДЭ, имеющих повышенный уровень глюкозы, но и у больных с недостаточностью без СД [20]. При исследовании группы из 128 больных ДЭ [21] проведен фармакоэкономический анализ эффективности лечения препаратом тиоктовой кислоты у больных с разными стадиями хронической церебральной сосудистой недостаточности. Препарат тиоктовой кислоты назначался перорально в суточной дозе 600 мг 2 р./сут в течение 7 дней с переходом на 600 мг 1 р./сут в течение 23 дней за 30 мин до еды. В ходе исследования установлено: у больных ДЭ I ст. — регресс астенического синдрома, вестибулярной атаксии, аксиальных рефлексов; у больных ДЭ II ст. — увеличение эффективности влияния на показатели шкалы «движение», атаксии, псевдобульбарного синдрома; у больных ДЭ III ст. — положительное влияние на показатели шкалы «движение», атаксии (лобной и мозжечковой), псевдобульбарного синдрома, которое сохранялось до мес. наблюдения, а также показано статистически достоверное влияние на динамику балльной оценки амиостатического синдрома. Авторы исследования пришли к выводу, что лечение тиоктовой кислотой у больных ДЭ приводит к значительному клиническому улучшению, снижает риск возникновения инсультов в течение заболевания и уменьшает процент прогрессирования заболевания у больных ДЭ I и II ст. Отмечен незначительный процент возникновения побочных эффектов. Тиоктовая кислота хорошо переносится больными, и пациентами старших возрастных групп. Терапия тиоктовой кислотой предпочтительна с экономической точки зрения по сравнению со стоимостью лечения пациентов контрольной группы, получавших гипотензивную и антитромботическую терапию, что связано с ее высокой эффективностью влияния на риск возникновения ТИА, инсультов и прогрессирование ДЭ.
Заключение
Имеющиеся сегодня данные позволяют рекомендовать назначение врачом препарата Тиогамма® в лечении пациентов с нейропатией соматогенного происхождения. С высокой степенью эффективности успешно применяется разработанная схема назначения препарата Тиогамма®: внутривенные инфузии готового раствора препарата Тиогамма® в течение 10 дней (во флаконах 50 мг раствора для инфузий 12 мг/мл, что эквивалентно 600 мг тиоктовой кислоты, при времени внутривенного капельного введения 30–40 мин) с последующим назначением таблетированной формы препарата (600 мг/сут) в течение 50 дней. С точки зрения клинической эффективности и с учетом возможности развития побочных эффектов дозировка тиоктовой () кислоты в 600 мг/сут является оптимальной. Индивидуальный подход режима дозирования: при выраженной болевой симптоматике — более короткий по продолжительности курс с высокой дозировкой препарата (1800 мг/сут в течение 4 нед.), при менее выраженных симптомах — более длительный курс с меньшей суточной дозировкой (600 мг/сут в течение 3 мес.).
Важно отметить, что отличительной особенностью препарата Тиогамма® является форма выпуска, которая позволяет вводить препарат внутривенно, капельно, не требуя предварительного разведения.
Только для зарегистрированных пользователей
Альфа-липоевая кислота — спектр клинического применения
О. В. Воробьева
Профессор кафедры нервных болезней факультета послевузовского профессионального образования ГОУ ВПО «Московская медицинская академия им. И. М. Сеченова» Росздрава РФ
Резюме
Альфа-липоевая кислота (АЛК) — естественный антиоксидант, представляет собой кислоту жирного ряда, которая находится в каждой клетке человеческого тела. С лечебными целями АЛК используется с середины двадцатого века. В работе приведен обзор клинических исследований эффективности АЛК при различных клинических состояниях, ассоциированных с оксидантным стрессом.
Ключевые слова: альфа-липоевая кислота, оксидантный стресс, диабетическая невропатия.
Summary
Alpha lipoic acid (ALA) is a natural antioxidant, a fatty acid that is found in every cell of human body. ALA is used for treatment since the mid-twentieth century. The article provides an overview of the clinical studies of ALA effectiveness in different clinical conditions associated with oxidative stress.
Key words: alpha-lipoic acid, oxidative stress, diabetic neuropathy.
История открытия АЛК
Альфа-липоевая кислота (АЛК) была открыта Snell et al. в 1937 году, когда он обнаружил что определенные бактерии нуждаются для роста в экстракте картофеля [1]. В 1951 году Reed et al. выделили так называемый картофельный фактор роста (АЛК), и вскоре было показано участие АЛК как коэнзима в цикле Кребса и в элиминации свободных радикалов [2, 3]. Изначально АЛК была известна как незаменимый биохимический кофактор для митохондриальных ферментов. Однако в последнее десятилетие было обнаружено, что АЛК и промежуточный продукт ее обмена дигидролипоевая кислота являются мощными антиоксидантами. Приблизительно с 1980-х годов большинством исследователей АЛК признается одним из самых мощных антиоксидантов.
Индуцированный гипергликемией оксидантный стресс и АЛК
Роль оксидантного стресса глубоко изучена на модели экспериментального диабета и у больных, страдающих сахарным диабетом. Повышение уровня глюкозы у лиц, страдающих сахарным диабетом, приводит к нарастанию конечных продуктов гликирования (AGE). Этот процесс, определяемый как аутоокислительная гликолизация, рассматривается как главная причина повышения продукции свободных радикалов у больных диабетом [4]. Кроме того, ауто-окислительная гликолизация может быть ответственна за снижение доступности и активности антиоксидантных энзимов. Дополнительно фруктоза, уровень которой повышается из-за активации полиолого пути метаболизма, служит источником предшественников AGE. Повреждающий эффект аккумулированных конечных продуктов гликирования (AGE) осуществляется благодаря их связыванию со специфическими рецепторами оболочки нервного волокна и активации нуклеарного фактора кВ (NF-kB). Одним из эффектов NF-kB является стимулирование выделения субстанций, ухудшающих кровоток, например, эндотелина-1 [5, 6]. Напротив, антиоксиданты ингибируют NF-kB. Индуцированный гипергликемией оксидантный стресс способствует программированной гибели швановских клеток, что является дополнительным патогенетическим фактором развития диабетической нейропатии. Например, при добавлении глюкозы в культуру клеток ганглия заднего корешка повышается частота программированной гибели швановских клеток [7]. Свободные радикалы нарушают деятельность клеточных структур, в том числе и эндотелия, вызывая эндоневральную гипоксию и ускоряя развитие невропатии.
АЛК — естественный антиоксидант, представляет собой кислоту жирного ряда, которая находится в каждой клетке человеческого тела. АЛК образуется в организме естественным путем и по химическому строению определяется как 1,2-дитиолан-3-пентаноевая кислота (С8 Н14 02S2). У людей АЛК синтезируется в печени и других тканях. Дополнительным источником АЛК являются пищевые продукты. Она содержится в следующих продуктах: красное мясо, печень, зеленые овощи, картофель, дрожжи. Эндогенный уровень АЛК у здоровых лиц составляет 1-25 нг/мл [8]. Но ее синтез снижается с возрастом, а также у лиц с хроническими заболеваниями, включая сахарный диабет и его осложнения, такие как диабетическая нейропатия.
Эта кислота играет важнейшую роль в процессе преобразования глюкозы в энергию. В то же время АЛК — мощный липофильный антиоксидант, эффективность которого доказана как в лабораторных условиях, так и в организме [9]. Основной эффект кислоты — поглощение различных реактивных окисленных субстанций. АЛК — универсальный антиоксидант, поскольку является как водо-, так и жирорастворимой субстанцией. Это свойство обеспечивает преимущество АЛК в протекции различных форм оксидантного стресса, в частности, внутрикле точную защиту. Дополнительным преимуществом АЛК является синергичное взаимодействие с другими антиоксидантами, в том числе витаминами С и Е. Кроме того, АЛК участвует в рециркуляции других антиоксидантов, таких как витамин С, Е и глутатион. Например, АЛК может участвовать в реакциях регенерироции витамина С и глутатиона [10]. Глутатион является одним из основных неферментных механизмов защиты, который может как напрямую реагировать со свободными радикалами, уничтожая их, так и входит в состав ферментной системы глутатионпероксидазы. Совместно с АЛК глутатион играет важную роль в различных клеточных восстановительно-окислительных реакциях. Дополнительным эффектом АЛК является стимуляция фактора роста нерва и соответственно регенерации волокна [11]. Естественная форма АЛК состоит из R-изомера, но синтетическая форма представляет собой рацемическую смесь двух изомеров R-формы и S-формы. Оба изомера имеют различный потенциал. R-форма обладает большими возможностями в утилизации глюкозы. С другой стороны, S-форма демонстрирует лучший аффинитет с глутатион редуктазой.
Анализ вышеизложенных фактов демонстрирует, что оксидантный стресс — конечный путь в повреждении нервного волокна. Поэтому антиоксиданты могут предохранять от индуцированной гликимией дисфункции нервного волокна или улучшать течение диабетической нейропатии. Уникальность АЛК как антиоксиданта заключается в следующих свойствах:
1) способность напрямую элиминировать свободные радикалы;
2) способность к регенерации эндогенных антиоксидантов, таких как глтатион, витамины Е и С;
3) способность редуцировать продукцию свободных радикалов, благодаря метал-хелатной активности.
АЛК в клинической практике
С лечебными целями АЛК впервые начали использовать в 1966 году клиницисты Германии для лечения диабетической полиневропатии и цирроза печени, потому что имелись наблюдения о низком уровне АЛК у этой категории пациентов [12]. На животных моделях экспериментального диабета было доказано, что АЛК улучшает невральное кровообращение и проводимость сигнала по нерву [13]. Эти позитивные результаты способствовали немедленному проведению клинических исследований эффективности АЛК в лечении диабет-индуцированной полиневропатии. За десятилетия использования АЛК накоплены многочисленные доказательства эффективности данного препарата в отношении симптомов диабетической полинейропатии. Препарат хорошо переносится больными, терапия им безопасна.
АЛК — препарат выбора для лечения диабетической невропатии.
В 1990-х годах проведены основополагающие исследования эффективности и безопасности АЛК для лечения диабетической невропатии с соблюдением требований доказательной медицины. В первом крупном исследовании ALADIN оценивались три дозы АЛК. Исследование включало 328 больных со вторым типом сахарного диабета. Пациенты получали внутривенно 1 200 мг, 600 мг, 100 мг или плацебо в течение трех недель. Улучшение симптоматики на 30 % и более наблюдалось у 71 % пациента, получавших 1 200 мг АЛК в сутки; у 82 % пациентов, получавших 600 мг АЛК в сутки; у 65 % пациентов, получавших 100 мг АЛК в сутки; у 58 % пациентов, получавших плацебо. Во втором исследовании, названном ALADIN II, анализировались результаты лечения 65 пациентов, получавших две дозы таблетированной АЛК (600 мг/день или 1 200 мг/день) или плацебо свыше двух лет. В исследовании были получены убедительные доказательства клинического улучшения симптомов невропатии. Основным показателем выраженности ДПН служили баллы по шкале Total Symptom Score (TSS), которая позволяла оценить интенсивность и частоту в течение последних 24 часов основных позитивных невропатических симптомов, таких как стреляющая боль, жжение, онемение и парестезии. На основании этих позитивных результатов был разработан дизайн исследования ALADIN III, в котором проверялась гипотеза об эффективности короткого курса интервенозного введения АЛК с последующим длительным курсом таблетированного приема АЛК для лечения диабетической нейропатии [14]. В этом исследовании пациенты получали 600 или 1 200 мг АЛК в день в течение трех недель с последующим приемом таблетированной формы 1 800 мг/день в течение шести месяцев. Результаты продемонстрировали устойчивую тенденцию улучшения болевого синдрома, но не достигли статистической достоверности. Но исследование ORPIL, в котором пациенты с сахарным диабетом второго типа получали 1 800 мг/день, показало достоверное улучшение эндоневральной функции после трех недель лечения [15]. Кроме того, благодаря исследованию SYDNEY было доказано влияние АЛК на сенсорные симптомы диабетической полиневропатии. В исследовании SYDNEY участвовали пациенты со стабильным диабетом, осложненным сенсомоторной невропатией, которые получали интравенозно 600 мг АЛК или плацебо пять дней в неделю, в целом 14 вливаний [16]. После лечения наблюдалось значимое улучшение по шкале Total Symptom Score (TSS, оценивает основные позитивные невропатические симптомы) на 5,7 пунктов в группе активного лечения по сравнению с группой плацебо на 1,8 пунктов (P 0,05) тенденция к более выраженному увеличению скорости проведения импульса по чувствительным и двигательным нервам, а также амплитуд моторных и сенсорных ответов в основной группе.
Дополнительные клинические возможности использования АЛК
Конечно, основное показание для использования АЛК — это сахарный диабет и связанные с нарушением обмена глюкозы осложнения, включая в первую очередь нейропатию и катаракту. Дополнительно АЛК улучшает возможности организма для утилизации глюкозы, что способствует снижению зависимости от инсулина. Но благодаря своим свойствам АЛК обеспечивает высокую протекцию против окислительных процессов, что позволяет использовать АЛК в лечебных целях при широком спектре заболеваний.
АЛК и компрессионно-ишемическая радикулопатия
На животных моделях (сдавление седалищного нерва крысы) доказан протективный эффект АЛК в отношении редукции оксидантного стресса при травматическом повреждении нервного волокна [23]. Эти находки позволяют обсуждать использование АЛК для лечения боли в спине, ассоциированной с радикулопатией. Наиболее частой причиной радикулопатии и радикулярной боли является поясничные грыжи межпозвонкового диска. Повреждение нервного волокна зависит от длительности сдавления. Последовательный паттерн аксональной дегенерации и деградации миелина и последующей быстрой регенерации характерен для повреждения периферического нерва. Неоспоримым фактом является повышение свободных радикалов после повреждения ткани [23]. Повышенная продукция свободных радикалов в условиях неэффективного баланса клеточных антиоксидантных систем приводит к дополнительному прямому повреждению фосфолипидов мембран клетки, митохондрий, а также клеточных белков. Пероксид дисмутаза — одна из протективных систем, защищающая клетки от повреждения, связанного со свободными радикалами. Пероксид дисмутаза принадлежит к семейству метаталлопротеиназ. Она катализирует дисмутацию свободных радикалов, конечными продуктами которой являются вода и пероксид водорода, последний нейтрализуется благодаря активности каталазы. На экспериментальной модели поврежденного нервного волокна показано повышение активности пероксид дисмутазы и каталазы, что может быть ответом, нивелирующим оксидантный стресс. Несмотря на отсутствие полного понимания тонких механизмов повреждения нервного волокна, имеющихся на сегодняшний день фактов достаточно для предположения, что АЛК может повышать антиоксидантную защиту поврежденного волокна. Действительно, недавние исследования показали эффективность АЛК в отношении таких клинических симптомов как боль, парестезии, гипостезия у пациентов с компрессионной радикулопатией, вследствие диско-радикулярного конфликта [24]. Эти данные Senoglu et al. (2009) коррелируют с другим исследованием, в котором оценивалась эффективность дополнительного использования комбинации АЛК и гамма-линоленовой кислоты в шестинедельной реабилитационной программе у пациентов с дискогенной радикулопатией по сравнению с аналогичной группой пациентов, получавших только реабилитационную программу [25]. Дополнительные преимущества антиоксидантной терапии были продемонстрированы в отношении редукции боли и связанными с ней функциональными нарушениями (Visual Analogue Scale, Oswestry Low Back Pain Disability Questionnaire, Aberdeen Back Pain Scale, Revised Leeds Disability Questionnaire, Roland and Morris Disability Questionnaire), а также в отношении улучшения качества жизни (Short Form Health Survey [36].
АЛК и алкогольная невропатия
Антиоксидантная терапия рассматривается как один возможных путей лечения токсических эффектов алкоголя на нервную систему. Однако, хотя имеется масса публикаций о доказанном терапевтическом действии АЛК при диабетической полиневропатии, работы по изучению эффективности АЛК при АП пока единичны. Показано, что АЛК эффективна у 70 % пациентов с АП, влияя на сенсорные и моторные симптомы и оказывая также положительный эффект на мучительные для больных болевые и парестетические проявления АП [26]. При анализе эффективности и переносимости АЛК в сравнении с тиамином было обнаружено, что АЛК достоверно эффективнее витамина В1 по клиническим и электрофизиологическим показателям и рекомендована для широкого применения для терапии АП [27]. Лечение АЛК можно считать этиотропным, так как препарат влияет на один из основных этиологических факторов формирования полиневропатии при хроническом алкоголизме — оксидантный стресс. Кроме того, имеются доказательства прямого эффективного действия АЛК при этанол-обусловленной нейротоксичности in vivo [28].
АЛК и вибрационная болезнь
К числу основных симптомов вибрационной болезни относят сосудистые расстройства, проявляющиеся нарушениями периферического кровообращения, изменением тонуса капилляров, нарушением общей гемодинамики, а также развитием вегетативно-сенсорной полинейропатии конечностей. Ишемия эндоневрия запускает процессы оксидантного стресса, играющие важную роль в повреждении нервного волокна. Этот факт открывает новые возможности использования антиоксидантной терапии для лечения вибрационной болезни. На кафедре профессиональных заболеваний Санкт-Петербургской государственной медицинской академии им. И. И. Мечникова было проведено сравнительное, открытое рандомизированное исследование эффективности «Тиолепты» в дозе 600 мг/сут. (длительность курса 21 день) для лечения вибрационной болезни с вегетативно-сенсорной полинейропатией [29]. Дополнительное введение в терапию «Тиолепты» привело к снижению частоты субъективных жалоб пациентов, к стойкому уменьшению рецидивов болевого синдрома в конечностях, урежению частоты приступов ангиоспазмов. В группе пациентов, получавших «Тиолепту», имелась значимая позитивная динамика (р ЛИТЕРАТУРА
1. Snell EE, Strong FM, Peterson WH. Growth factors for bacteria. VI: Fractionation and properties of an accessory factor for lactic acid bacteria. Biochem J 1937. 31 (10):1789-1799.
2. Reed LJ, DeBusk BG, Gunsalus IC, Hornberger CSJr. Cristalline alpha-lipoic acid: a catalytic agent associated with pyruvate dehydrogenase. Science 1951. 114 (2952):93-94.
3. Reed LJ. The chemistry and function of lipoic acid. Adv Enzymol 1957. 18:319-347.
4. Sen CK. Redox signaling and the emerging therapeutic potential of thiol antioxidants. Biochem Pharmacol 1998.55 (11): 1747-1758.
5. Kihara M, Low P A Impaired vasoreactivity to nitric oxide in experimental diabetic neuropathy Experimental Neurology, 1995, v 132, 180-185.
6. Kowluru RA. Effect of advanced glycation end products on accelerated apoptosis of retinal capillary cells under in vitro conditions. Life Sci. 2005 Jan 14;76 (9):1051-60.
7. Miinea C, Eichberg J. Antioxidant protection mechanisms and arachidonic acid synthesis are altered in Schwann cells grown in elevated glucose. Fifth Diabetic Neuropathy Satellite Symposium 2000. 32.
8. Teichert J, Preiss R. HPLC-methods for determination of lipoic acid and its reduced form in human plasma. Int J Clin Pharmacol Ther Toxicol. 1992;30:511-512.
9. Packer L, Tritschler HJ, Wessel K. Neuroprotection by the metabolic antioxidant alpha-lipoic acid. Free Radic Biol Med. 1997;22:359-378.
10. Packer L, Witt EH, Tritschler HJ. „ Alpha-Lipoic acid as a biological antioxidant. “ Free Radic Biol Med 1995 Aug;19 (2):227-50.
11. Murase K, Hattori A, Kohno M, Hayashi K. Stimulation of nerve growth factor synthesis/secretion in mouse astroglial cells by coenzymes. Biochem Mol Biol Int 1993.30:615-621.
12. Biewenga GP, Haenen GR, Bast A. The pharmacology of the antioxidant lipoic acid.//Gen Pharmacol 1997;29:315-331.
13. Coppey LJ, Gellett JS, Davidson EP, et al. Effect of antioxidant treatment of streptozotocin-induced diabetic rats on endoneurial blood flow, motor nerve conduction velocity, and vascular reactivity of epineurial arterioles of the sciatic nerve. Diabetes. 2001;50:1927-1937.
14. Ziegler D, Hanefeld M, Ruhnau KJ, et al. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpha-lipoic acid: a 7-month multicenter randomized controlled trial (ALADIN III Study). ALADIN III Study Group. Alpha-Lipoic Acid in Diabetic Neuropathy. Diabetes Care. 1999;22:1296-1301.
15. Ruhnau KJ, Meissner HP, Finn JR, et al. Effects of 3-week oral treatment with the antioxidant thioctic acid (alpha-lipoic acid) in symptomatic diabetic polyneuropathy. Diabet Med. 1999;16:1040-1043.
16. Ametov AS, Barinov A, Dyck PJ, et al. SYDNEY Trial Study Group. The sensory symptoms of diabetic polyneuropathy are improved with alpha-lipoic acid: the SYDNEY trial. Diabetes Care. 2003;26:770-776.
17. Yadav V, Marracci G, Lovera J, et al. Lipoic acid in multiple sclerosis: a pilot study. Mult Scler. 2005;11:159-165.
18. Ziegler D, Nowak H, Kempler P, Vargha P, Low PA. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpha-lipoic acid: a meta-analysis.//Diabet Med 2004;21 (2):114-121.
19. Ziegler D, Ametov A, Barinov A, Dyck PJ, GurievaI, Low PA, Munzel U, Yakhno N, Raz I, Novosadova M, et al. Oral treatment with alpha-lipoic acid improves symptomatic diabetic polyneuropathy. The SYDNEY 2 trial. Diabetes Care 2006. 29:2365-2370.
20. Ziegler D. Thioctic acid for patients with symptomatic diabetic neuropathy: a critical review. Treat Endocrinol 2004.3 (3):173-189.
21. Строков И. А., Ахметжанова Л. Т., Солоха О. А. Эффективность лечения диабетической полиневропатии таблетированной формой альфа-липоевой кислоты. Трудный пациент 2010; 8 № 3:17-21.
22. Баранцевич Е. Р., Посохина О. В. Подходы к терапии неврологических проявлений сахарного диабета. Журнал неврол. и психиатр им. С. С. Корсакова 2010;110 № 4:63-66.
23. Senoglu M, Nacitarhan V, Kurutas EB, Senoglu N, Altun I, Atli Y, Ozbag D. Intraperitoneal Alpha-Lipoic Acid to prevent neural damage after crush injury to the rat sciatic nerve. J Brachial Plex Peripher Nerve Inj. 2009;4:22.
24. Ranieri M, Sciuscio M, Cortese AM, Santamato A, Di Teo L, Ianieri G, Bellomo RG, Stasi M, Megna M. The use of alpha-lipoic acid (ALA), gamma linolenic acid (GLA) and rehabilitation in the treatment of back pain: effect on health-related quality of life. Int J Immunopathol Pharmacol. 2009;22 (3 Suppl):45-50.
25. Ranieri M, Sciuscio M, Cortese AM, Santamato A, Di Teo L, Ianieri G, Bellomo RG, Stasi M, Megna M. The use of alpha-lipoic acid (ALA), gamma linolenic acid (GLA) and rehabilitation in the treatment of back pain: effect on health-related quality of life. Int J Immunopathol Pharmacol. 2009;22 (3 Suppl):45-50.
26. Скляр И. А., Воробьева О. В., Шаряпова Р. Б., Садеков Р. К. Тиоктацид в лечении алкогольной полиневропатии. Лечение нервных болезней 2001; 2: 39-41.
27. Ковражкина Е. А., Айриян Н. Ю., Серкин Г. В., Глушков К. С., Павлов Н. А., Гехт А. Б., Стаховская Л. В., Скворцова В. И. Возможности и перспективы применения берлитиона для лечения алкогольной полиневропатии. Журн Неврол и психиатр им. С. С. Корсакова 2004; 104: 2: 33-37.
28. Pirlich M, Kiok K, Sandig G, Lochs H, Grune T. Alpha-lipoic acid prevents ethanol-induced protein oxidation in mouse hippocampal HT22 cells. Neurosci Lett. 2002 Aug 9;328 (2):93-6.
29. Артамонова В. Г. Лашина Е. Л. Применение препарата тиолепта (тиоктовая кислота), в комбинированной терапии вибрационной болезни. Журн Неврол и психиатр им. С. С. Корсакова 2011; 111: 1: 82-85.
30. Han D, Tritschler HJ, Packer L. Alpha-lipoic acid increases intracellular glutathione in a human T-lymphocyte Jurkat cell line. Biochem Biophys Res Commun 1995 Feb 6;207 (1):258-64.
31. Baur A et al., Alpha lipoic acid is an effective inhibitor of human immuno-deficiency virus (HIV-1) replication, Klin Wochenschr 69 (1991): 722-4.
32. Perricione N. The Wrinkle Cure, Chapter 6 «Alpha Lipoic Acid» pp.71-72. Warner Books., 2000.
33. Cao X and Phillis JW. Free Radical Research 1995; 23:365.
34. Marracci GH, Jones RE, McKeon GP, Bourdette DN. «Alpha Lipoic Acid inhibits T cell migration into the spinal cord and suppresses and treats experimental autoimmune encephalomyelitis.» Journal of Neuroimmunololgy, October2002;131 (1-2):104-14.
35. Hummel T, Heilmann S, Huttenbriuk KB., «Lipoic acid in the treatment of smell dysfunction following viral infection of the upper respiratory tract.» Laryngoscope 2002 Nov;112 (11):2076-80.
36. Logan AC, Wong C. «Chronic fatigue syndrome: oxidative stress and dietary modifications.» Alternative Medicine Review Oct 2001;6 (5):450-9.
37. Peltier AC, Russell JW. Advances in understanding drug-induced neuropathies. Drug Saf 2006;29 (1):23-30.
38. Gedlicka C, Kornek GV, Schmid K, Scheithauer W. Amelioration of docetaxel/cisplatin induced polyneuropathy by alpha-lipoic acid. Annals of Oncology 2003;14:339-340.
39. Phase III Randomized Study of Alpha-Lipoic Acid in Preventing Platinum-Induced Peripheral Neuropathy in Cancer Patients Receiving a Cisplatin- or Oxaliplatin-Containing Chemotherapy Regimen (MDA-CCC-0327).
40. Al-Majed, AA. Gado, AM, Al-Shabanah, OA, and Mansour, AM. «Alpha-lipoic Acid Ameliorates Myocardial Toxicity Induced by Doxorubicin.» Pharmacol Res December 2002;46 (6):499-503.
41. Mijnhout G. S., Alkhalaf A., Kleefstra N., Bilo H. J. G. The Netherlands Journal of Medicine 2010; 68 (4): 158-162.