Анеуплоидные эмбрионы что такое
ПГТ хромосомных анеуплоидий
Что такое анеуплоидия?
Анеуплоидия — нарушение числа хромосом в диплоидном наборе, когда в одной из пар гомологичных хромосом (а иногда и в нескольких) появляется лишняя хромосома, либо одна из хромосом исчезает. Эта аномалия известна как наиболее часто встречающаяся у доимплантационных эмбрионов.
Типы анеуплоидий – трисомии (лишняя хромосома), моносомии (отсутствие одной из парных хромосом). Эмбрионы с дефицитом (моносомия) или избытком (трисомия) отдельных хромосом возникают, главным образом, вследствие оплодотворения яйцеклетки с хромосомным дисбалансом.
Анеуплоидии всегда клинически значимы, то есть, так или иначе патологически проявляются. Их проявления могут выражаться в отсутствии имплантации, прерывании беременности, нарушениями эмбриогенеза и рождению ребенка с хромосомной патологией.
При этом:
С возрастом риск возникновения анеуплоидной патологии у женщины существенно возрастает. Так, риск трисомий после 40-ленего возраста женщин имеется у каждой из 63-х, а в 45 лет – уже у каждой из 20.
Таргетные (целевые) исследования всего лишь нескольких хромосом из полного набора у эмбриона не оправдывают себя лишь в том, что они не охватывают остальные хромосомы, не дают полной картины по всем возможным анеуплоидиям.
В нашем центре мы предложим молекулярное кариотипирование эмбриона (исследование набора хромосом эмбриона), включающее исследование на анеуплоидии полного набора хромосом по доступной цене. Это оправдано не только с клинической точки зрения, но и с экономической.
Причины, формы и диагностика анеуплоидии
Анеуплоидией называют изменение кариотипа, когда число хромосом некратно гаплоидному набору. Это приводит к нарушению эмбрионального развития, является частой причиной самопроизвольных выкидышей, может вызывать некоторые наследственные синдромы.
Причины анеуплоидии
Изменение кариотипа вызывают нарушения сегрегации хромосом в митозе или мейозе. В случае если гомологичные хромосомы одной или нескольких пар в анафазе I мейоза не расходятся, то развивается врожденная анеуплоидия.
Если половая клетка с лишней или недостающей хромосомой сливается с нормальной гаплоидной гаметой, то образовавшаяся зигота несет клетки с нечетным количеством хромосом. Зигота, имеющая число хромосом, меньше нормального диплоидного набора, обычно не развивается. Плодное яйцо с лишними хромосомами способно к развитию, но в большинстве случаев развитие сопровождается серьезными аномалиями.
По типу вовлеченных хромосом различают анеуплоидию половых хромосом и аутосомную. Первая характеризуется более мягкими фенотипическими проявлениями.
Выделяют также такие формы, как моносомия — отсутствие в диплоидном организме одной хромосомы, нуллисомия — отсутствие двух гомологичных хромосом, трисомия — наличие дополнительной хромосомы. Нарушения в сфере половых хромосом могут иметь формы тетрасомии и пентасомии (встречаются крайне редко).
Синдромы, связанные с анеуплоидией
Моносомия по Х-хромосоме является причиной синдрома Шерешевского-Тернера. Таким нарушением страдают исключительно женщины. Они имеют нормальное интеллектуальное развитие и ведут полноценный образ жизни, однако для больных характерны бесплодие, пороки развития внутренних органов и другие внешние признаки хромосомной патологии.
Жизнеспособная форма трисомии возможна только по хромосоме 21, однако она приводит к развитию синдрома Дауна. Трисомия по хромосоме 13 является причиной синдрома Патау, по хромосоме 18 — синдрома Эдвардса. Они характеризуются ранней постнатальной смертностью.
Трисомии половых хромосом встречаются чаще. Одной из форм подобного типа анеуплоидии является синдром Клайнфельтера. Для него характерно наличие мужской Y-хромосомы при одной или двух лишних Х-хромосомах. Страдающие синдромом Клайнфельтера вследствие анеуплоидии — мужчины, имеющие некоторые женские вторичные половые признаки. Обычно они бесплодны и имеют низкий уровень интеллектуального развития.
Синдром трипло-X является такой формой анеуплоидии, при которой у женщины присутствует лишняя Х-хромосома. В основном больные имеют нормальное физическое и психическое развитие, хромосомные аномалии у них выявляются, как правило, случайно. При синдроме трипло-X анеуплоидия не приводит к аномалиям полового развития, однако повышен риск спонтанных выкидышей и хромосомных патологий у потомства. Лишь у некоторых женщин присутствуют нарушения репродуктивной функции.
Лишняя Y-хромосома у мужчин является синдромом, при котором анеуплоидия развивается вследствие слияния нормальной яйцеклетки со сперматозоидом, являющимся носителем второй Y-хромосомы. Патология выявляется случайно, обычно носители не знают о ее наличии. Для таких мужчин характерен более высокий рост, небольшие нарушения координации движений, у половины из них имеются трудности с обучением, нарушения речи и письма.
Диагностика анеуплоидий
Риск рождения ребенка с хромосомной аномалией даже у полностью здоровых родителей составляет 5 %. Поэтому так важно выявить возможные аномалии, в т. ч. анеуплоидии, вызывающие наследственные синдромы, на раннем сроке беременности.
Заранее оценить риски помогают скрининговые тесты и УЗИ. Они не дают точной информации о наличии хромосомной патологии, но позволяют выявить беременных группы риска. Наиболее точный диагноз помогает установить неинвазивный пренатальный тест (НИПТ).
В медико-генетическом центре «Геномед» вы можете пройти такое исследование. НИПТ позволяет диагностировать анеуплоидии, в т. ч. трисомии, моносомии, численные аномалии половых хромосом. Точность исследования достигает 99 %. Благодаря тесту можно исключить наличие у будущего ребенка таких заболеваний, как синдромы Дауна, Эдвардса, Патау, Тернера и т. д.
Для того чтобы провести НИПТ и обнаружить/исключить анеуплоидии, достаточно 15 мл венозной крови будущей матери. Это позволяет избежать инвазивных методов пренатальной диагностики, которые грозят осложнениями.
НИПТ в медико-генетическом центре «Геномед» с высокой достоверностью определяет анеуплоидии, поскольку основан на особом алгоритме обработки сигналов. Он позволяет сравнивать и обнаруживать отличия материнской ДНК, присутствующие в плазме/лейкомассе, с ДНК плода, находящейся только в плазме.
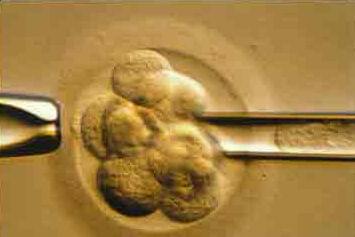
Преимплантационный генетический анализ эмбрионов
Каждая из 100 триллионов клеток в организме человека (за исключением красных кровяных клеток) содержит весь человеческий геном. Хромосомы – это струноподобные элементы внутри ядра (в центре) каждой клетки вашего тела. Они содержат генетическую информацию, ДНК. Ген занимает определенное место на хромосоме. В норме, есть 23 идентичных пары хромосом (2 метра ДНК) в каждой клетке, в общей сложности 46 хромосом. Каждый партнер во время оплодотворения обычно предоставляет 23 хромосомы. Если яйцеклетка или сперматозоид имеют аномальную упаковку хромосом, эмбрион, который они создают, также будет иметь хромосомные аномалии. Иногда это связано с перестройкой хромосом, или недостатком части хромосомы. В некоторых случаях есть отсутствующие хромосомы, или дополнительная хромосома (анеуплоидии), ведущие к наследственным заболеваниям. Любой эмбрион, в котором отсутствует хромосома (моносомия) перестанет расти до имплантации (фатальная аномалия). Если анеуплоидии включают хромосомы 13, 18, 21, Х или Y, беременность может дойти до родов. Наиболее распространенной из этих несмертельных аномалий является трисомия 21, или синдром Дауна, при которой присутствует дополнительная 21-я хромосома. Другие включают синдром Тернера у женщин и синдром Клайнфельтера у мужчин.
История преимплантационной генетической диагностики (ПГД)
Первые живорождения после ПГД были зарегистрированы в Лондоне в 1989 году. Две двойни девочек-близнецов родились от пяти пар с риском передачи связанного с Х-хромосомой заболевания. В настоящее время с помощью методов генетического анализа или ПГД могут быть обнаружены около 90% аномальных эмбрионов. Не все хромосомные или генетические заболевания могут быть определены этими процедурами, так как в ходе одной процедуры может быть диагностировано только ограниченное число хромосом. Многочисленные исследования на животных и некоторые исследования на человеке показывают, что микрохирургия эмбриона (биопсия), необходимая для удаления клеток, не влияет на нормальное развитие ребенка. Эта процедура, однако, была выполнена относительно небольшому числу пациентов во всем мире, поэтому точные негативные последствия, если таковые имеются, неизвестны. Несмотря на то, что после генетического анализа для выявления анеуплоидии всем мире на сегодняшний день было рождено уже много детей, эта процедура все еще относительно нова. В исследованиях на животных не было обнаружено никаких очевидных проблем и предварительные данные с эмбрионами человека позволяют предположить справедливость этого вывода. В исследовании, проведенном в Университетском колледже Лондона, исследователи недавно рассмотрели 12 преимплантационных эмбрионов с новой техникой, которая сочетает в себе амплификацию всего генома (WGA) и сравнительную гибридизацию генома (CGH). В результате в 8 из 12 изученных эмбрионов были обнаружены значительные хромосомные аномалии. Это может объяснить, почему люди имеют в лучшем случае 25% шансов на достижение жизнеспособной беременности в месяц при естественном зачатии.
Как передаются по наследству генетические заболевания
В диаграммах ниже, D или d представляет дефектный ген, а N или n представляет нормальный ген. Мутации не всегда приводят к болезни.
Доминантные заболевания:
Один из родителей имеет один дефектный ген, который доминирует над своей нормальной парой. Так как потомки наследуют половину своего генетического материала от каждого из родителей, есть 50% риск наследования дефектного гена, и, следовательно, заболевания.
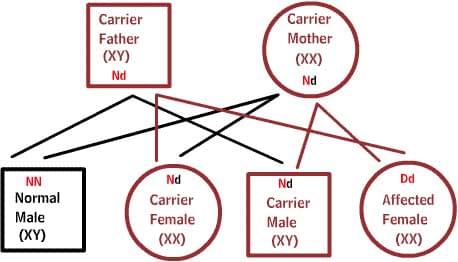
Рецессивные заболевания:
Оба родителя являются носителями одного дефектного гена, но при этом имеют нормальную пару гена. Для наследования заболевания необходимы две дефектных копии гена. Каждый потомок имеет 50% шанс быть носителем, и 25% шанс унаследовать заболевание.
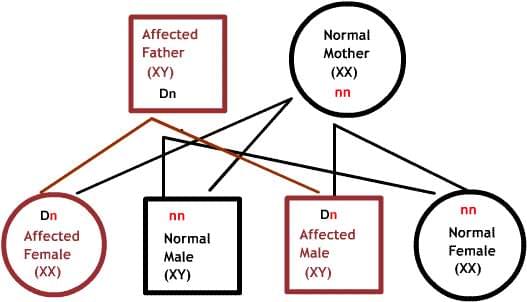
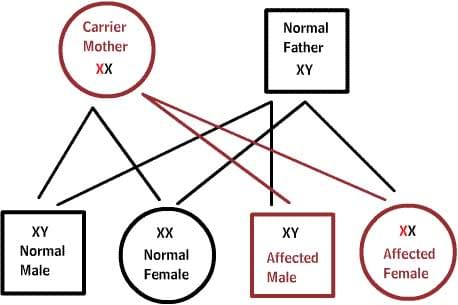
X-сцепленные заболевания:
Нормальные женщины имеют XX хромосомы, а нормальные мужчины XY. Женщины, которые имеют нормальный ген на одной из Х-хромосом, защищены от дефектного гена на их другой Х-хромосоме. Однако, у мужчины отсутствует такая защита в связи с наличием только одной Х-хромосомы. Каждый мужской потомок от матери, которая несет в себе дефект, имеет 50% шанс унаследовать дефектный ген и заболевание. Каждый женский потомок имеет 50% шанс быть носителем, как и ее мать. (на рисунке ниже X представляет нормальный ген а X представляет дефектный ген)
Возможные преимущества генетического анализа
Преимплантационная генетическая диагностика позволяет отобрать и перенести не измененные (хромосомно нормальные) эмбрионы, которые могут привести к большей частоте имплантации на эмбрион, сокращению потерь беременности и рождению большего числа здоровых детей. Генетическая диагностика предлагает парам альтернативу мучительному выбору по поводу того, чтобы прервать пострадавшую беременность после пренатальной диагностики, производимой путем амниоцентеза или биопсии ворсин хориона (CVS) на более поздних стадиях беременности. Почти все генетически связанные заболевания, которые могут быть диагностированы в перинатальном периоде либо амниоцентезом или CVS, могут быть обнаружены и ПГД. Процедура должна уменьшить психологическую травму для пар, которые несут повышенный риск генетических заболеваний для потомства.
Преимущества преимплантационной генетической диагностики (ПГД) могут включать в себя:
Возможные риски генетического анализа
Кандидаты для биопсии эмбриона и ПГД
Кандидаты для биопсии эмбриона и ПГД включают в себя:
Пары с повторными неудачами ЭКО.
Используемые методы
Для анализа на наличие генетических дефектов эмбриона, из него необходимо удалить либо первое полярное тельце из неоплодотворенной яйцеклетки и/или 1 или 2 клетки от каждого эмбриона. Это называется биопсией яйцеклетки или эмбриона и обычно делается перед тем, как происходит оплодотворение, или через 3 дня после оплодотворения. Биопсия на 6-10 клеточной стадии не оказывает отрицательного влияния на преимплантационное развитие. На этом этапе каждая клетка имеет полный набор хромосом. Обычно из эмбриона удаляется только одна клетка, так как ожидается, что будут одинаковыми со всеми другими клетками в эмбрионе. Иногда необходимо удалить вторую клетку из эмбриона, например, если сигнал в первой не обнаружен. Для диагноза предрасположенности с помощью первого и второго полярных телец, как показателей генетического статуса яйцеклетки, используется анализ методом FISH. Недостатком анализа полярных телец заключается в том, что он не принимает во внимание отцовские анеуплоидии.
Анализ биопсированной клетки использует один из двух методов:
Вся информация носит ознакомительный характер. Если у вас возникли проблемы со здоровьем, то необходима консультация специалиста.
Хромосомная анеуплоидия эмбрионов, полученных в циклах ЭКО без стимуляции
W. Verpoest, B.C. Fauser, E. Papanikolaou, C. Staessen, L. Van Landuyt, P. Donoso, H. Tournaye,I. Liebaers и P. Devroey
ПГС все чаще проводится в программах экстракорпорального оплодотворения с целью выявления численных хромосомных аномалий (анеуплоидии) эмбрионов, что направлено на повышение эффективности репродуктивного лечения. В настоящей работе описывается распространенность анеуплоидии среди эмбрионов, полученных в результате нестимулированных циклов ЭКО и ПГС, и беременности, закончившиеся рождением двух живых детей.
В естественном, нестимулированном менструальном цикле у всех пациенток проводилось трансвагинальное ультразвуковое исследование и гормональный анализ сыворотки с определением концентрации ФСГ, лютеинизирующего гормона, эстрадиола и прогестерона. В случае снижения концентрации эстрадиола и одновременного подъема уровня прогестерона овуляцию считали ложной и от забора ооцита отказывались. С целью снижения риска отсутствия оплодотворения во всех циклах использовали ИКСИ.
Оплодотворение оценивали через 18 часов, далее развитие эмбриона оценивали на 2 и 3-й день перед биопсией. Биопсию эмбриона проводили на 6-клеточной или более стадии развития. Проводили анализ хромосом X, Y, 13, 18 и 21 на первом этапе и хромосом 16 и 22 – на втором этапе.
Перенос эмбриона проводили на стадии бластоцисты на 5-й день после забора ооцита. Поддержка лютеиновой фазы не проводилась.
Средний возраст пациенток составил 31,4 года. Показаниями для лечения бесплодия в исследуемой группе служили необъяснимое бесплодие у 12 пациенток, олигоастенотератозооспермия у 17 пациенток и блокада маточных труб у одной пациентки.
Результаты данного исследования, в первую очередь, демонстрируют тот факт, что отсутствие экзогенной стимуляции яичников не исключает возникновения многочисленных хромосомных аномалий эмбрионов. Во многих исследованиях с использованием ооцитов, как животных, так и человека, было подтверждено увеличение частоты анеуплоидии после индукции овуляции. В исследованиях последних лет было показано, что в ооцитах после индукции овуляции имеет место повышенная частота нарушений геномного импринтинга. Возможно, это обусловлено не только исходными материнскими факторами, такими как возраст, но и внешними факторами, в частности, субоптимальными или аномальными биохимическими характеристиками фолликулярной жидкости и развитием цитоплазмы. Кроме того, частота анеуплоидии в ооцитах человека, как известно, существенно выше, чем в ооцитах различных видов животных, что, насколько можно полагать, связано со стимуляцией яичников, поскольку это единственная группа, в которой определялась анеуплоидия ооцитов. Другие факторы, такие как качество спермы и условия культивирования эмбрионов, также могут оказывать влияние на хромосомные характеристики эмбриона, давая толчок таким аномалиям, как мозаицизм. Эти аномалии невозможно исключить, пропуская этап стимуляции яичников.
Во-вторых, исследование подтвердило, что анеуплоидия присутствует в единичных бластомерах эмбрионов молодых женщин в возрасте до 36 лет. Хотя известно, что частота анеуплоидии в возрасте старше 36 лет увеличивается, немногое известно о частоте анеуплоидии у молодых женщин, поскольку ПГС в этой группе обычно не проводится.
Признавая ограничения этого исследования в отношении размера выборки, важно также понимать, что ПГС, будучи единственным доступным средством для оценки хромосомной состоятельности эмбриона, не может считаться оптимальным методом оценки влияния стимуляции яичников на статус хромосом ооцитов. ПГС позволяет оценить всего один или два бластомера эмбриона, который состоит как минимум из шести бластомеров, что является потенциальным источником ошибок, включая диагностику мозаицизма.
Данные настоящего исследования показывают, что исключение стимуляции яичников у молодых женщин не исключает возникновения численных хромосомных аномалий.
Неинвазивная диагностика анеуплоидий у плода: от идеи к продукту
Неинвазивная диагностика анеуплоидий у плода: от идеи к продукту
Яблоня без яблок бесполезна. Без ствола и ветвей яблоня будет без яблок, то есть бесполезна. Яблоня без корней нежизнеспособна.
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Генетические заболевания в разной степени ухудшают качество и продолжительность жизни человека. Иногда их можно и не заметить, если повезет не встретиться с триггером, запускающим каскад поломок в организме. А какие-то генетические нарушения неизбежно приводят к боли, страданиям и смерти. Некоторые из них протекают настолько тяжело, что считаются медицинскими показаниями к искусственному прерыванию беременности. Такие состояния можно детектировать неинвазивно на ранних сроках, что создает основу для этически очень непростого, но осознанного решения родителей о прекращении или продолжении беременности. Число подобных анализов с каждым годом растет, на высококонкурентном рынке соревнуются несколько компаний. В этой заметке рассмотрим способ, применяемый фирмой Natera. При этом важно понимать, что высокотехнологичный коммерческий продукт вырастает из результатов фундаментальных исследований, которые на первый взгляд практической пользы не несут, а лишь удовлетворяют любопытство увлеченных людей.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Академия & Бизнес» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
У всех увлеченных людей есть потребность в удовлетворении своего любопытства. Некоторым из нас везет — это можно делать в рабочее время за счёт денег налогоплательщиков или потребителей. На первый взгляд такой процесс с непредсказуемым результатом может показаться неэффективным расходом ресурсов. Но это не так. Технологические прорывы возникают только тогда, когда кто-то рискует, дает волю своей фантазии и начинает использовать ресурсы неожиданным образом. При этом если результат Его Величества Эксперимента известен заранее, то это уже не эксперимент, а копирование чужой идеи. Замечу, что творческую деятельность сложно выполнять по приказу. «Иванов, до 31 числа жду от тебя пять озарений», — звучит смешно, но реально. Бóльшая часть научных открытий никакой прямой пользу обществу не несет. Фундаментальная наука создает основу для прикладной; конечный результат — статья в рецензируемом научном журнале, то есть идея с зафиксированным приоритетом. Прикладная же наука скорее использует эти статьи в попытке найти им применение; конечный результат — патент, то есть защищенный от копирования вариант использования идеи. Патенты могут быть востребованы бизнесом для создания коммерчески доступных продуктов, которые удовлетворяют нужды потребителей и приумножают вложенный капитал. Получается пирамида «ворох идей → горсть применений → щепотка продуктов». Не идеально, но ничего эффективнее нет — только так идеи становятся коммерчески доступными продуктами [1]. В этой заметке рассмотрим один из успешных примеров, (слегка) изменивших мир.
А в чем проблема?
В 2004 году моя сестра родила сына с синдромом Дауна. Ребенка не стало через шесть дней после рождения. Это был опустошающий опыт для всей нашей семьи. Я основал компанию Natera, потому что верю, что все семьи заслуживают доступа к технологиям, которые предлагают раннее обнаружение генетических заболеваний.
Качество и продолжительность жизни зависит от генетических особенностей индивидуума и давления внешней среды. Некоторые генетические нарушения могут настолько сильно ухудшить физическое, душевное и социальное благополучие человека, что считаются медицинскими показаниями к искусственному прерыванию беременности.
В ядре человеческой клетки в норме 23 пары хромосом. Одну хромосому из каждой такой пары мы получаем от папы, а вторую — от мамы. А потом передаем своим детям 23 хромосомы, скомпонованные из отцовских и материнских хромосом. А второй родитель добавляет другой перемешанный вариант 23 хромосом. В результате встречи двух гамет (сперматозоида и яйцеклетки) может образоваться эмбрион с 23 парами хромосом. Но иногда что-то идет не так, и у нового организма общее число хромосом отличается от 46-и. Такое нарушение называют анеуплоидией (строго говоря, это «некратное увеличение набора хромосом»). В самых тяжелых случаях эмбрион в принципе не будет развиваться, имплантации не произойдет — и женщина даже не заметит признаков не начавшейся беременности [2]. Иногда беременность наступит, но преждевременно прервется — произойдет выкидыш [3]. А при некоторых анеуплоидиях (например, синдроме Дауна) эмбрион разовьется, и беременность может завершиться родами. Часть родителей отказывается от детей с особенностями развития, часть посвящает себя уходу за ребенком. Современные методы позволяют диагностировать анеуплоидии на ранних стадиях развития плода, что, повторюсь, является медицинским показанием к искусственному прерыванию беременности. Результат такого анализа может стать основой для этически очень непростого, но осознанного решения родителей о прекращении или продолжении беременности. Отмечу, что синдром Дауна — далеко не единственный результат анеуплоидий. Также, например, возможно развитие синдромов Эдвардса, Патау и других генетических отклонений от условной нормы.
Как диагностировать анеуплоидии?
Достоверно диагностировать анеуплоидию можно только определив число хромосом в геноме плода. Но как безопасно получить биоматериал? Человеческий эмбрион развивается в амниотической полости. Этот мешок окружен плодными оболочками, внутренняя часть которых называется амнионом. Кстати говоря, в русском языке есть выражение «в рубашке родился». Такой «рубашкой» (рис. 1) называют неразорвавшиеся во время родов плодные оболочки. Эмбрион плавает в околоплодных водах (амниотической жидкости), в которой есть отмершие клетки плода. В результате анализа генома этих клеток можно посчитать число хромосом нового организма.
Рисунок 1. «В рубашке родился»!
Амниотическую жидкость для анализа получают в результате амниоцентеза. Такая инвазивная процедура заключается в проколе амниотической оболочки и заборе околоплодных вод для анализа. Надо отметить, что амниоцентез может провоцировать выкидыши. Вероятность такого неблагополучного исхода беременности составляет примерно 30 случаев на 10 000 процедур [4]. Существуют и другие способы инвазивной пренатальной диагностики с сопоставимыми рисками. При этом в среднем из 10 000 новорожденных 13 появляются на свет с синдромом Дауна [5]. Это значит, что, грубо говоря, инвазивная диагностика скорее приведет к выкидышу, чем выявит анеуплоидии плода.
Как неинвазивно диагностировать анеуплоидии?
В 1969 году в крови беременной женщины обнаружили клетки, содержащие Y-хромосомы [6]. В результате родов на свет появился мальчик. Таким образом, стало понятно, что клетки плода могут находиться в крови беременной женщины. Тем не менее таких клеток мало, что затрудняет разработку рутинных диагностических тестов [7]. Затем в 1997 году фетальную (от лат. fetus — плод) ДНК обнаружили в плазме крови беременных женщин [8]. Отмечу, что плазма — это жидкая бесклеточная фракция крови, в которой взвешены форменные элементы, то есть клетки крови. Таким образом, в результате такой малоинвазивной процедуры, как забор крови беременной женщины, можно исследовать ДНК плода. Тем не менее существующий на начало 2000-х годов уровень развития технологий не предполагал рутинного решения для диагностики анеуплоидий [9].
А причем тут высокопроизводительное секвенирование?
Иногда в результате творчества научных сотрудников и преобразования возникших идей в коммерчески доступный продукт мир меняется. В 2005 году произошла революция. Компания 454 Life Sciences стала продавать первый прибор для высокопроизводительного секвенирования [10]. Этот подход был основан на идее, опубликованной в 1998 году [11]. Затем в конкурентной борьбе технология-пионер проиграла другим методам [12]. Сейчас чаще всего используют секвенаторы производства компаний Illumina и Thermo Fisher Scientific [13]. Эти технологии не идеальны — исходные нуклеиновые кислоты служат матрицей для создания новых фрагментов ДНК. То есть на подготовительном этапе возможны искажения, вклад которых сложно оценить. Иначе говоря, происходит косвенное секвенирование — идентифицируют не исходные последовательности, а производные от исходных. Недавно появились способы прямого секвенирования нуклеиновых кислот — технологии компаний Oxford Nanopore [14] и Pacific Biosciences [13] позволяют секвенировать нуклеиновые кислоты без посредников.
Но всё это не важно. Мир поменялся — стало возможным одновременно секвенировать много нуклеотидных последовательностей, что на несколько порядков удешевило ряд исследований. Например, секвенирование генома человека при помощи метода, описанного в конце 1970-х годов [15], стоило несколько миллиардов долларов в конце 1990-х — начале 2000-х годов. Сейчас же получение аналогичных данных обойдется в несколько сотен долларов. Неинвазивная диагностика анеуплоидий, по сути, стала возможной благодаря этой технологической революции.
Исследование фетальной ДНК из свободной от клеток фракции крови, то есть плазмы, стало доступным за счет появления методов высокопроизводительного секвенирования. Существуют разные способы выполнения такого анализа. Запатентованный компанией Natera метод вошел в широкую клиническую практику [16]. Для исследования внеклеточную ДНК выделяют из плазмы крови беременной женщины. Затем некоторые фрагменты этой ДНК амплифицируют и секвенируют. Параллельно то же самое делают с геномной ДНК мамы и папы. В результате получают массивы данных высокопроизводительного секвенирования, в которых зашифрована информация о десятках тысяч однонуклеотидных полиморфизмов (ОНП). Эти большие данные обрабатывают при помощи соответствующего алгоритма [17].
Что такое однонуклеотидный полиморфизм?
В норме нуклеотидные последовательности одного человеческого организма продублированы. Мы получаем 23 хромосомы от мамы и 23 хромосомы от папы. Это значит, что каждая позиция генома существует в двух вариантах, или аллелях. При этом некоторые позиции генома у разных людей не совпадают, то есть полиморфны. А бывает, что и у одного человека на двух аллелях в одной и той же позиции разные нуклеотиды. Если один нуклеотид не совпадает, а окружающие его соседние нуклеотиды совпадают, то это однонуклеотидный полиморфизм (ОНП). Например, у Маши в 231 позиции гена qwerty на обоих аллелях расположен нуклеотид G (дезоксигуанозин-5′-монофосфат). А у Пети в этой же позиции на одной аллели G, а на второй C. Значит, для Маши и Пети эта позиция полиморфна. И для одного Пети, кстати, тоже полиморфна. А теперь представьте, что рассматриваем всю человеческую популяцию — тогда таких ОНП наберется довольно много.
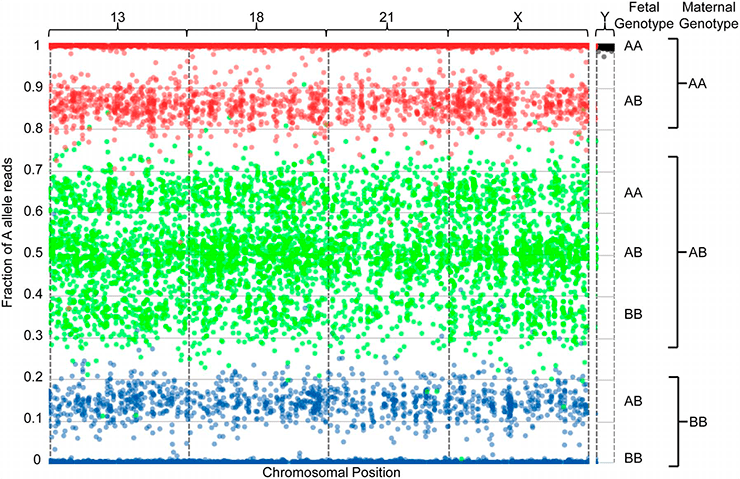
В методе NATERA рассматривают только два самых частых варианта ОНП. Для упрощения обозначим первый вариант ОНП символом «А», а второй — символом «В». Если секвенировать один человеческий организм, то возможно три варианта сочетаний ОНП из двух хромосом: АА, АВ и ВВ. Для каждого ОНП измеряют частоту встречаемости ОНП «А», то есть фракцию «А». Для сочетания АА это значение будет равно 100%, для сочетания АВ — 50%, а для сочетания ВВ — 0%. Теперь усложним задачу — пусть в образце есть ДНК из двух разных организмов. Тогда, если в обоих организмах ОНП присутствует в одинаковом варианте АА, то частота А составит 100%. Но возможна и такая ситуация, что в одном организме есть сочетание АА (на двух хромосомах одинаковый ОНП — «А»), а в другом — АВ (на одной хромосоме ОНП «А», а на второй — «В»). Тогда общая фракция «А» будет меньше 100%. Это значение зависит от соотношения между количеством ДНК разных организмов в образце. Если материнской ДНК 99%, а фетальной — 1%, то разница будет незаметна для человеческого глаза. А если материнской ДНК 50%, и фетальной ДНК тоже 50%, то частота «А» в смеси составит 75%. И так далее — возможны разные сочетания вариантов АА, АВ, ВВ из двух разных организмов. Подобную ситуацию можно проиллюстрировать графиком (рис. 2 и 3). Исследуемые ОНП располагают по абсциссе согласно месту локализации в геноме, фракции «А» для каждого ОНП откладывают по ординате. Если оба организма содержат нормальное число хромосом, то получится что-то подобное рисунку 2. Вклад фетальной ДНК приводит к распределению точек в отдельные кластеры-отпечатки, которые можно использовать для определения числа копий хромосомы.
Рисунок 2. Визуализация результатов секвенирования внеклеточной ДНК плазмы крови беременной женщины. В методе NATERA рассматриваются такие ОНП, для которых возможны два варианта нуклеотидов. Для упрощения первый вариант ОНП обозначают символом «А», а второй — символом «В». Доля фетальной ДНК в образце составила 28,1%. На оси абсцисс расположены все ОНП согласно позиции в хромосоме. Название хромосом указано над графиком. Каждая точка представляет собой один ОНП, где точное положение по оси Y отображает совместную фракцию «А» материнской и фетальной ДНК. Точки красного цвета соответствуют сочетанию вариантов АА у матери на двух хромосомах, синего — сочетанию ВВ, зеленого — сочетанию АВ. В образце следов анеуплоидии нет. Также отсутствуют ОНП, принадлежащие Y-хромосоме, то есть плод — женского пола.
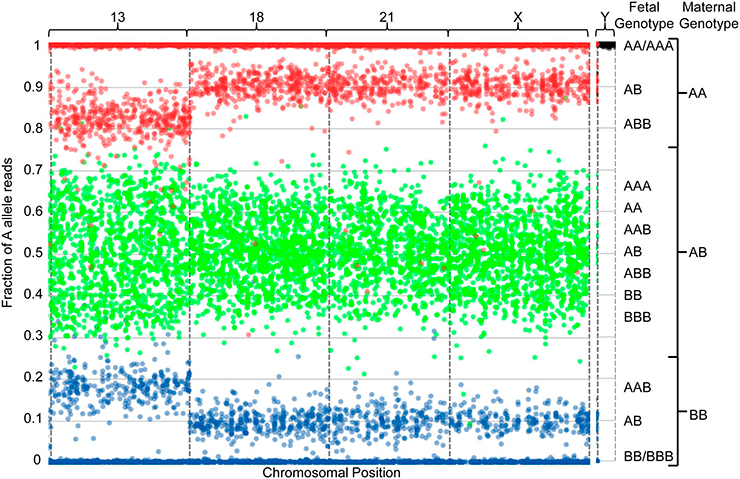
А теперь представим ситуацию, когда одна из хромосом плода продублирована. Тогда получится что-то подобное рисунку 3.
Рисунок 3. Визуализация результатов секвенирования внеклеточной ДНК плазмы крови беременной женщины. Доля фетальной ДНК в образце составила 19,2%. Описание этого рисунка аналогично предыдущему.
На рисунке 3 видно, что паттерн распределение частот «А» для ОНП 13-й хромосомы отличается от паттерна распределения фракции «А» для ОНП 18-й, 21-й и Х-хромосомы. Это значит, что у плода есть три 13-е хромосомы. Такое состояние называют синдромом Патау, при котором наблюдают тяжелые врожденные пороки. Следует отметить, что при малой доле фетальной ДНК во внеклеточной ДНК плазмы крови беременной женщины паттерны распределения фракции «А» для ОНП разных хромосом неразличимы для человеческого глаза при анеуплоидии у плода. Невидимые глазу искажения распределения фракций «А» можно различить при помощи автоматизированной обработки данных на основе разработанного алгоритма [18]. Таким образом, неинвазивная процедура (забор крови беременной женщины) позволяет выявить анеуплоидии у плода.
А что с коммерциализацией?
Сейчас услугой компании Natera воспользовались более двух миллионов беременных женщин из нескольких десятков стран. Стоимость анализа составляет сотни долларов, что доступно для значимой части целевой аудитории продукта. Число проводимых тестов с каждым годом растет, то есть рынок далек от насыщения. Запатентованная технология неинвазивного выявления анеуплоидий у плода во время беременности — одна из двух основных приносящих доход продуктов компании Natera. За первые три месяца 2020 года общий доход компании составил 94 миллиона долларов, валовая прибыль — 49 миллионов долларов. То есть эта динамично развивающаяся компания удовлетворяет запросы всё большего числа потребителей за счет превращения воздушных идей научных сотрудников в приземленный материальный продукт.
Заключение
Эта заметка — краткая справка по одному из способов неинвазивной диагностики анеуплоидий у плода. Но сколько фундаментальных и прикладных исследований понадобилось, чтобы из идей-фантазий получилось что-то материальное? Много. Знали ли авторы этих работ, что получится в результате? Не знали. Сколько было неудачных попыток превращения идей в коммерческий продукт? Неизвестно. Для успеха скорее необходима плодотворная среда, в которой комфортно сосуществуют фантазеры и жесткие прагматики. Для каких-то работ исход сложно предсказать, нужно включать фантазию и не бояться ошибаться. Но чем четче очертания конечного результата, тем проще привлечь капитал, которым рискуют в надежде приумножить. Сухой расчет необходим для оценки необходимых вложений и вероятных доходов. Чем приземленнее такой расчет, тем меньше рисков потерять привлеченный капитал и тем больше вероятность ситуации Win-Win для всех причастных.