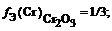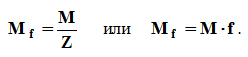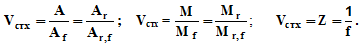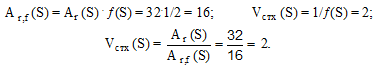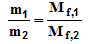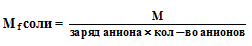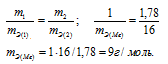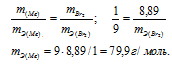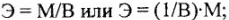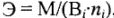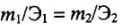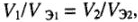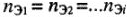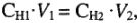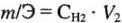Что показывает фактор эквивалентности
Что показывает фактор эквивалентности
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности ( f Э). Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1. Формулы расчета фактора эквивалентности приведены в таблице 1.1.
Таким образом, сочетая фактор эквивалентности и формульную единицу вещества, можно составить формулу эквивалента какой-либо частицы, где фактор эквивалентности записывается как химический коэффициент перед формулой частицы:
f Э (формульная единица вещества) º эквивалент
В примере, рассмотренном выше, фактор эквивалентности для кислоты, соответственно, равен 1/2, а для щелочи КОН равен 1.
Между H 3 PO 4 и КОН также могут происходить и другие реакции. При этом кислота будет иметь разные значения фактора эквивалентности:
Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть.
Таблица 1.1 – Расчет фактора эквивалентности
Фактор эквивалентности
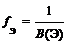
где В(Э) – валентность элемента
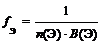
где n (Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента
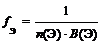
где n (Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента
f Э (P2O5) = 1/(2 × 5) = 1/10
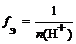
где n ( H + ) – число отданных в ходе реакции ионов водорода (основность кислоты)
f Э ( H 2 SO 4 ) = 1/1 = 1 (основность равна 1)
(основность равна 2)
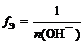
где n (О H – ) – число отданных в ходе реакции гидроксид-ионов (кислотность основания)
f Э ( Cu ( OH )2) = 1/1 = 1 (кислотность равна 1) или
(кислотность равна 2)
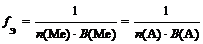
где n (Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n (А) – число кислотных остатков, В(А) – валентность кислотного остатка
f Э ( Cr 2 ( SO 4 )3) = 1/(3 × 2) = 1/6 (расчет по кислотному остатку)
Частица в окислительно-восстановительных реакциях
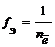
где 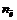
Fe 2+ + 2 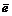
MnO4 – + 8H + + 5 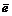
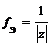
Пример. Определите фактор эквивалентности и эквивалент у солей: а) ZnCl 2, б) КНСО3, в) ( MgOH )2 SO 4.
Решение: Для расчетов воспользуемся формулами, приведенными в таблице 1.1.
а) ZnCl 2 (средняя соль):
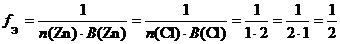
f Э( ZnCl 2) = 1/2, поэтому эквивалентом ZnCl 2 является частица 1/2 ZnCl 2.
б) КНСО3 (кислая соль):
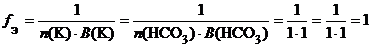
f Э(КНСО3) = 1, поэтому эквивалентом КНСО3 является частица КНСО3.
в) ( MgOH )2 SO 4 (основная соль):
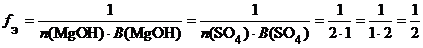
f Э ( ( MgOH )2 SO 4 ) = 1/2, поэтому эквивалентом ( MgOH )2 SO 4 является частица 1/2( MgOH )2 SO 4.
Эквивалент, как частица, может быть охарактеризован молярной массой (молярным объемом) и определенным количеством вещества n э. Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
Молярная масса эквивалента имеет размерность «г/моль».
МЭ(соли) = МЭ(Ме) + МЭ(кислотного остатка).
Закон эквивалентов был открыт в 1792 г. И. Рихтером. Современная формулировка закона: вещества реагируют и образуются согласно их эквивалентам . Все вещества в уравнении реакции связаны законом эквивалентов, поэтому:
n э(реагента1) = … = n э(реагента n ) = n э (продукта1) = … = n э (продукта n )
Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
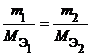
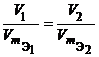
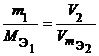
Фактор эквивалентности
Эквивалент — реальная или мнимая частица вещества, которая может присоединять, высвобождать или быть каким-либо иным образом эквивалентна (то есть равноценна) одному иону H+ в обменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Например, в реакции: NaOH + HCl = NaCl + H2O эквивалентом будет реальная частица — ион Na+: в реакции Zn(OH)2 + 2HCl = ZnCl2 + 2H2O эквивалентом будет являться мнимая частица 1/2 Zn(OH)2.
Содержание
Фактор эквивалентности
В реакции: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O Эквивалентом является частица 1/2Zn(OH)2. Число 1/2 в получила название фактора эквивалентности и может обозначаться, как fэкв. или z.
Фактор эквивалентности помогает сформулировать закон эквивалентности.
Эквивалентная масса
Эквивалентная масса — это масса одного эквивалента данного вещества.
Молярная масса эквивалента вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества.
Закон эквивалентов
Все вещества реагируют между собой в эквивалентных количествах. Закон был сформулирован в 1793 г. В. Рихтером. Иногда удобнее пользоваться другим определением закона эквивалентов: массы (объемы) реагирующих между собой веществ пропорциональны их молярным массам эквивалентов (объемам эквивалентов).
Примечания
Ссылки
Полезное
Смотреть что такое «Фактор эквивалентности» в других словарях:
Фактор эквивалентности — Безразмерная величина fэквх, числовое значение которой обозначает долю реальной частицы вещества X, которая в данной кислотно основной реакции эквивалентна одному иону водорода или в данной окислительно восстановительной реакции одному электрону … Словарь-справочник терминов нормативно-технической документации
фактор эквивалентности — (1/z) – величина, рассчитанная на основании стехиометрии данной реакции и показывающая, какая доля реальной частицы вещества соответствует эквиваленту. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
фактор эквивалентности — lygiavertiškumo daugiklis statusas T sritis Standartizacija ir metrologija apibrėžtis Dydis, atvirkščias lygiavertiškumo skaičiui. atitikmenys: angl. equivalence factor vok. Gleichwertigkeitsfaktor, m rus. фактор эквивалентности, m pranc. facteur … Penkiakalbis aiškinamasis metrologijos terminų žodynas
фактор эквивалентности — ekvivalentinis daugiklis statusas T sritis chemija apibrėžtis Dydis, atvirkščias ekvivalentiniam skaičiui. atitikmenys: angl. equivalence factor rus. фактор эквивалентности … Chemijos terminų aiškinamasis žodynas
фактор эквивалентности — ekvivalentiškumo daugiklis statusas T sritis fizika atitikmenys: angl. equivalence factor vok. Gleichwertigkeitsfaktor, m rus. фактор эквивалентности, m pranc. facteur d’équivalence, m … Fizikos terminų žodynas
Фактор — 5. Фактор Ндп. Параметр Переменная величина, по предположению влияющая на результаты эксперимента Источник: ГОСТ 24026 80: Исследовательские испытания. Планирование эксперимента. Термины и определения … Словарь-справочник терминов нормативно-технической документации
Фактор-отображение — Пусть есть множество X, на котором введено отношение эквивалентности (то есть которое обладает следующими свойствами: каждый элемент множества эквивалентен сам себе; если x эквивалентно y, то y эквивалентно x; если x эквивалентно y, а y… … Википедия
Фактор-пространство — Пусть есть множество X, на котором введено отношение эквивалентности (то есть которое обладает следующими свойствами: каждый элемент множества эквивалентен сам себе; если x эквивалентно y, то y эквивалентно x; если x эквивалентно y, а y… … Википедия
Эквивалент. Закон эквивалентов. Решение задач
Количественный подход к изучению химических явлений и установление закона постоянства состава показали, что вещества вступают во взаимодействие в определенных соотношениях масс, что привело к введению такого важного понятия как «эквивалент» и установлению закона эквивалентов: «Массы взаимодействующих без остатка веществ относятся как их эквивалентные массы».
Непосредственно из понятия эквивалента следует необходимость важнейшего понятия химии – валентность (от Valentia – сила) – это способность атома присоединять к себе определенное число других атомов.
Стехиометрическая валентность атома (Vстх) отражает состав вещества (без учета строения и структуры):
Например, при взаимодействии серы с водородом образуется Н2S; эквивалент серы равен 1/2 атома (f(S) = 1/2); Аr(S) = 32:
Математическое выражение закона эквивалентов:
Рассмотрим примеры решения задач на закон эквивалентов:
Пример 1.
Определить эквивалент и эквивалентные массы гидроксида висмута (III) в реакциях:
1) Bi(OH)3 + HCl = Bi(OH)2Cl + Н2O;
2) Bi(OH)3 + 3HCl = BiCl3 + H2O.
Решение:
1) f(Bi(OH)3) = 1, Mf(Bi(OH)3) = 260 г/моль (т. к. из трех групп заместилась одна);
2) f(Bi(OH)3) = 1/3, a Mf(Bi(OH)3) = 260 /3 = 86,3 г/моль (т.к. из трех групп заместились все три).
г) эквивалентная масса соли в реакциях полного замещения катиона или аниона равна:
д) Эквивалентная масса оксида в реакциях полного замещения равна:
Находим эквивалентную массу брома, учитывая, что эквивалентная масса металла равна 9г/моль:
Ответ: 9г/моль; 79,9г/моль.
Эквиваленты и количество эквивалентов простых и сложных веществ. Закон эквивалентов
Моль — количество вещества (n), в котором содержится число структурных частиц (молекул, атомов, ионов и др.), равное постоянной Авогадро (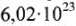
Например: 
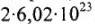
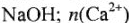
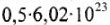
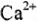
Молярная масса (М) — масса 1 моля вещества, численно равная его относительной молекулярной (атомной) массе. При использовании термина «молярная масса» также рекомендуется указывать вид частицы, молярная масса которой определяется.
Например, 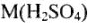
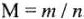
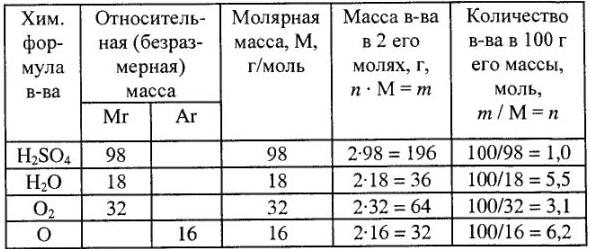
Обозначения и числовые значения некоторых терминов, а также элементарные расчеты приведены в табл. 1.
Молярная масса эквивалента (Э) — масса 1 моля эквивалента.
В химии большое практическое значение имеют такие характеристики элементов (для атомов) или веществ (для молекул), как эквиваленты, или молярная масса эквивалента.
Эквивалент — такое реальное количество вещества, которое присоединяет или замещает 1 моль атомов водорода в химических реакциях. Эквиваленты выражаются в молях, а молярная масса эквивалента — в г/моль.
Различают молярные массы эквивалентов элементов, простых и сложных веществ. Молярные массы рассчитывают по формулам:
элементов:
простых и сложных веществ:
где Э — молярная масса эквивалента, г/моль; М — молярная масса, г/моль; 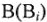
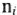
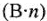
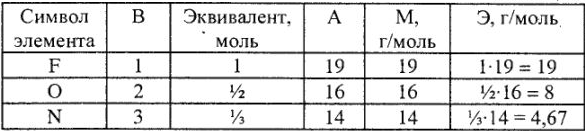
Молярная масса эквивалента элемента в соединениях определяется делением молярной массы его атомов на валентность. Молярная масса численно равна его относительной атомной массе: 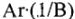
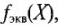
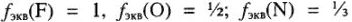
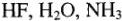
Определение эквивалента и эквивалентной массы элементов фтора, кислорода, азота в соединениях 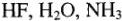
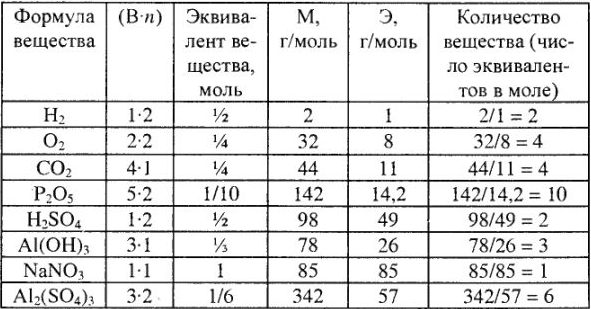
Эквивалентные массы простых веществ равны их молярной массе, деленной на суммарную валентность атомов (В-n).
Молярные массы эквивалентов кислот, оснований и солей в реакциях обмена выражаются через молярную массу, деленную на произведение абсолютного значения заряда одного из ионов на число их в соединениях. Причем молярная масса эквивалента кислоты равна ее молярной массе, деленной на ее основность в реакции (число водородных ионов, участвующих в химической реакции), а молярная масса основания — молярной массе, деленной на кислотность основания в реакции (число гидроксильных групп, принимающих участие в химической реакции).
Расчет эквивалентов, молярные массы эквивалентов и число эквивалентов в молярной массе для простых и сложных веществ приведены в табл. 3.
Обратите внимание: число эквивалентов (молярная масса эквивалентов) в моле (молярной массе) вещества равно (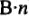
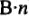
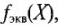
Молярный объем — объем, занимаемый молярной массой газообразного вещества. Молярный объем любого газа при нормальных условиях равен 22,4 л.
Эквивалентный объем — объем, занимаемый молярной массой эквивалента газообразного вещества. 1 моль водорода содержит 2 эквивалента. Объем молярной массы эквивалента водорода (1г/моль) — 22,4/2 = 11,2 л. 1 моль кислорода содержит 4 эквивалента. Объем молярной массы эквивалента кислорода (8г/моль) 22,4/4 = 5,6 л.
Закон эквивалентов
Отношения масс (объемов) реагирующих друг с другом веществ равны или пропорциональны их химическим эквивалентным массам (эквивалентным объемам).
Математические выражения закона эквивалентов:
а) для любых веществ с известной массой:
б) для газов с известным объемом:
где 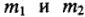
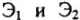
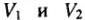
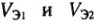
Следствие закона эквивалентов
Вещества реагируют друг с другом равным числом эквивалентов (молярных масс эквивалентов).
Математические выражения следствия закона эквивалентов:
а) для любых веществ с известным количеством эквивалентов (эквивалентных масс):
б) для растворов с известной молярной концентрацией эквивалента:
где 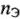
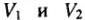
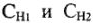
Рациональное решение задач сводиться к правильному выбору формулы из 1-4. При необходимости можно приравнять левую часть одного из приведенных уравнений к правой части любого другого.
Например, для решения реакции взаимодействия твердого вещества с раствором определенной молярной концентрации эквивалента (
Эта теория взята со страницы подробного решения задач по всем темам химии:
Возможно эти страницы вам помогут:
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института