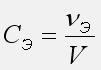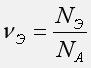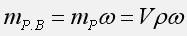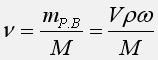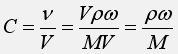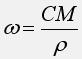Что показывает коэффициент растворимости
Понятие о растворах. Растворимость веществ
Растворы — гомогенные (однородные) системы переменного состава, которые содержат два или несколько компонентов.
Наиболее распространены жидкие растворы. Они состоят из растворителя (жидкости) и растворенных веществ (газообразных, жидких, твердых):
Жидкие растворы могут быть водные и неводные. Водные растворы — это растворы, в которых растворителем является вода. Неводные растворы — это растворы, в которых растворителями являются другие жидкости (бензол, спирт, эфир и т. д.). На практике чаще применяются водные растворы.
Растворение веществ
Растворение — сложный физико-химический процесс. Разрушение структуры растворяемого вещества и распределение его частиц между молекулами растворителя — это физический процесс. Одновременно происходит взаимодействие молекул растворителя с частицами растворенного вещества, т.е. химический процесс. В результате этого взаимодействия образуются сольваты.
Сольваты — продукты переменного состава, которые образуются при химическом взаимодействии частиц растворенного вещества с молекулами растворителя.
Если растворителем является вода, то образующиеся сольваты называются гидратами. Процесс образования сольватов называется сольватацией. Процесс образования гидратов называется гидратацией. Гидраты некоторых веществ можно выделить в кристаллическом виде при выпаривании растворов. Например:
Что представляет собой и как образуется кристаллическое вещество синего цвета? При растворении в воде сульфата меди (II) происходит его диссоциация на ионы:
Образующиеся ионы взаимодействуют с молекулами воды:
При выпаривании раствора образуется кристаллогидрат сульфата меди (II) — CuSО4 • 5Н2О.
Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами. Вода, входящая в их состав, называется кристаллизационной водой. Примеры кристаллогидратов:
Впервые идею о химическом характере процесса растворения высказал Д. И. Менделеев в разработанной им химической (гидратной) теории растворов (1887 г.). Доказательством физико-химического характера процесса растворения являются тепловые эффекты при растворении, т. е. выделение или поглощение теплоты.
Тепловой эффект растворения равен сумме тепловых эффектов физического и химического процессов. Физический процесс протекает с поглощением теплоты, химический — с выделением.
Если в результате гидратации (сольватации) выделяется больше теплоты, чем ее поглощается при разрушении структуры вещества, то растворение — экзотермический процесс. Выделение теплоты наблюдается, например, при растворении в воде таких веществ, как NaOH, AgNО3, H2SО4, ZnSО4 и др.
Если для разрушения структуры вещества необходимо больше теплоты, чем ее образуется при гидратации, то растворение — эндотермический процесс. Это происходит, например, при растворении в воде NaNО3, KCl, K2SO4, KNO2, NH4Cl и др.
Растворимость веществ
Мы знаем, что одни вещества хорошо растворяются, другие — плохо. При растворении веществ образуются насыщенные и ненасыщенные растворы.
Насыщенный раствор — это раствор, который содержит максимальное количество растворяемого вещества при данной температуре.
Ненасыщенный раствор — это раствор, который содержит меньше растворяемого вещества, чем насыщенный при данной температуре.
Количественной характеристикой растворимости является коэффициент растворимости. Коэффициент растворимости показывает, какая максимальная масса вещества может раствориться в 1000 мл растворителя при данной температуре.
Растворимость выражают в граммах на литр (г/л).
По растворимости в воде вещества делят на 3 группы:
Таблица растворимости солей, кислот и оснований в воде:
Растворимость веществ зависит от природы растворителя, от природы растворенного вещества, температуры, давления (для газов). Растворимость газов при повышении температуры уменьшается, при повышении давления — увеличивается.
Зависимость растворимости твердых веществ от температуры показывают кривые растворимости. Растворимость многих твердых веществ увеличивается при повышении температуры.
По кривым растворимости можно определить: 1) коэффициент растворимости веществ при различных температурах; 2) массу растворенного вещества, которое выпадает в осадок при охлаждении раствора от t1 o C до t2 o C.
Процесс выделения вещества путем испарения или охлаждения его насыщенного раствора называется перекристаллизацией. Перекристаллизация используется для очистки веществ.
Коэффициент растворимости
По этой ссылке вы найдёте полный курс лекций по математике:
онятие растворимости можно рассматривать с двух сторон — качественной и количественной. Качественно под растворимостью понимают способность вещества растворяться в том или ином растворителе. Количественно растворимость характеризуют концентрацией растворенного вещества в его насыщенном растворе при данной температуре. Численно растворимость может быть выражена теми же способами, что и концентрация: в массовых долях (%), в моль ит. п., но чаще всего ее выражают количеством граммов растворенного вещества в 100 г растворителя — параметром, который носит название коэффициента растворимости.
Для раствора, коэффициент растворимости которого равен К, массовая доля (%) растворенного вещества равна: ш
«к+Тоо’100%’ Растворимость веществ, которая в различных растворителях меняется в широких пределах, определяется рядом факторов. Первый из них — увеличение хаотичности, неупорядоченности при образовании растворов, способствует переходу растворенного вещества в раствор. Второй фактор — энергетические затраты на отрыв частиц от кристаллической решетки растворяемого вещества и возрастание энергии при растворении.
Энергетический фактор препятствует переходу растворенного вещества в раствор. Значение равновесной концентрации растворенного вещества в растворе будет определяться совместным действием этих двух факторов. В свою очередь, влияние названных факторов зависит от природы растворителя, природы растворяемых веществ, их агрегатного состояния и внешних условий (температуры, давления и др.).
Анализ зависимости растворимости любого вещества в растворителях различной природы наглядно иллюстрирует влияние на растворимость природы растворителя. Влияние природы растворяемых веществ можно показать на следующих примерах. Так, почти все соли щелочных металлов и аммония хорошо растворимы в воде, например нитраты, хлориды (кроме хлоридов серебра, ртути, свинца) и сульфаты (кроме сульфатов щелочноземельных металлов и свинца).
Возможно вам будут полезны данные страницы:
Для переходных металлов характерна небольшая растворимость сульфидов, фосфатов, карбонатов и некоторых других солей, а также их гидроксидов. Более подробно влияние этого фактора иллюстрирует таблица растворимости веществ (см. Приложение). Анализируя растворимость веществ различного агрегатного состояния, следует отметить, что при растворении твердых и жидких веществ объем раствора обычно изменяется незначительно.
Поэтому растворимость твердых и жидких веществ, как правило, не зависит от давления. При растворении газообразных веществ объем системы существенно уменьшается, и это предопределяет зависимость их растворимости от давления, причем повышение давления в соответствии с принципом Jle Шателье приводит к увеличению растворимости газа. Растворимость веществ во всех агрегатных состояниях зависит от температуры. Как, правило, растворимость твердых веществ с увеличением температуры возрастает (AgN03, KI, NH4C1).
Однако имеются вещества, растворимость которых при увеличении температуры возрастает очень незначительно (NaCl) или даже уменьшается (Са(ОН)2, Li2S04, Са(СН3СОО)2. По принципу Jle Шателье между веществом в кристаллическом состоянии и его насыщенным раствором имеет место равновесие: кристалл + растворитель насыщенный раствор ± ДН В тех случаях, когда процесс растворения эндотермичен, т. е. количество энергии, идущей на разрушение кристаллической решетки веществ не полностью компенсируется энергией, выделяющейся при образовании гидратов (сольва-тов), повышение температуры ведет к увеличению растворимости.
Ясно, что экзотермичность процесса растворения приведет к понижению растворимости при повышении температуры. Зависимость между растворимостью и температурой изображают как в виде табличных данных, так и в графической форме — в виде кривых растворимости. Рассматривая растворимость жидкостей, отметим, что некоторые из них смешиваются с растворителем в любых соотношениях, например спирт и вода, другие — ограниченно растворимы — бензол и вода.
В случае ограниченной растворимости жидкости взаимно растворимы друг в друге до насыщения при данной температуре. Так, если смешать гексан с водой, то образуется два слоя: верхний представляет собой насыщенный раствор воды в гексане, а нижний — насыщенный раствор гексана в воде. В большинстве подобных случаев с повышением температуры взаимная растворимость жидкостей увеличивается до тех пор, пока не будет достигнута температура, при которой обе жидкости смешиваются в любых пропорциях.
Растворение газов почти всегда сопровождается выделением теплоты.
Согласно принципу Jle Шателье, повышение температуры понижает растворимость газов, поэтому при кипячении газы полностью удаляится из растворов. Решение задач по теме ♦ Растворимость» водится или к определению растворимости веществ в изотермических условиях (по известным данным о содержании раство- ренного вещества), или к определению количества вещества, выпадающего в осадок, либо растворяющегося в системе «вещество-растворитель» при изменении температуры раствора.
| Определим массовую долю (%) |
96,65 Г’ 3) Рассчитаем количество соли, которое необходимо добавить к раствору при 20 °С, чтобы он остался насыщенным при 100 °С: Вопросы и задачи для самостоятельного решения L Какой взгляд на природу растворов предложил Д. И. Менделеев, в каких фактах он видел подтверждение своей теории? 2. Каковы современные взгляды на процесс растворения? 3. Какие факторы влияют на растворимость веществ?
4. Какую роль в процессе растворения играет растворитель и чем объясняется избирательность его действия на растворимые вещества? 5. Как можно объяснить различные значения тепловых эффектов процесса растворения твердых веществ? 6. Что следует понимать под терминами «растворимость», ♦ коэффициент растворимости»? 7. В какой зависимости находятся коэффициенты растворимости твердых веществ от температуры, как эту зависимость обычно выражают? Растворимость дихромата калия при 20 °С составляет 11,0 г. Определите массовую долю (%) насыщенного раствора соли. Ответ: 9,91 %.
9. Массовая доля (%) насыщенного при 20 °С раствора нитрата бария равна 8,25%. Найдите коэффициент растворимости соли. Ответ: 9 г. 10. При охлаждении 500 г раствора с массовой долей соли 12 % часть растворенного вещества выпала в осадок и концентрация раствора стала равной 8 %. Чему равна масса выпавшей в осадок соли? Ответ: 21,8 г. 11. При охлаждении насыщенного при 80 °С раствора до 20 °С выкристаллизовалось 150 г соли.
Какова была масса исходного раствора, если растворимость соли при 80 и 20 °С соответственно составляет 35 и 6,5 г? Ответ: 710,5 г. 12. Определить концентрацию раствора и количество воды, в которой можно растворить при 40 °С 200 г соли, содержащей 80 % сульфата калия, если растворимость сульфата калия при этой температуре равна 64 г. Ответ: 39 %; 250 г. 13.
Определить количество воды, в которой можно растворить при 80 °С 950 г соли, содержащей 84,58 % кристаллогидрата хлорида магния, если растворимость безводного хлорида магния при этой температуре равна 66 г. Ответ: 569^7 г. 14. Растворимость сульфата меди при 20 °С равна 20,2 г, а при 100 °С— 77 г. Определите массу сульфата меди, выпадающего в осадок при охлаждении 165 г раствора от 100 до 20 °С. Ответ: 54,2 г. 15. Растворимость хлората калия при 70 °С равна 30,2 г, а при 30 °С — 10,1 г. Определите массу соли, выпадающей в осадок при охлаждении до 30 °С 350 г насыщенного при 70 °С раствора. Ответ: 54 г.
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Растворимость. Коэффициент растворимости
Растворение – процесс образования раствора из компонентов. Растворение представляет собой обратимый процесс, который при неизменности внешних условий достигает состояния равновесия.
Раствор, находящийся в состоянии равновесия с избытком растворенного вещества, называется насыщенным.
Концентрация насыщенного раствора – это равновесная концентрация, зависящая от природы растворителя, растворенного вещества и не зависящая от того, как раствор был приготовлен.
Способность вещества растворяться в определенном растворителе называется растворимостью этого вещества в данном растворителе.
Чаще всего характеризуют способность вещества растворяться в воде и под растворимостью вещества понимают растворимость в воде. Количесвенно растворимость вещества при определенных условиях может быть связана с концентрацией его насыщенного при данных условиях раствора, т.к. это – воспроизводящаяся величина. Принятыми способами выражения растворимости вещества в воде (или другом растворителе) является коэффициент растворимости.
Коэффициент растворимости показывает, какую массу вещества надо растворить при определенных условиях в 100 г воды (или в 1 литре воды), чтобы получить насыщенный при данных условиях раствор. При записи коэффициента растворимости обязательно указывается вещество, растворитель и внешние условия (для веществ в твердом состоянии обычно в качестве внешних условий указывают только температуру), например:
растворимость KNO3при 20 o С равна 25 г в 100 г воды, или
растворимость KNO3 в воде при 20 o С равна 250 г/ л.
По электропроводности растворов их делят на растворы электролитов – эти растворы проводят электрический ток – и растворы неэлектролитов, не обладающие электропроводностью.
Ненасыщенный раствор — раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое его количество.
Насыщенный раствор — раствор, в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется. Осадок данного вещества находится в равновесном состоянии с веществом в растворе.
Перекристаллиза́ция — метод очистки вещества, основанный на различии растворимости вещества в растворителе при различных температурах (обычно интервал температур от комнатной до температуры кипения растворителя, если растворитель — вода, или до какой-то более высокой температуры). [1]
Перекристаллизация подразумевает плохую растворимость вещества в растворителе при низких температурах, и хорошо — при высоких. При нагревании колбы вещество растворяется. После стадии адсорбции примесей (если это необходимо) активированным углём, охлаждении образуется перенасыщенный раствор, из которого растворённое вещество выпадает в виде осадка. После пропуска смеси через колбу Бунзена и воронку Бюхнера получаем очищенное растворённое вещество. [1]
Растворителем могут быть вода, уксусная кислота, этанол (95 %), метанол, ацетон, гексан, пентан — в зависимости от условий. [1]
Если растворителем является вода, то нагревание проводят в водяной бане. Охлаждение перенасыщенного раствора проводят с помощью водяного холодильника, если температура кипения растворителя ниже 130 градусов, если выше — с помощью воздушного холодильника. [1]
Концентрацию веществ в растворах можно выразить разными способами. На этой страничке вы с ними познакомитесь. Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию.
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) · V),
Общая химия
Растворы. Способы выражения концентрации
Истинными растворами называются гомогенные системы, состоящие из двух или большего числа компонентов, состав которых может непрерывно меняться в определенных пределах.
Агрегатное состояние растворов может быть твердым, жидким или газообразным. Обычно термин “растворы” относят к жидким системам. Компонент раствора, имеющий то же агрегатное состояние, что и раствор, называют растворителем, остальные компоненты – растворенными веществами. Это деление достаточно условно, например в растворе, компонентами которого являются азотная кислота и вода, растворителем и растворенным веществом можно считать каждый из компонентов. Подобные растворы называют взаимными, например взаимный раствор азотной кислоты и воды. Однако в случае, когда одним из компонентов раствора является вода, ее традиционно считают растворителем.
Содержание растворенного вещества в растворе может быть выражено несколькими способами:
Массовая доля растворенного вещества: отношение массы растворенного вещества к массе раствора:
где 
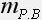
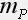
Концентрация (молярная концентрация, молярность): отношение количества растворенного вещества 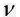
Молярная концентрация имеет принятую в химии размерность [моль/л], которая часто обозначается М и называется молярностью. Например, концентрация раствора 5 моль/л может быть записана как 5 М и такой раствор называется пятимолярным.
Эквивалентная (нормальная) концентрация: отношение количества эквивалентов растворенного вещества 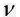
Эквивалент – это реальная или условная частица вещества, которая в данной кислотно-основной реакции эквивалента (равна) одному иону водорода или в данной окислительно-восстановительной реакции – одному электрону. Например в реакции
эквивалентом гидроксида калия будет молекула КОН, а серной кислоты 
Фактор эквивалентности fЭКВ показывает, какая доля реальной частицы данного вещества в данной кислотно-основной реакции эквивалента (равна) одному иону водорода или в данной окислительно-восстановительной реакции – одному электрону.
Для приведенного примера
Величина, обратная фактору эквивалентности, называется эквивалентным числом zB:
Число частиц эквивалентов вещества NЭ связано с числом реальных частиц N соотношением:
Количество вещества эквивалента равно отношению числа частиц эквивалентов к числу Авогадро:
Молярная масса эквивалента равна отношению массы вещества к количеству вещества эквивалента:
и имеет размерность г/моль.
Эквивалентная концентрация имеет размерность [моль эквивалента/л] и называется также нормальной концентрацией или нормальностью раствора и обозначается н. Например, раствор с эквивалентной концентрацией 0,5 моль-эквивалентов/л называется полунормальным, его концентрация запишется 0,5 н.
Молярная концентрация и массовая доля растворенного вещества связаны между собой. Предположим, что мы знаем массовую долю растворенного вещества 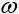

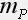
масса растворенного вешества:
количество растворенного вещества:
Подставляем выражение для количества растворенного вещества в формулу для концентрации и сокращаем объем раствора V:
Если из полученного соотношения выразить массовую долю растворенного вещества, то:
Оба выражения (для концентрации и массовой доли) содержат размерные величины, поэтому подстановка числовых значений требует от них определенных размерностей: С[моль/л], М[г/моль], 


Растворимость. Коэффициент растворимости
Растворение – процесс образования раствора из компонентов. Растворение представляет собой обратимый процесс, который при неизменности внешних условий достигает состояния равновесия.
Раствор, находящийся в состоянии равновесия с избытком растворенного вещества, называется насыщенным.
Концентрация насыщенного раствора – это равновесная концентрация, зависящая от природы растворителя, растворенного вещества и не зависящая от того, как раствор был приготовлен.
Способность вещества растворяться в определенном растворителе называется растворимостью этого вещества в данном растворителе.
Чаще всего характеризуют способность вещества растворяться в воде и под растворимостью вещества понимают растворимость в воде. Количесвенно растворимость вещества при определенных условиях может быть связана с концентрацией его насыщенного при данных условиях раствора, т.к. это – воспроизводящаяся величина. Принятыми способами выражения растворимости вещества в воде (или другом растворителе) является коэффициент растворимости.
Коэффициент растворимости показывает, какую массу вещества надо растворить при определенных условиях в 100 г воды (или в 1 литре воды), чтобы получить насыщенный при данных условиях раствор. При записи коэффициента растворимости обязательно указывается вещество, растворитель и внешние условия (для веществ в твердом состоянии обычно в качестве внешних условий указывают только температуру), например:
растворимость KNO3при 20 o С равна 25 г в 100 г воды, или
растворимость KNO3 в воде при 20 o С равна 250 г/ л.
По электропроводности растворов их делят на растворы электролитов – эти растворы проводят электрический ток – и растворы неэлектролитов, не обладающие электропроводностью.