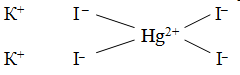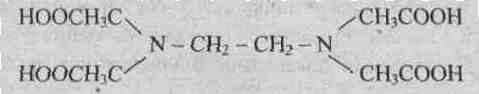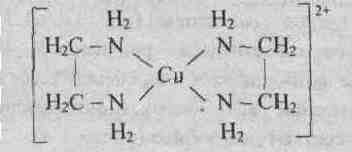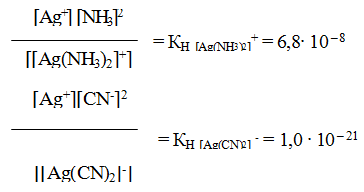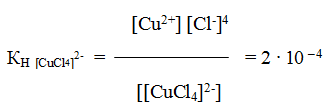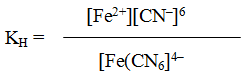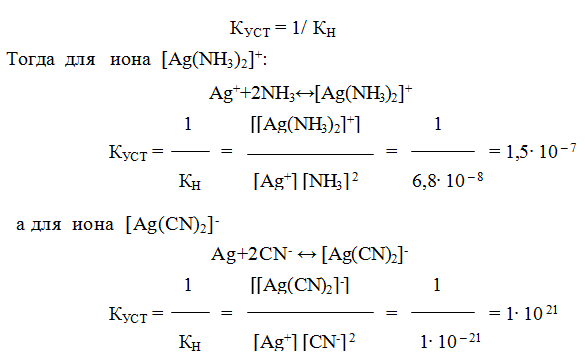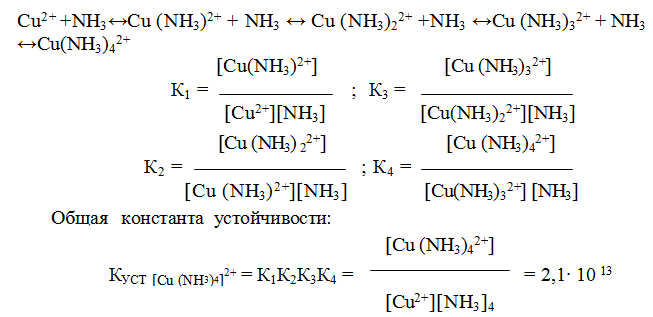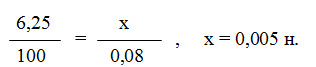Что показывает координационное число
Урок №15. Комплексные соединения
Na 2 [Zn(OH) 4 ] →2Na + + [Zn(OH) 4 ] 2-
Ионы противоположного знака, связанные с комплексным ионом, образуют внешнюю сферу.
Комплексный ион состоит из комплексообразователя и лигандов и образует внутреннюю сферу (внутреннюю сферу заключают в квадратные скобки).
Координационное число зависит:
от природы центрального атома;
условий образования комплексов.
Виды комплексов
Соединения с комплексными анионами
Соединения с комплексными катионами
[Ag(NH 3 ) 2 ]Cl – хлорид диамминсеребра
[Al(H 2 O) 5 OH]SO 4 – сульфат гидроксопентаакваалюминия
[Pt(H 2 O)(NH 3 ) 2 OH] NO 3 – нитрат гидроксодиамминакваплатины (II)
Соединения без внешней сферы
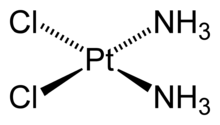
[Pt(NH 3 ) 2 Cl 2 ] – дихлородиамминплатина (II)
[Co(NH 3 ) 3 Cl 3 ] – трихлоротриамминкобальт (III)
Номенклатура
в названиях комплексных ионов сначала указываются лиганды;
название комплексного иона завершается названием металла с указанием его степени окисления (римским цифрами в скобках);
в названиях комплексных катионов используются русские названия металлов;
в названиях комплексных анионов используются латинские названия металлов: Al –алюминат, Cr – хромат, Fe – феррат;
Координационное число
Координационное число (в химии и кристаллографии) — характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле.
Содержание
Координационное число в химии
Например, в комплексной соли гексацианоферрате(III) калия K3[Fe(CN)6] координационное число иона Fe 3+ равно 6, а в цис-дихлородиамминплатине (II) (соли Пейроне) Pt(NH3)2Cl2 центральный атом платины связан с четырьмя лигандами.
Понятие координационного числа применяется также при описании структуры жидкостей и аморфных тел. В этом случае координационное число — мера ближнего порядка, среднее число ближайших соседей атома. Оно может быть дробным.
Координационное число в кристаллографии
В кристаллохимии координационное число — характеристика, которая определяет число ближайших равноудаленных одинаковых частиц (ионов или атомов) в кристаллической решётке. Прямые линии, соединяющие центры ближайших атомов или ионов в кристалле, образуют координационный многогранник, в центре которого находится данный атом.
В решётках Браве для всех узлов координационное число одинаково. Число ближайших соседей отражает плотность упаковки вещества. Чем больше координационное число, тем больше плотность и соответственно свойства вещества ближе к металлическим. Данному параметру решетки соответствует первая, вторая (соседи, следующие за ближайшими), третья и т. д. координационные группы частиц.
Для простой кубической решетки координационное число равно шести, для ОЦК — 8, ГЦК и ГП (гексагональной плотноупакованной) — 12.
См. также
Источники
Примечания
Полезное
Смотреть что такое «Координационное число» в других словарях:
КООРДИНАЦИОННОЕ ЧИСЛО — число ближайших к данному атому соседних атомов в кристаллической решётке (атомной структуре кристалла) или молекул в молекулярных кристаллах. Если центры этих ближайших соседей соединить друг с другом прямыми линиями, то получится плоская фигура … Физическая энциклопедия
КООРДИНАЦИОННОЕ ЧИСЛО — 1) в кристаллографии число ближайших к данному атому или иону соседних атомов или ионов в кристалле, находящихся от него на одинаковом расстоянии.2) В химии число лигандов, связанных с центральным ионом в комплексных соединениях … Большой Энциклопедический словарь
КООРДИНАЦИОННОЕ ЧИСЛО — одно из основных понятий кристаллохимии, означающее число атомов или ионов, окружающих любой атом или ион на ближайшем расстоянии, или в первой сфере. В гольдшмидто паулинговской кристаллохимии считалось, что К.ч. определяется соотношением… … Геологическая энциклопедия
КООРДИНАЦИОННОЕ ЧИСЛО — число ближайших к данному атому (иону) соседних атомов (ионов) в кристаллической решетке. В титаномагнетите, например, у катионов в тетраэдрических узлах подрешетки А координационное число – 4, в октаэдрических узлах подрешетки В – 6. Существуют… … Палеомагнитология, петромагнитология и геология. Словарь-справочник.
координационное число — – число лигандов, непосредственно связанных с комплексообразователем, определяемое числом свободных орбиталей в центральном атоме. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
координационное число — (напр. атомов) [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN cooordinate numberCNcoordination number … Справочник технического переводчика
координационное число — 1) в кристаллографии число ближайших к данному атому или иону соседних атомов или ионов в кристалле, находящихся от него на одинаковом расстоянии. 2) В химии число лигандов, связанных с центральных ионом в комплексных соединениях. * * *… … Энциклопедический словарь
координационное число — [coordination number] число ближайших соседних атомов, окружающих на равных расстояниях данный атом. Металлы с ГЦК и ГПУ решеткой имеют координационное число = 12. У металлов с ОЦК решеткой координационное число = 8; Смотри также: Число число… … Энциклопедический словарь по металлургии
координационное число — (см. координация) 1) физ. число ближайших к данному атому или иону соседних атомов или ионов в кристалле (наибольшее координационное число равно 12); 2) хим. число атомов (групп атомов) или ионов, связанных хим. связью с центральным атомом в… … Словарь иностранных слов русского языка
координационное число — koordinacijos skaičius statusas T sritis Standartizacija ir metrologija apibrėžtis Atomų ar atomų grupių, tiesiogiai prisijungusių prie atomo, skaičius kompleksiniame junginyje. atitikmenys: angl. coordination number vok. Koordinationszahl, f rus … Penkiakalbis aiškinamasis metrologijos terminų žodynas
КООРДИНАЦИОННОЕ ЧИСЛО
Понятие «К. ч.» применяется и при описании структуры аморфных тел и жидкостей. В этом случае оно является статистическим, поэтому К. ч. может оказаться не целым. Для жидкостей К. ч.- мера ближнего порядка; по тому, насколько К. ч. жидкости близко к К. ч. кристалла, судят о близости её структуры к структуре кристалла.
Лит. см. при ст. Кристаллохимия.
Полезное
Смотреть что такое «КООРДИНАЦИОННОЕ ЧИСЛО» в других словарях:
Координационное число — (в химии и кристаллографии) характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле. Содержание 1 Координационное число в химии … Википедия
КООРДИНАЦИОННОЕ ЧИСЛО — 1) в кристаллографии число ближайших к данному атому или иону соседних атомов или ионов в кристалле, находящихся от него на одинаковом расстоянии.2) В химии число лигандов, связанных с центральным ионом в комплексных соединениях … Большой Энциклопедический словарь
КООРДИНАЦИОННОЕ ЧИСЛО — одно из основных понятий кристаллохимии, означающее число атомов или ионов, окружающих любой атом или ион на ближайшем расстоянии, или в первой сфере. В гольдшмидто паулинговской кристаллохимии считалось, что К.ч. определяется соотношением… … Геологическая энциклопедия
КООРДИНАЦИОННОЕ ЧИСЛО — число ближайших к данному атому (иону) соседних атомов (ионов) в кристаллической решетке. В титаномагнетите, например, у катионов в тетраэдрических узлах подрешетки А координационное число – 4, в октаэдрических узлах подрешетки В – 6. Существуют… … Палеомагнитология, петромагнитология и геология. Словарь-справочник.
координационное число — – число лигандов, непосредственно связанных с комплексообразователем, определяемое числом свободных орбиталей в центральном атоме. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
координационное число — (напр. атомов) [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN cooordinate numberCNcoordination number … Справочник технического переводчика
координационное число — 1) в кристаллографии число ближайших к данному атому или иону соседних атомов или ионов в кристалле, находящихся от него на одинаковом расстоянии. 2) В химии число лигандов, связанных с центральных ионом в комплексных соединениях. * * *… … Энциклопедический словарь
координационное число — [coordination number] число ближайших соседних атомов, окружающих на равных расстояниях данный атом. Металлы с ГЦК и ГПУ решеткой имеют координационное число = 12. У металлов с ОЦК решеткой координационное число = 8; Смотри также: Число число… … Энциклопедический словарь по металлургии
координационное число — (см. координация) 1) физ. число ближайших к данному атому или иону соседних атомов или ионов в кристалле (наибольшее координационное число равно 12); 2) хим. число атомов (групп атомов) или ионов, связанных хим. связью с центральным атомом в… … Словарь иностранных слов русского языка
координационное число — koordinacijos skaičius statusas T sritis Standartizacija ir metrologija apibrėžtis Atomų ar atomų grupių, tiesiogiai prisijungusių prie atomo, skaičius kompleksiniame junginyje. atitikmenys: angl. coordination number vok. Koordinationszahl, f rus … Penkiakalbis aiškinamasis metrologijos terminų žodynas
Что показывает координационное число
Основы современной координационной теории были изложены в конце прошлого века швейцарским химиком Альфредом Вернером, обобщившим в единую систему весь накопившийся к тому времени экспериментальный материал по комплексным соединениям. Им были введены понятия о центральном атоме (комплексообразователь) и его координационном числе, внутренней и внешней сфере комплексного соединения, изомерии комплексных соединений, предприняты попытки объяснения природы химической связи в комплексах.
Все основные положения координационной теории Вернера используются и в настоящее время. Исключение составляет его учение о природе химической связи, которое представляет сейчас лишь исторический интерес.
Образование комплексного иона или нейтрального комплекса можно представить себе в виде обратимой реакции общего типа:
M + n L 
В комплексных ионах комплексообразователями являются медь(II), кремний(IV), железо(II), бор(III).
Чаще всего комплексообразователем служит атом элемента в положительной степени окисления.
Отрицательные условные ионы (т.е. атомы в отрицательной степени окисления) играют роль комплексообразователей сравнительно редко. Это, например, атом азота(-III) в катионе аммония [NH 4 ] + и т.п.
Атом-комплексообразователь может обладать нулевой степенью окисления. Так, карбонильные комплексы никеля и железа, имеющие состав [Ni(CO) 4 ] и [Fe(CO) 5 ], содержат атомы никеля(0) и железа(0).
Комплексообразователь (выделен синим цветом) может участвовать в реакциях получения комплексов, как будучи одноатомным ионом, например:
так и находясь в составе молекулы:
P H 3 + H + 
B F 3 + NH 3 
В комплексной частице может быть два и более атомов-комплексообразователей. В этом случае говорят о многоядерных комплексах.
Лиганды, как правило, не связаны друг с другом, и между ними действуют силы отталкивания. В отдельных случаях наблюдается межмолекулярное взаимодействие лигандов с образованием водородных связей.
Примером гексадентатного лиганда может служить анион этилендиаминтетрауксусной кислоты:
Полидентатные лиганды могут выступать в роли мостиковых лигандов, объединяющих два и более центральных атома.
Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с лигандами, или координационное число ( КЧ ). Эта характеристика комплексообразователя определяется главным образом строением его электронной оболочки и обусловливается валентными возможностями центрального атома или условного иона-комплексообразователя (подробнее см. >>>).
Когда комплексообразователь координирует монодентатные лиганды, то координационное число равно числу присоединяемых лигандов. А число присоединяемых к комплексообразователю полидентатных лигандов всегда меньше значения координационного числа.
Значение координационного числа комплексообразователя зависит от его природы, степени окисления, природы лигандов и условий (температуры, природы растворителя, концентрации комплексообразователя и лигандов и др.), при которых протекает реакция комплексообразования. Значение КЧ может меняться в различных комплексных соединениях от 2 до 8 и даже выше. Наиболее распространенными координационными числами являются 4 и 6.
В аквакомплексах координационное число комплексообразователя в степени окисления +II чаще всего равно 6:
Известны комплексообразователи, которые обладают практически постоянным координационным числом в комплексах разных типов. Таковы кобальт(III), хром(III) или платина(IV) с КЧ 6 и бор(III), платина(II), палладий(II), золото(III) с КЧ 4. Тем не менее большинство комплексообразователей имеет переменное координационное число. Например, для алюминия(III) возможны КЧ 4 и КЧ 6 в комплексах и
Координационные числа 3, 5, 7, 8 и 9 встречаются сравнительно редко. Есть всего несколько соединений, в которых КЧ равно 12 – например, таких как K9 [Bi(NCS) 12 ].
Лиганды, непосредственно связанные с комплексообразователем, образуют вместе с ним внутреннюю (координационную) сферу комплекса.
Так, в комплексном катионе внутренняя сфера образована атомом комплексообразователя – меди(II) и молекулами аммиака, непосредственно с ним связанными.
Обозначается внутренняя сфера квадратными скобками:
В зависимости от соотношения суммарного заряда лигандов и комплексообразователя внутренняя сфера может иметь положительный заряд, например, либо отрицательный, например, или нулевой заряд, например, как для
При растворении в воде комплексные соединения необратимо диссоциируют на ионы:
Кислоты с комплексными анионами в водном растворе подвергаются необратимому протолизу :
в котором реализуется четверная связь Re – Re: одна σ-связь, две π- связи и одна δ-связь. Особенно большое число кластерных комплексов насчитывается среди производных d-элементов.
Многоядерные комплексы смешанного типа содержат как связь комплексообразователь–комплексообразователь, так и мостиковые лиганды.
Примером комплекса смешанного типа может служить карбонильный комплекс кобальта состава [Co 2 (CO) 8 ], имеющий следующее строение:
Здесь имеется одинарная связь Co – Co и два бидентатных карбонильных лиганда CO, осуществляющих мостиковое соединение атомов-комплексообразователей.
Комплексные соединения. Комплексообразователи, лиганды
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Комплексные соединения
9.1. Определение комплексных соединений. Такие соединения, как оксиды, кислоты, основания, соли образованы из атомов в результате возникновения между ними химической связи. Это соединения обычные, или соединения первого порядка.
Однако имеются вещества, которые образованы в результате соединения друг с другом нейтральных молекул без возникновения новых связующих электронных пар. Например:
Это молекулярные соединения, или соединения высшего порядка. Одни из них диссоциируют в водном растворе на простые ноны, например:
другие — на сложные (комплексные) ионы, состоящие, в свою очередь, из более простых ионов, как, например:
Молекулярные соединения, образующие комплексные ионы, способные к существованию как в растворе, так и в кристалле, называют комплексными. Но такое определение применимо лишь в известных пределах. Оно не охватывает соединений типа неэлектролитов, например карбонилов металлов —Ni(CO)4 и др., а потому не является и полным.
Чтобы объяснить, почему происходит присоединение одних простых молекул к другим, швейцарский химик А. Вернер ввел понятие о главной и побочной валентности. Тогда образование, скажем, K2[HgI4] можho представить так: ион ртути за счет своей главной валентности (обозначается сплошной линией), равной двум, присоединяет два иодид-иона, а за счет побочной – (обозначается пунктиром) — дополнительно еще два иодид-иона. По Вернеру, это может быть изображено формулой
В настоящее время главную валентность надо объяснить ионной или ковалентной связью, а побочную – ковалентной связью, возникшей по донорно-акцепторному механизму (см. раздел 4.8.2.). Исходя из механизма образования комплексных соединений, им можно дать более точное, не имеющее исключений определение: комплексные соединения – это соединения, характеризующиеся наличием хотя бы одной ковалентной связи, возникшей по донорно-акцепторному механизму.
9.2. Комплексообразователи. Комплексообразователями служат атомы или ионы, имеющие вакантные орбитали. Способность к комплексообразованию возрастает с увеличением заряда иона и уменьшением его размера. К наиболее распространенным комплексообразователям относятся ионы d-элементов VII, VIII, I и II групп периодической таблицы элементов.
Динатриевая соль ЕДТА и сама кислота относятся к классу соединений, называемых комплексонами. Би- и полидентантные лиганды при взаимодействии с комлексообразователями образуют замкнутые циклы, называемые хелатными, поэтому и комплексы с би- и полидентантными лигандами называют хелатными (или клешневидными), например
Пример 1. Определите заряд комплексного иона, координационное число (к.ч.) и степень окисления комплексообразователя в соединениях: a) K4[Fe(CN)6]; б) Na[Ag(NO2)2]; в) K2[MoF8]; г) [Сr(Н2O)2(NН3)3С1]С12.
Решение. Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него. Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисления всех атомов в молекуле равна нулю. Заряды нейтральных молекул (H2O, NН3) равны нулю. Заряды кислотных остатков определяют из формул соответствующих кислот. Отсюда:
| Заряд иона | К.ч. | Степень окисления | |
| а) | -4 | 6 | +2 |
| б) | -1 | 2 | +1 |
| в) | -2 | 8 | +6 |
| г) | +2 | 6 | +3 |
9.4. Номенклатура комплексных соединений. Название комплексного катиона записывается одним словом, начинающимся с названия отрицательного лиганда с прибавлением буквы «о», затем приводятся нейтральные молекулы и центральный атом с указанием римской цифрой его степени окисления для металлов переменной валентности. Для молекул Н2О (аква), NН3 (аммин), СО (карбонил), NO (нитрозил) даются особые названия, указанные в скобках.
Число лигандов обозначают греческими приставками (ди-, три-, тетра- и т.д.) или бис-, трис-, тетракис-, пентакис- и гексакис- для 2, 3, 4, 5 и 6 соответственно у сложных лигандов. Например, соединение [Zn(NH3)2Cl]CI называется хлорид хлородиамин цинка (II), а [Ni(En)2]Cl2 – хлорид бис(этилендиамин) никеля (II).
Комплексный анион записывается аналогично названию катиона, но с добавлением суффикса -«am» к названию комплексообразователя, например K2[Zn(CN)4] – тетрацианоцинкат (II) калия. Нейтральный комплекс записывается подобно катиону, например комплекс [Ni(CО)4] называется тетракарбонил никеля (II). Соответственно по типу лигандов комплексы называют аквакомплексы (лиганд Н2О), аминокомплексы (лиганд NH3), ацидокомплексы (лиганды анионы кислот), комплексонатные комплексы (лиганды-комплексоны) и т.д.
9.5. Диссоциация комплексных соединений. Комплексные соединения — неэлектролиты в водных растворах диссоциации не подвергаются. У них отсутствует внешняя сфера комплекса, например: [Zn(NH3)2Cl2], [Co(NH3)3(NO3)3], [Pt (NH3)2C12]. В водной среде такие молекулы гидратируются как единое образование.
Комплексные соединения — электролиты при диссоциации в водных растворах образуют комплексные ионы, например:
Такая диссоциация протекает полностью, ионы гидратируются. Комплексные ионы в свою очередь подвергаются вторичной диссоциации:
Однако эта диссоциация обычно протекает в незначительной степени. Применяя закон действующих масс к обратимым процессам (а) и (б), получаем выражения констант нестойкости комплексных ионов:
Соединения с малоустойчивой внутренней сферой называют двойными солями. Обозначают их иначе, чем комплексные соединения, а именно — как соединения молекул, например K2SO4∙A12(SO4)3. Принципиальной же разницы между двойными солями и комплексными соединениями нет. В растворе двойной соли имеется некоторое количество комплексных ионов (например, [Al (SO4)2] – ). Двойная соль отличается от комплексной соли лишь диссоциацией комплексного иона: у первой она практически полная, а у второй — незначительная.
Двойные соли — довольно распространенные соединения. К ним относятся соль Мора (NH4)2SO4∙FeSO4∙6H2O, двойной хлорид калия и меди 2КС1 ∙ СuС12 ∙ 2Н2О и многие другие. Если, например, растворить в воде двойной хлорид, то происходит диссоциация
и все образовавшиеся в растворе ионы можно обнаружить с помощью соответствующих реакций. Но если это соединение рассматривать как комплексное, то его формулу надо изобразить как K2[CuС14]∙2H2О. Диссоциация K2[CuС14]∙2H2О протекает по уравнению:
Образующийся комплексный ион устойчив только в концентрированных растворах, и его константа нестойкости при комнатной температуре
Решение. Если комплексная соль гексацианоферрат (II) калия, являясь сильным электролитом, в водном растворе необратимо диссоциирует на ионы внешней и внутренней сфер
то комплексный ион диссоциирует обратимо и в незначительной степени на составляющие его частицы:
Обратимый процесс характеризуется своей константой равновесия, которая в данном случае называется константой нестойкости (Кн) комплекса:
Чем меньше KH, тем более прочен данный комплекс.
9.6. Константы устойчивости комплексов. Для характеристики устойчивости (прочности) комплексного иона применяют также величину, обратную константе нестойкости. Ее называют константой устойчивости (КУСТ) или константой образования комплекса. Величины КН и КУСТ взаимосвязаны:
Очевидно, чем выше КУСТ, тем прочнее комплексный ион и тем больше его концентрация при равновесии.
Следует подчеркнуть, что как диссоциация комплексного иона, так и его образование являются процессами обратимыми и протекают ступенчато, как у слабых электролитов. Каждой ступени соответствует определенная величина константы устойчивости – К1, К2 …, Кn. Ион [Ag(NH3)2] + будет иметь две константы устойчивости — K1 и K2:
У иона [Cu(NH3)4] 2+ будет четыре константы устойчивости, так как комплексообразователь в четыре стадии присоединяет лиганд NH3
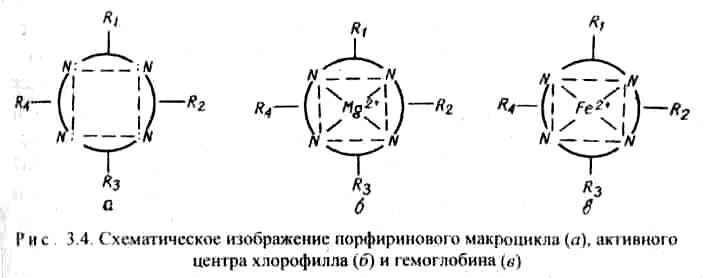
9.7.Роль комплексных соединений. Комплексные соединения широко распространены в природе. В состав многих растений и живых организмов входят соединения с макроциклическими лигандами. В упрощенном виде тетрадентантный макроцикл порфин представлен на рис. 3.3
Рис. 3.3. Структура молекул порфина
Комплексы с участием порфина называются порфи-ринами. Они отличаются друг от друга центральными ионами-комплексообразователями и заместителями, присоединенными к атомам углерода на периферии лиганда. В наиболее простом виде порфиновый цикл представлен четырьмя атомами азота, соединенными углеродными цепями (рис. 3.3). Кроме того, имеются четыре или более заместителей – радикалов R1, R2, R 3, R4. В зеленом катализаторе фотосинтеза – хлорофилле роль комплексообразователя выполняет магний (рис. 3.4). Макроциклический комплекс железа входит в состав гемоглобина (рис. 3.4).
Железо координирует кислород в комплексе гемоглобина и переносит его по организму с кровью. Связь кислорода с железом в комплексе не очень прочная и поэтому кислород в организме легко реагирует с восстановителями. Недостаток железа в организме приводит к болезни – анемии. Макроциклы крови могут взаимодействовать с каталитическими ядами, например, монооксидом углерода СО, что приводит к отравлению организма.
Пример 1. Вычислите жесткость воды, зная, что в 500 л ее содержится 202,5 г Са(НСО3)2.
Приведенные примеры решают, применяя формулу Ж = m / (mЭ ∙ V)
где: т – масса вещества, обусловливающего жесткость воды или применяемого для устранения жесткости, мг;
mэ, – молярная масса эквивалента этого вещества;
Решение. В 1 л воды содержится 202,5 : 500 = 0,405 г Са(НСО3)2, что составляет 0,405 : 81 = 0,005 ммоль/л. 81 г/моль — эквивалентная масса Са(НСО3)2. Следовательно, жесткость воды 5ммоль. (Ж = т / (mэV)= 202 500 / (81 • 500) = 5 ммоль. 81 – эквивалентная масса Са(НСО3)2, равная половине его молярной массы).
Пример 2. Сколько граммов CaSO4 содержится в 1 м 3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 ммоль?
Решение. Молярная масса CaSO4 136,14 г/моль; молярная масса эквивалента равна 136,14:2 = 68,07 г/моль. В 1 м 3 воды жесткостью 4 ммоль содержится 4 · 1000 = 4000 ммоль, или 4000 · 68,07 = 272 280 мг = 272,280 г CaSO4. Из формулы Ж = m / (mэV),m = 468,071000 = 272 280 мг = 272,280 г CaSO4).
Пример 3. Какую массу соды надо добавить к 500 л воды, чтобы устранить ее жесткость, равную 5 ммоль?
Решение. В 500 л воды содержится 500 · 5 = 2500 моль солей, обусловливающих жесткость воды. Для устранения жесткости следует прибавить 2500 · 53 = 132 500 мг = 132,5 г соды (53 г/моль — молярная масса эквивалента Na2CO3).
Пример 4. Вычислите карбонатную жесткость воды, зная, что на титрование 100 см 3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см 3 0,08 н. раствора НС1.
Решение. Вычисляем молярную концентрацию эквивалентов раствора гидрокарбоната кальция. Обозначив число эквивалентов растворенного вещества в 1 л раствора, через х, составляем пропорцию: