Что положено в основу количественного определения ферментов
Определение активности ферментных препаратов (ОФС.1.2.4.0013.15)
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Определение активности ферментных препаратов (ОФС.1.2.4.0013.15)
Настоящая общая фармакопейная статья распространяется на методы определения активности ферментов, которые основаны на определении скорости превращения субстратов для действия энзимов в соответствующие продукты ферментативной реакции, которые они катализируют.
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
ОФС.1.2.4.0013.15 Определение активности ферментных препаратов
Взамен ГФ XI, вып.2, стр. 25
Настоящая общая фармакопейная статья распространяется на методы определения активности ферментов, которые основаны на определении скорости превращения субстратов для действия энзимов в соответствующие продукты ферментативной реакции, которые они катализируют.
Классификация ферментов
Фермент (E) – белок, обладающий каталитическими свойствами в реакции преобразования субстрата (S) в продукт (P).
Согласно международной номенклатуре (табл.), все ферменты подразделяются на 6 классов в зависимости от типа катализируемых ими реакций.
Таблица. Классификация ферментов
Особенности измерения активности ферментов, описываемые в фармакопейных статьях, определяется их принадлежностью к тому или иному классу.
Принцип, положенный в основу всех методов определения активности фермента (Е), заключается в регистрации скорости убыли субстрата (S) (то есть вещества, на которое действует фермент) или скорости образования продукта реакции (P).
Простейшей схемой для описания кинетики ферментативных реакций является так называемая двухстадийная схема:
Е – фермент;
S – субстрат;
P – продукты реакции;
kкат – каталитическая константа.
Начальная скорость (υo) катализируемой ферментом реакции, при которой расходом субстрата можно пренебречь, описывается уравнением Михаэлиса–Ментен (2):
Для аллостерических ферментов начальная скорость ферментативной реакции не подчиняется уравнению Михаэлиса–Ментен.
Для определения скорости ферментативной реакции через определенные промежутки времени отбирают пробы из реакционной смеси и проводят количественное определение методами, основанными чаще всего на спектральных свойствах субстрата или продукта реакции.
Требования к условиям проведения ферментативной реакции
Ферментативная реакция должна проводиться в строго определенных условиях с учетом следующих факторов.
1.Начальная скорость реакции (хo).
Скорость ферментативной реакции количественно можно измерить по убыли субстрата или по образованию продукта реакции.
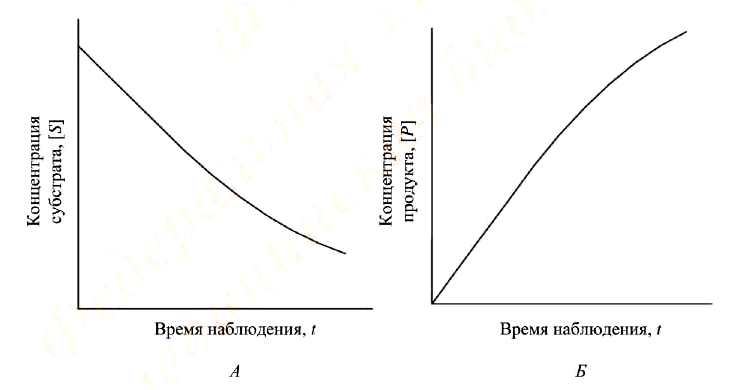
Типичные кинетические кривые ферментативной реакции приведены на рис. 1. Для каждой ферментативной реакции могут быть подобраны условия, при которых начальный участок кривой линеен, т. е. зависимость концентрации образовавшегося продукта или израсходованного субстрата от времени наблюдения имеет прямо пропорциональный характер.
Рисунок 1. Типичные кинетические кривые ферментативной реакции:
А – регистрация по скорости исчезновения субстрата реакции;
Б – регистрация по скорости образования продукта реакции
Начальная скорость реакции (υo) определяется как тангенс угла наклона линейного участка кривой.
Поскольку длительность прямолинейного участка кинетической кривой от опыта к опыту несколько изменяется, время инкубации (при использовании метода отбора проб) должно составлять не более 70 % и не менее 20% времени соответствующего прямолинейного участка.
2.Концентрация субстрата ([S]0).
В большинстве случаев зависимость начальной скорости ферментативной реакции (хo) от начальной концентрации субстрата ([S]0), согласно уравнению Михаэлиса–Ментен (2) описывается гиперболической функцией (рис. 2).
Начальная скорость реакции (υo) зависит от начальной концентрации субстрата ([S]0) вплоть до его насыщающей концентрации. Под насыщающей концентрацией ([S]нас) понимают такую концентрацию субстрата, при которой начальная скорость реакции практически перестает повышаться при дальнейшем увеличении концентрации субстрата, стремясь к своему предельному значению, называемому максимальной скоростью реакции Vмакс (рис. 2). Отрезок на оси абсцисс, соответствующий скорости, равной половине максимальной, будет представлять собой Км. При проведении ферментативной реакции реакционная смесь должна содержать такое количество субстрата, которое обеспечит насыщение фермента в течение всего хода определения (количество субстрата, взятого для проведения ферментативной реакции, должно быть примерно на 30% выше насыщающей концентрации).
Если форма кривой зависимости начальной скорости реакции (υo) от начальной концентрации субстрата ([S]0) отличается от гиперболической, определение параметров по уравнению Михаэлиса–Ментен невозможно. Такие отклонения наблюдаются в случае ингибирования или активации фермента субстратом, а также при работе с аллостерическими ферментами. В этом случае оптимальной является та концентрация субстрата, при которой начальная скорость реакции максимальна ([S]опт)– точка перегиба на экспериментальной кривой зависимости начальной скорости реакции от начальной концентрации субстрата (рис. 2).
После выбора насыщающей концентрации субстрата необходимо проверить, сохраняется ли при ней линейная зависимость [P] от t.
В качестве субстратов используются как природные вещества, такие как альбумин, казеин, крахмал, так и синтетические. Природные субстраты ферментов используют большей частью для подтверждения подлинности. Синтетические субстраты обеспечивают более высокую точность и лучшую воспроизводимость при количественном определении ферментативной активности.
3.Концентрация фермента ([Е]0).
В соответствии с уравнением Михаэлиса–Ментен начальная скорость ферментативной реакции (хo) в подавляющем большинстве случаев линейно зависит от концентрации фермента ([E]0). Выбор оптимальной для каждого метода концентрации фермента осуществляется экспериментально при помощи построения кривой зависимости начальной скорости реакции от концентрации фермента (рис. 3).
После выбора начальной концентрации фермента необходимо проверить, сохраняется ли при ней линейная зависимость [P] от t при выбранном значении насыщающей концентрации субстрата.
4. Температура.
Особенностью ферментативных реакций является наличие колоколообразной зависимости скорости реакции от температуры в достаточно широком интервале температур, которая характеризуется «температурным оптимумом» реакции. Эта особенность объясняется наложением 2 эффектов: возрастанием скорости реакции при увеличении температуры и ускорением тепловой денатурации белковой молекулы, приводящей к инактивации фермента при достаточно высоких температурах. Обычно ферментативную реакцию рекомендуется проводить в термостате при температуре (37 ± 0,1) ºС, если нет иных указаний в фармакопейной статье. Предварительно каждый из реагентов нагревают до температуры 37º С.
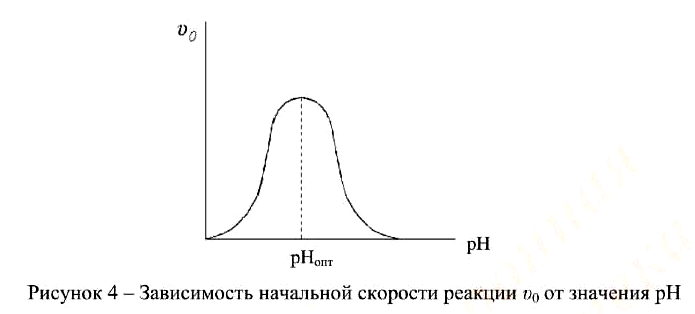
5. Значение рН.
Типичная кривая, описывающая для большинства ферментов рН-зависимость начальной скорости ферментативной реакции при наличии 2 ионогенных групп в активном центре фермента, приведена на рис. 4.
Определение активности следует проводить при оптимальном значении рН, определенном при выбранных значениях концентрации фермента и насыщающей концентрации субстрата; использовании буферного раствора того состава, который не ингибирует фермент и температуре (37 ± 0,1) ºС, если нет других указаний в фармакопейной статье.
После выбора оптимального значения рН необходимо проверить, сохраняется ли при этом рН линейная зависимость [P] от t при выбранных значениях концентрации фермента и насыщающей концентрации субстрата.Рисунок 4 – Зависимость начальной скорости реакции υ0 от значения рН
6.Кофакторы.
Для определения оптимальной концентрации кофактора следует построить кривую зависимости начальной скорости реакции от начальной концентрации кофактора, аналогичную зависимости начальной скорости реакции от начальной концентрации субстрата, и по этой кривой выбрать насыщающую концентрацию кофактора.
После выбора насыщающей концентрации кофактора необходимо проверить, сохраняется ли при ней линейная зависимость [P] от t.
Конкретные параметры ферментативной реакции указываются в фармакопейных статьях.
Способы детекции
Для количественной регистрации скорости ферментативной реакции используют спектрофотометрические, флюресцентные, хеми- и биолюминесцентные методы детекции, основанные на спектральных свойствах субстрата или продукта реакции, а также детекцию с помощью микрокалориметрических датчиков и биодатчиков (биосенсоров) на основе хеми- и биолюминесценции; электрохимические методы, такие как потенциометрия, амперометрия и др. Для одних видов анализа детекция может проводиться непрерывно в ходе реакции, для других – после ее остановки.
Способ остановки ферментативной реакции должен быть указан в фармакопейной статье.
Единицы измерения ферментативной активности
Активность фермента измеряется количеством субстрата, преобразованного в продукт в единицу времени, и выражается в Международных единицах (МЕ) или единицах действия (ЕД).
МЕ – это такое количество фермента, которое при заданных условиях катализирует превращение одного микромоля субстрата за 1 мин (или одного микроэквивалента затронутых реакцией групп в тех случаях, когда атакуется более одной группы в каждой молекуле субстрата).
ЕД – это условная единица активности фермента, величина которой указывается в фармакопейной статье.
Перевод единиц активности ЕД в МЕ и обратно осуществляется опытным путем на основании статистически достаточного материала, обработанного в соответствии с ОФС «Статистическая обработка результатов определения специфической фармакологической активности лекарственных средств биологическими методами».
Определение активности ферментных препаратов в сравнении со стандартным образцом (СО)
С целью снижения погрешности методов определения ферментативной активности необходимо проводить определение ферментативной активности препарата в сравнении со стандартным образцом (СО) данного фермента.
Определение ферментативной активности испытуемого препарата и СО проводят в одинаковых условиях опыта.
Активность препарата (А) в соответствующих единицах (МЕ или ЕД) вычисляют по формуле:
А0 – ферментативная активность СО в единицах (МЕ или ЕД) на 1мг белка или препарата;
П – величина измеряемого параметра для СО;
П0 – величина измеряемого параметра для испытуемого препарата;
К – коэффициент, выравнивающий концентрации растворов испытуемого препарата и СО.
Определение активности иммобилизованных ферментов
Иммобилизованными называются ферменты, молекулы которых физически или химически связаны с каким-либо носителем. В качестве носителей могут быть использованы природные и синтетические полимеры, органические низкомолекулярные носители, неорганические материалы. В зависимости от природы носителя иммобилизованные ферменты могут существовать в форме гелей, пленок, гранул, макропористых порошков и в других формах.
Активность иммобилизованных ферментов может нормироваться на массу носителя или его площадь.
Кинетические характеристики иммобилизованных ферментов, численно определяемые константой Михаэлиса Км и каталитической константой kкат, могут существенно изменяться в зависимости от природы носителя и способа иммобилизации. Поэтому для корректного определения активности иммобилизованных ферментов необходим повторный подбор условий.
Качественное обнаружение и количественное определение активности. Единицы активности (МE, катал). Удельная активность. Число оборотов ферментов.
Сопряженные ферментные системы их применение. Номенклатура, классификация ферментов (тривиальная, рациональная, систематическая). Принципы классификации.
 |
Сопряженные реакции – используются в случаях, если нет возможности прямо определить количество продукта исследуемой реакции. В таких случаях в реагирующую смесь добавляется фермент (Е2) катализирующий превращение образующегося продукта в реакции, которую можно оценить количественно, одним из вышеперечисленных методов.
Если фермент Е2 присутствует в избытке, скорость образования C отражает скорость образования В.
Например, сопряженное исследование активности глюкокиназы (используется избыток глюкозо-6-фосфат дегидрогеназы и НАДФ + )
Глюкоза + AТФ → глюкоза 6-Ф + AДФ : (катализируется глюкокиназой –Е1)
Глюкоза-6-Ф + НАДФ + → 6-фосфоглюконолактон + НАДФН + H + : ( катализируется глюкоза-6Ф –дегидрогеназой – Е2):
Скорость образования НАДФH (измеряется по поглощению при 340 нм) пропорциональна активности глюкокиназы (см выше)
В настоящее время известны и используются 3 вида классификации ферментов:
1. Тривиальная (исторически сложившаяся) номенклатура: (пепсин, трипсин).
2. Рациональная предложена французским физиологом П. Дюкло в 1883 году (к корню названия субстрата прибавляется суффикс
3. Современная классификация рассмотрена и утверждена V Всемирным биохимическим конгрессом в г. Москве в 1961 г. В основу ее положен тип катализируемой реакции (всего 6 классов):
Оба этих класса ферментов работают при участии коферментов, которые являются водорастворимыми витаминами: В6, В12, В1, В15.
3) Гидролазы: ферменты, катализирующие расщепление внутримолекулярных связей при участии молекулы воды.
5) Изомеразы: ферменты, катализирующие различные типы реакций изомеризации. Сюда относятся рацемазы и эпимеразы.
Кроме всего этого все существующие ферменты (более 2000) имеют свой цифровой шифр, который присваивается по 4-х значному коду. Т. о. шифр каждого фермента состоит из 4-х цифр, разделенных точками и составляется по следующему принципу.
Первая цифра указывает на номер одного из классов ферментов.
Вторая цифра озночает подкласс, который характеризует тип связи, на которую действует фермент.
Третья цифра означает подподкласс, который характеризует химическую природу донора или акцептора, участвующего в реакции.
Четвертая цифра обозначает порядковый номер фермента.
Алкогольдегидрогеназа (АДГ); КФ: 1. 1. 1. 1.
Лактатдегидрогеназа (ЛДГ); КФ: 1. 1. 1. 27.
ЛДГ4,5
ЛДГ1,2
H (heart) и M (muscle).
Существует 5 изоферментных форм:
HHHH HHHM HHMM HMMM MMMM
H4 H3M H2M2 HM3 M4
ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4, ЛДГ5.
Поскольку H-протомеры несут более выраженный отрицательный заряд, то изофермент H4 (ЛДГ1) будет мигрировать при электрофорезе с наибольшей скоростью к аноду.
С наименьшей скоростью к аноду будет двигаться М4.
Остальные изоферменты занимают промежуточное положение.
Изоферменты ЛДГ локализованы в различных тканях:
Изоферменты появляются на различных этапах онтогенеза и реализуют программу индивидуального развития.
Изоферментный профиль меняется в процессе развития.
При патологиях имеется существенный изоферментный сдвиг.
Метаболон – мультиферментный комплекс, состоящий из белков-ферментов обладающих всеми уровнями структурной организации и катализирующих отдельные метаболические пути. Эти комплексы обычно связаны с клеточными мембранами, играют важную роль в эволюции живых систем, поскольку обеспечивают высокую скорость катализа, тонкую, точную регуляцию и направленность (векторность) метаболизма во времени и пространстве.
Энзимодиагностика.
Еще Вольгемут показал, что при заболевании поджелудочной железы в моче и крови обнаруживается высокая активность амилазы.
Таким образом энзимодиагностика базируется на идее органоспецифичности и компартментолизации ферментов в клетке.
При заболевании увеличивается проницаемость мембран и вследствие нарушения градиента концентраций ферментов между внутриклеточной и межклеточной средами, ферменты выходят из клетки и попадают в кровь, мочу.
Энзимодиагностика имеет 2 направления:
1. Ранняя диагностика.
Так при гепатитах активность трансаминаз (АсАТ АлАТ) повышается гораздо раньше, чем билирубин проникает в ткани и вызовет желтуху, и значительно раньше, чем возникает недомагание.
Путем определения активности АсАТ и АлАТ можно диагнозировать гепатит за 2-е недели до появления желтухи.
2. Дифференциальная дигностика.
Так например заболевание печени делится на 3 группы.
АлАТ
При гепатите коэф. 2 (увеличивается активность АсАТ), то это инфаркт миокарда; уровень держится 2-3 суток, к концу 1 недели падает.
Следует отметить, что при заболеваниях может наблюдаться 3 состояния ферментов:
1) гипоферментемия (снижена активность в плазме). Наблюдается при поражении того органа в котором синтезируется данный фермент, например при гепатите уменьшается активность холинэстеразы, синтезируемой в гепатоцитах. Так, на высоте заболевания панкреотитом, снижается активность амилазы, что ведет к некрозу.
3) Гипеферментемия встречается чаще всего.
Некоторые примеры использования измерения активности ферментов в диагностике
Глутамилтранспептидаза (g-ГТ) является печеночным ферментом и имеет значение для диагностики нарушений печени. При паренхиматозных заболеваниях печени, расстройстве функции желчевыделительной системы часто намного раньше других клеточных ферментов в сыворотке крови повышается активность g-глутамилтранспептидазы (ранняя диагностика). Она же остается повышенной гораздо дольше всех остальных ферментов.
4.2. Энзимотерапия. Примеры. Иммобилизованные ферменты, липосомы, тени эритроцитов, вирусные векторы. Биотехнология.
Ферменты, которые обнаруживаются в норме в плазме крови делятся на 3 группы:
Энзимотерапия.
Ферменты применяются для апликаций, ингаляций при гнойных заболеваниях легких.
Ферменты: РНКазы, ДНКазы, гиалуронидаза, коллагеназы, эластазы используются для обработки ран, воспалительных очагов, ожогов, для устранения отеков.
Для лечения заболеваний ССС применяются кашикрины (для снижения кровяного давления), стрептодеказа (ведет к снижению зоны инфаркта миокарда).
В последнее время применяются иммобилизованные ферменты, т. е. фиксированные на чем либо. Такие ферменты обладают повышенной стабильностью, сниженной антигенностью и более длительным действием в организме.
Предпринимались попытки применения ферментов для лечения злокачественных опухолей, например аспарагиназы при лечении лимфогранулематоза. Этот фермент разрушает АСН, является незаменимым фактором для лейкозных клеток.
Качественное обнаружение и количественное определение активности. Единицы активности (МE, катал). Удельная активность. Число оборотов ферментов.
О скорости ферментативной реакции судят или по скорости убыли субстрата, или по скорости образования продукта.
За единицу активности любого фермента (Е) принимается то количество фермента которое в оптимальных условиях катализирует превращение 1 мкмоля субстрата в 1 мин.
Существует другая единица активности:
1 Е фермента = 16,67 нкатал.
Для выражения активности фермента пользуются определением удельной и молекулярной активности.
Чем выше очистка фермента, тем выше удельная активность.
Число оборотов широко варьирует, например:
1. Карбоангидраза (катализирует перенос Н2СО3) совершает 36 000 000 оборотов.
Для качественного обнаружения и количественного определения активности сложных ферментов используют следующие методы: ЛДГ CH3 CH3
НАД НАД.Н+Н COOH COOH
НАД.Н интенсивно поглощает свет ( =340 нм). По изменению ПВК можно судить о НАДН.
На одну молекулу лактата образуется одна молекула НАД.Н.
НАД.Н интенсивно флюоресцирует. Интенсивность флюоресценции будет пропорциональна концентрации.
В практике лабораторий широко пользуются понятием удельная активность. Для этого число cтандартных единиц пересчитывают на какую-либо единицу сравнения. Это может быть мг белка в пробе или объем исследуемой биологической жидкости. Определение активности ферментов широко распространено в любой современной клинической лаборатории.
При исследовании кинетики реакций используется и такое понятие как молекулярная активность. Она показывает, сколько молекул субстрата в секунду превращаются в продукт 1 молекулой фермента и используется для сравнительной характеристики активности нескольких ферментов.
Пример вычисления активности фермента:
Методы исследования активности определяются механизмом реакции и природой определяемого вещества. Наиболее широко используются:
· Измерение изменения спектральных свойств (измерение поглощения света в видимой или ультрафиолетовой области, измерение флюоресценции) при помощи спектрофотометров, ФЭКов, спектрофлуориметров. Эти методы применяют и для определения количества продуктов или субстратов реакции, и для изменений количества коферментов, участвующих в реакции. Последнее нашло широкое применение в практике клинических биохимических лабораторий. В основе этих методов лежит закон Beer-Lambert: A = e x c x l = log (I0/I) (e, поглощение 1 M раствора вещества при специфической длине волны или молярный коэффициент экстинкции; c, концентрация ; A, поглощение ; l, длина в см кюветы спектрофотометра ; I0, интенсивность падающего света; I, интенсивность прошедшего света). В случае, если молярный коэффициент экстинкции ( исследуемого вещества неизвестен, исследователь определяет экспериментально зависимость между поглощением света исследуемого раствора и концентрацией этого вещества и использует полученную закономерность в форме стандартного (калибровочного) графика.
Эту величину можно использовать для оценки скорости реакции.
· Химический анализ с использованием высокоразрешающей жидкостной или газовой хроматографии, или ЯМР или тонкослойной хроматографии. (АТФазы)
· Изотопный анализ (например, с использованием радиоактивного 32 P)
Что положено в основу количественного определения ферментов
Методы выделения и количественного определения активности ферментов
Для изучения свойств и клинического применения ферментов необходимы высокоочищенные препараты ферментов. Поэтому были разработаны различные методы выделения ферментов. К ним относятся разрушение клеток и получение клеточного сока, в котором содержатся ферменты; экстрагирование ферментов из высушенных тканей слабыми растворами солей, кислот и оснований. Из растворов ферменты можно осаждать добавлением солей [(NH4)2SО4, NaCl] и различных органических растворителей типа ацетона, смеси спирта и эфира и др.
Выделение ферментов также осуществляется методом адсорбции. Адсорбенты типа окиси кремния, активированного угля, гидрата окиси железа, различных синтетических смол и др. обладают способностью обратимо связывать определенные ферменты. Извлечение ферментов при этом достигается промыванием адсорбентов различными специфическими растворителями, которые переводят ферменты в раствор. В настоящее время для выделения ферментов используют хроматографическое фракционирование на колонках с синтетическими смолами, разделение ферментов при помощи электрофореза и др. Получение ферментов в кристаллическом виде достигают путем высушивания очищенных ферментов при низких температурах и вакууме (лиофилизация).
О присутствии ферментов в растворе судят по производимому ими действию. Так, наличие пепсина, который катализирует расщепление белка, определяют по появлению свободных аминокислот, входящих в состав этого белка, о действии каталазы узнают по выделению кислорода при разложении перекиси водорода. Активность фермента выражают количеством распавшегося под действием фермента субстрата или образовавшихся продуктов реакции за единицу времени, в расчете на г ткани или мг белка.