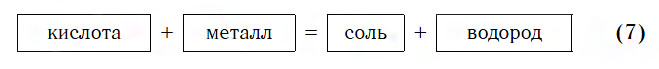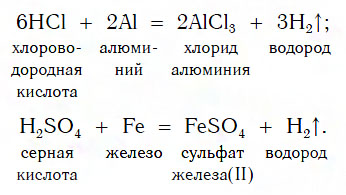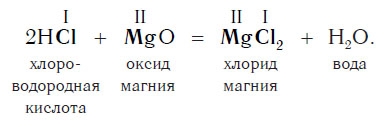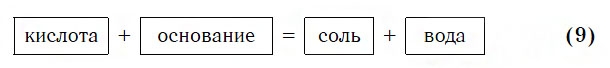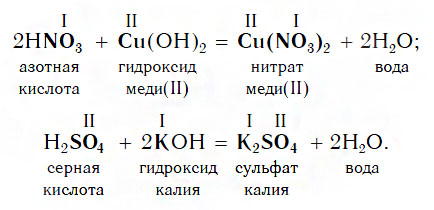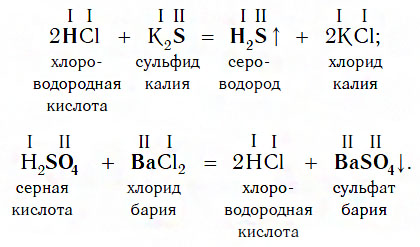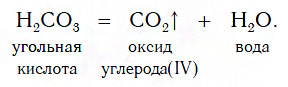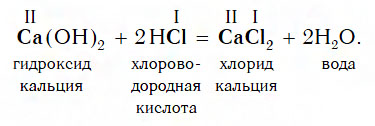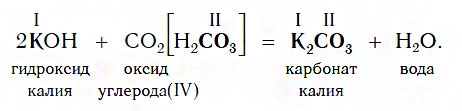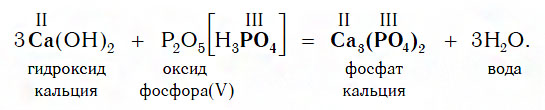Что получается при взаимодействии основания с кислотой
2.5. Характерные химические свойства оснований и амфотерных гидроксидов.
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2. Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних солей:
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.
Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000 o C:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 o C:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
Урок 35. Химические свойства кислот
В уроке 35 «Химические свойства кислот» из курса «Химия для чайников» узнаем о всех химических свойствах кислот, рассмотрим с чем они реагируют и что при этом образуется.
В состав молекулы любой кислоты обязательно входят атомы водорода, связанные с различными кислотными остатками. Такое подобие состава молекул обусловливает подобие химических свойств кислот. Оно выражается в том, что кислоты в водных растворах проявляют схожие химические свойства, называемые кислотными свойствами. Знание этих свойств очень важно для дальнейшего изучения химии, поэтому познакомимся с ними более подробно и систематизируем изученный ранее материал.
Изменение окраски индикаторов
Вы уже знаете, что для доказательства наличия кислоты или щелочи в растворе можно использовать особые вещества — индикаторы.
Вспомните, в какие цвета окрашены растворы индикаторов лакмуса, метилоранжа и фенолфталеина. Как изменяется их окраска в растворах кислот?
Взаимодействие с металлами
Из материала предыдущих тем вам известно, что в водных растворах многие кислоты реагируют с металлами, расположенными в ряду активности левее Н2 (например, Mg, Al, Zn, Fe). В результате этих реакций образуются сложные вещества — соли и выделяется газообразное простое вещество — водород:
В такие реакции вступают как бескислородные (HCl, HBr), так и кислородсодержащие (H2SO4, H3PO4) кислоты, например:
Реакции этого типа, как вы уже знаете, относятся к реакциям замещения: атомы металлов замещают (вытесняют) атомы водорода из молекул кислот.
Следует помнить, что металлы, расположенные в ряду активности правее Н2 (Сu, Ag, Hg и др.), с указанными кислотами в
водных растворах не реагируют.
Реакции с основными оксидами
Еще в младших классах, изучая математику, вы узнали, что от перемены мест слагаемых сумма не изменяется: 2 + 3 = 5; 3 + 2 = 5.
Похожее правило есть и в химии: если в уравнении реакции исходные вещества поменять местами, то ее продукты от этого не изменятся. Так, например, изучив ранее химические свойства основных оксидов, вы узнали, что они реагируют с кислотами с образованием солей и воды. Зная это, вы можете теперь смело утверждать, что кислоты реагируют с основными оксидами, образуя те же продукты — соли и воду:
Пример уравнения реакции, протекающей в соответствии с этой схемой:
Как вам уже известно, эти реакции относятся к реакциям обмена, поскольку в процессе взаимодействия исходные сложные вещества обмениваются своими составными частями.
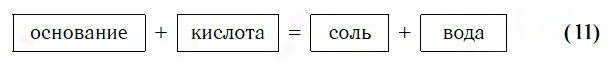
Взаимодействие с основаниями
Изучая химические свойства оснований, вы узнали, что они реагируют с кислотами с образованием солей и воды. А что же тогда образуется при взаимодействии кислот с основаниями? Правильно, те же самые продукты — соли и вода! Мы еще раз убедились в том, что состав конечных веществ не зависит от того, в каком порядке смешиваются одни и те же исходные вещества. Итак, составим схему, согласно которой кислоты реагируют с основаниями:
Запомните, что в образующейся соли валентность атомов металла такая же, как в исходном основании, а валентность кислотного остатка такая же, как в исходной кислоте.
Кислоты реагируют как с нерастворимыми, так и с растворимыми основаниями, например:
Реакции этого типа, как и предыдущего, относятся к реакциям обмена. Вспомните, как называется реакция, которую отображает последнее уравнение. Почему она так называется?
Взаимодействие с солями
Еще один класс сложных веществ, с которыми кислоты могут вступать в химическое взаимодействие, — соли. Реакции этого типа идут по общей схеме:
Однако сразу заметим, что кислота реагирует в растворе с солью лишь в том случае, если в результате реакции выделяется газ (↑) или образуется нерастворимое вещество, выпадающее в осадок (↓). Примеры таких реакций:
Очевидно, что реакции этого типа, как и двух предыдущих, относятся к реакциям обмена.
Разложение кислот на кислотные оксиды и воду
Известно несколько кислот, которые достаточно легко разлагаются на соответствующий кислотный оксид и воду. К таким кислотам, которые называют неустойчивыми, относят угольную (H2CO3), сернистую (H2SO3) и кремниевую (H2SiO3) кислоты. Особенно неустойчива угольная кислота — она разлагается на кислотный оксид CO2 и воду уже при комнатной температуре:
Краткие выводы урока:
Надеюсь урок 35 «Химические свойства кислот» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 37. Основания
В уроке 37 «Основания» из курса «Химия для чайников» узнаем о составе оснований, выясним на какие виды они подразделяются, а также рассмотрим с чем эти сложные веществ взаимодействуют.
Существует целый класс сложных неорганических веществ, в состав которых входят атомы металлов и группы ОН. Все вещества этого класса реагируют с кислотами с образованием солей, т. е. являются как бы «основой» солей. Поэтому класс таких веществ получил название основания.
Состав оснований
Вы уже знаете, что общая формула оснований — Me(OH)x, где Me — символ какого-либо металла, а индекс х — число групп OH, соединенных с одним его атомом. Обычно это число изменяется от 1 до 3.
Напомним, что основания NaOH, KOH, Mg(OH)2, Ca(OH)2, Fe(OH)2, Cu(OH)2 относятся к основным гидроксидам.
Классификация оснований
По растворимости в воде основания делятся на растворимые и нерастворимые. К растворимым основаниям относятся NaOH, KOH, Ba(OH)2, Ca(OH)2. Они имеют общее название — щёлочи. При обычных условиях это твердые вещества белого цвета. Нерастворимыми являются основания Mg(OH)2, Al(OH)3, Zn(OH)2, Fe(OH)2, Fe(OH)3 и некоторые другие. Они также представляют собой твердые вещества, многие из которых окрашены в разные цвета (рис. 120).
На заметку: Термин «щёлочь» происходит от старорусского слова «щёлок», обозначавшего отвар чего-либо в воде. Этим словом называли, например, жидкость, которая получается при кипячении смеси воды с золой растений. Вещество, содержащееся в золе, реагирует с водой и превращается в гидроксид калия KOH. Это соединение, содержащееся в щёлоке, назвали «щёлочь». Впоследствии данный термин стали использовать для всех растворимых оснований.
Химические свойства оснований
Для оснований характерны реакции обмена с кислотами и солями, реакции соединения с кислотными оксидами и реакции термического разложения.
Изменение окраски индикаторов
Вы уже знаете, что такое индикаторы и для чего они используются. Вспомните, в какие цвета окрашиваются лакмус, метилоранж и фенолфталеин в растворах щелочей.
Взаимодействие с кислотами
Практически все основания реагируют с кислотами с образованием солей по общей схеме:
Пример реакции, протекающей в соответствии с указанной схемой:
В результате реакции между щелочью и кислотой образуется раствор соли, в котором уже нет ни щелочи, ни кислоты. Такой раствор называется нейтральным. Слово «нейтральный» происходит от греческого «нейтер», что в переводе на русский язык означает «ни тот ни другой».
Напомним, что реакция между щелочью и кислотой, в результате которой образуется нейтральный раствор, называется реакцией нейтрализации.
Взаимодействие с кислотными оксидами
Все щелочи реагируют с кислотными оксидами по общей схеме:
Например, если в реакцию вступает кислотный оксид CO2, которому соответствует кислота H2CO3 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — CO3, валентность которого, как вы уже знаете, равна II:
Если же в реакцию вступает кислотный оксид P2О5, которому соответствует кислота H3PO4 (указана в квадратных cкобках), то в составе образующейся соли будет остаток этой кислоты — PO4 с валентностью, равной III:
Взаимодействие с солями
Все щелочи реагируют с солями по общей схеме:
Реакции этого типа относятся к реакциям обмена, поскольку в процессе взаимодействия исходные вещества — щелочь и соль — обмениваются своими составными частями. При этом валентность атомов металлов и кислотных остатков не изменяется.
Термическое разложение
Все нерастворимые основания при нагревании разлагаются по общей схеме:
Краткие выводы урока:
Надеюсь урок 37 «Основания» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Уроки по неорганической химии для подготовки к ЕГЭ
Свойства простых веществ:
Свойства сложных веществ:
Особенности протекания реакций:
Химические свойства оснований
1. Щелочи (растворимые основания) из металлов реагируют только с Zn, Be и Al:
Cr + NaOH → реакция не идет
Fe + NaOH → реакция не идет
2. Щелочи из неметаллов реагируют только с S, P, Si и галогенами:
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2).
2F2 + 2NaOH → OF2 + 2NaF + H2O (продукты этой реакции на ЕГЭ не проверяются, но необходимо знать, что реакция протекает)
3. Основания взаимодействуют с кислотами с образованием средних, кислых или основных солей. Тип соли зависит от соотношения реагентов: например, в избытке кислоты образуются кислые соли.
Условие: один из реагентов должен быть растворимым.
H2SiO3 + Cu(OH)2 → реакция не идет, так как и H2SiO3 и Cu(OH)2 нерастворимые.
4. Основания взаимодействуют с солями
Условие: 1) оба реагента должны быть растворимыми; 2) должен выпадать осадок или выделяться газ.
2NaOH + ZnCl2 → Zn(OH)2 
NaOH + NH4NO3 → NH3 
Cu(OH)2 + NaNO3 → реакция не идет, так как гидроксид меди (II) нерастворим.
5. Основания реагируют с кислотными оксидами. Если оксид в избытке образуется кислая соль:
6. Щелочи реагируют с амфотерными оксидами:
1) реакции в растворе:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
BeO + 2NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
2) реакции при сплавлении:
ZnO + 2NaOH → Na2ZnO2 + H2O (цинкат натрия)
BeO + 2NaOH → Na2BeO2 + H2O (бериллат натрия)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (метаалюминат натрия)
7. Щелочи реагируют с амфотерными гидроксидами:
1) реакции в растворе:
2) реакции при сплавлении:
8. Нерастворимые основания (а также Ca(OH)2 и LiOH) разлагаются при нагревании:
Химические свойства кислот, их классификация и реакции
Общие свойства кислот. Классификация
Кислоты — класс сложных химических веществ, состоящих из атомов водорода и кислотных остатков.
В первую очередь кислоты делятся на:
Свойства карбоновых кислот подробно разбираются в статье Карбоновые кислоты (ссылка на статью)
В зависимости от количества атомов водорода, которые могут замещаться в химических реакциях различают:
Не смотря на то, что в уксусной кислоте четыре атома водорода, три из них принадлежат кислотному остатку и в реакциях замещения не участвуют. Соответственно, уксусная кислота — одновалентная.
Свойства неорганических кислот также зависят от наличия в их составе кислорода и делятся на
Растворы кислот способны диссоциировать и проводить электрический ток т.е. являются электролитами. В зависимости от степени диссоциации делятся на:
Химические свойства кислот
1. Диссоциация
При диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
Многоосновные кислоты диссоциируют ступенчато.
НРО 2- 4 ↔ Н + + PО З- 4 (третья ступень)
2. Разложение
Кислородсодержащие кислоты разлагаются на оксиды и воду.
Бескислородные на простые вещества
3. Реакция с металлами
Кислоты реагируют лишь с теми металлами, что стоят в ряду активности до кислорода. В результате взаимодействия образуется соль и выделяется водород.
Найти ряд активности можно на последней странице электронного учебника «Химия 9 класс» под редакцией В. В. Еремина.
Бдительные ученики могут сказать: «Золото стоит в ряду активности металлов после водорода, а с „царской водкой“ реагирует. Как же так?»
Из всех правил есть исключения.
Поскольку в состав азотной кислоты входит азот со степенью окисления +5, а в состав серной — сера со степенью окисления +6, то с металлами реагируют не ионы водорода, а более сильные окислители. Образуется соль, но не происходит выделения водорода.
4. Реакции с основаниями
В результате образуются соль и вода, происходит выделение тепла.
Реакции такого типа называются реакциями нейтрализации. Простейшая реакция, которую можно провести на собственной кухне — гашение соды столовым уксусом или 9%раствором уксусной кислоты.
5. Реакции кислот с солями
Вспомним, когда мы разбирали ионные уравнения ( ссылка на статью), одним из условий протекания реакций было образование в ходе взаимодействия нерастворимой соли, выделение летучего газа или слабо диссоциирующего вещества — например, воды. Те же условия сохраняются и для реакций кислот с солями.
6. Реакция кислот с основными и амфотерными оксидами
В ходе реакции образуется соль и происходит выделение воды.
7. Восстановительные свойства бескислородных кислот
Если в окислительных реакциях первую скрипку играет водород, то в восстановительных реакциях основная роль принадлежит анионному остатку. В результате реакций образуются свободные галогены.
Физические свойства кислот
При нормальных условиях (Атмосферное давление = 760 мм рт. ст. Температура воздуха 273,15 K = 0°C) кислоты чаще жидкости, хотя встречаются и твердые вещества: например ортофосфорная H3PO4 или кремниевая H2SiO3.
Некоторые кислоты представляют собой растворы газов в воде: фтороводородная-HF, соляная-HCl, бромоводородная-HBr.
Кислотные свойства кислот в ряду HF → HCl → HBr → HI усиливаются.
Для некоторых кислот (соляная, серная, уксусная) характерен специфический запах.
Благодаря наличию ионов водорода в составе, кислоты обладают характерным кислым вкусом.
Химическая лаборатория не ресторан, и в целях безопасности существует жесткий запрет на опробование на вкус химических веществ.
Как же можно определить кислота в пробирке или нет?
В 1300 году был открыт лакмус, и с тех пор алхимикам и химикам не пришлось рисковать своим здоровьем, пробуя на вкус содержимое пробирок. Запомните, что лакмус в кислой среде краснеет.
Вторым широко используемым индикатором является фенолфталеин.
Простой мнемонический стишок поможет запомнить, как ведут себя индикаторы в разных средах.
Индикатор лакмус — красный
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щёлочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеиновый — в щелочах малиновый
Но несмотря на это в кислотах он без цвета.