Что понимается под обратимым процессом
Виды термодинамических процессов
Термодинамический процесс — это непрерывное изменение состояний системы, которое происходит в результате ее интеракции с внешней средой. После подобного взаимодействия происходит изменение одного из параметров системы — давления, температуры, объема.
Типы термодинамических процессов
Основными процессами в термодинамике являются:
Изохорный процесс — такой, который протекает при постоянном объеме.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Подобное явление можно наблюдать при нагревании газа в закрытом сосуде.
Изменение параметров газа можно описать с помощью закона Шарля:
при этом изменение объема ( \(\Delta V\) ) равно нулю, из чего можно сделать вывод, что при протекании данного процесса не совершается никакая работа.
Изобарный процесс — такой, который протекает при постоянном давлении.
Его можно осуществить при размещении газа, поместив газ в цилиндр с движущимся поршнем, который испытывает непрерывное воздействие внешней силы.
Этот термодинамический процесс математически выражается с помощью закона Гей-Люссака:
При этом газом выполняется работа по контрвоздействию на внешние силы.
Изотермический процесс — такой, который происходит при постоянной температуре.
Он практически не осуществим опытным путем ввиду его сложности.
Изотермический процесс описан формулой закона Бойля-Мариотта:
Работа газа при его протекании определяется выражением:
Адиабатный процесс — такой, при котором не наблюдается обмена теплом между термодинамической системой и внешней средой.
Политропный процесс — при его протекании возможны изменения любого параметра. Все упомянутые выше разновидности являются его частными случаями.
Обратимые и необратимые процессы в термодинамике
Свойства обратимых процессов:
Следует отметить, что обратимые процессы возможны только в лабораторных условиях, в природе они не существуют и служат скорее математическими моделями. Однако преуменьшать их значимость также не стоит: все количественные положения термодинамики применимы в отношении равновесных систем и обратимых процессов. Это происходит потому, что они все равно приближены к реальным.
Свойства необратимых процессов:
Все реально существующие в природе процессы являются необратимыми. Приведем несколько примеров:
Процессы, связанные с кинетикой, также характеризуются необратимостью.
Формулировка первого и второго закона термодинамики
Первый закон термодинамики: изменение внутренней энергии системы при переходе из одного состояния в другое равно сумме количества теплоты, подведенной к системе извне и работе действующих на нее внешних сил.
Формула представлена следующим образом:
Для второго закона термодинамики необходимо определить понятие энтропии.
Энтропия (S) — это физическая величина, необходимая для точного и достоверного описания термодинамической системы.
Таким образом, второе начало термодинамики придает энтропии смысл функции состояния термодинамической системы. В изолированной системе энтропия либо остаётся неизменной, либо возрастает (в неравновесных процессах), достигая максимума при установлении термодинамического равновесия.
Все формулировки второго закона (начала) термодинамики, встречающиеся в научной литературе, восходят к закону возрастания энтропии.
Формулировки второго закона термодинамики:
Клаузиус: «Переход тепла от тела с невысокой температурой к другому телу с более высоким уровнем температуры невозможен».
Томсон: «Любой процесс является невозможным, если для его осуществления должно использоваться тепло взятое от постороннего тела».
Больцман: «Состояние энтропии не может стать меньше в полностью закрытых системах, которые не получают никакую внешнюю энергию».
Обратимый процесс
Полезное
Смотреть что такое «Обратимый процесс» в других словарях:
ОБРАТИМЫЙ ПРОЦЕСС — в термодинамике, процесс перехода термодинамич. системы из одного состояния в другое, допускающий возможность возвращения её в первонач. состояние через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимых в… … Физическая энциклопедия
ОБРАТИМЫЙ ПРОЦЕСС — в термодинамике процесс, который возможно осуществить в обратном направлении, последовательно повторяя в обратном порядке все промежуточные состояния прямого процесса. Обратимым процессом может быть только равновесный процесс. Реальные процессы,… … Большой Энциклопедический словарь
ОБРАТИМЫЙ ПРОЦЕСС — ОБРАТИМЫЙ ПРОЦЕСС, всякий процесс, который может при определенных условиях протекать в обратном направлении, т.е. так, что параметры, определяющие систему, изменяются в обратном порядке относительно их первоначальных значений. Если при прямом… … Научно-технический энциклопедический словарь
обратимый процесс — Термодинамический процесс, после которого система и взаимодействующие с ней системы (окружающая среда) могут возвратиться в начальное состояние без того, чтобы в системе и окружающей среде возникали какие либо остаточные изменения. [Сборник… … Справочник технического переводчика
обратимый процесс — – процесс, протекающий в данных условиях равновесно в прямом и обратном направлении. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Обратимый процесс — Эта статья слишком короткая. Пожалуйста … Википедия
обратимый процесс — в термодинамике, процесс, который возможно осуществить в обратном направлении, последовательно повторяя в обратном порядке все промежуточные состояния прямого процесса. Обратимый процесс может быть только равновесный процесс. Реальные процессы,… … Энциклопедический словарь
обратимый процесс — [reversible process] процесс перехода термодинамической системы из одного состояния в другое, допускающее возможность возвращения ее в первоначальное состояние через ту же последовательность промежуточных состояний, но в обратном порядке.… … Энциклопедический словарь по металлургии
обратимый процесс — Термодинамический процесс, после которого система и взаимодействующие с ней системы (окружающая среда) могут возвратиться в начальное состояние без того, чтобы в системе и окружающей среде возникали какие либо остаточные изменения. обратимый… … Политехнический терминологический толковый словарь
обратимый процесс — grįžtamasis vyksmas statusas T sritis Standartizacija ir metrologija apibrėžtis Sistemos būsenos kitimas, kuris gali vykti įprastine ir atvirkštine tvarka, nekeisdamas aplinkos. atitikmenys: angl. reversible process vok. reversibler Prozess, m;… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
обратимый процесс — grįžtamasis procesas statusas T sritis chemija apibrėžtis Sistemos būsenos kitimas, kuris gali vykti įprastine ir atvirkštine tvarka, nekeisdamas aplinkos. atitikmenys: angl. reversible process rus. обратимый процесс … Chemijos terminų aiškinamasis žodynas
Необратимые и обратимые процессы



1. Обратимым термодинамическим процессом называется термодинамический процесс, допускающий возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения. Необходимым и достаточным условием обратимости термодинамического процесса является его равновесность.
2. Необратимым термодинамическим процессом называется термодинамический процесс, не допускающий возможности возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения. Все реальные процессы протекают с конечной скоростью. Они сопровождаются трением, диффузией и теплообменом при конечной разности между температурами системы и внешней среды. Следовательно, все они неравновесны и необратимы.
Необратимость возникает только в том случае, если частиц много. Если мы имеем систему из большого числа частиц – появляются другие новые законы. Если заснимем движение частицы на пленку, то в любом направлении просмотра всё будет нормально для нас. Если заснимем растворение кристалла и посмотрим в обратном направлении – понятно, что такого не бывает. Для рассмотрения необратимых процессов нужны системы из б.ч.ч. Движение одной частицы обратимо, а группы частиц – необратимо. Для описания системы из б.ч.ч. можно использовать термодинамический или статический метод.
· При термодинамическом методе не важен состав. Важно, как меняется система при действии на нее. Уравнение теплового баланса и уравнение Менделеева-Клапейрона достигло этого подхода. Алгебраическая сумма всех количеств теплоты (поглощенных и выделенных) в теплоизолированной системе равна нулю. Q1+ Q2+…+ Qn= 0, где n – количество тел системы. Q = сm(t2 – t1), где m – масса тела, кг; (t2 – t1) – разность температур тела,° С (или К); с – удельная теплоёмкость вещества, из которого состоит тело. Термодинамика – описательная наука, позволяет исключить невозможные сценарии развития в системе.
· Функция распределения Максвелла. Пусть имеется n тождественных молекул, находящихся в состоянии беспорядочного теплового движения при определенной температуре. После каждого акта столкновения между молекулами, их скорости меняются случайным образом. В результате невообразимо большого числа столкновений устанавливается стационарное равновесное состояние, когда число молекул в заданном интервале скоростей сохраняется постоянным. В результате каждого столкновения проекции скорости молекулы испытывают случайное изменение на Δυx, Δυy, Δυz, причем изменения каждой проекции скорости независимы друг от друга. Будем предполагать, что силовые поля на частицы не действуют. Найдем в этих условиях, каково число частиц dn из общего числа n имеет скорость в интервале от υ до υ+Δυ. Скорость – векторная величина. Для проекции скорости на ось х (x-й составляющей скорости) из имеем 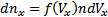
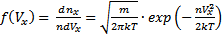
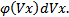
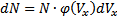
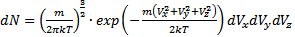
Если собрать вместе все молекулы в единице объёма, скорости которых заключены в интервале от υ до υ+dυ по всем направлениям, и выпустить их, то они окажутся через одну секунду в шаровом слое толщиной dυ и радиусом υ (рис. 2.4). Этот шаровой слой складывается из тех параллелепипедов, о которых говорилось выше.
Объём этого шарового слоя 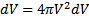
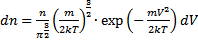
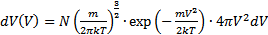
В системах из б.ч.ч. всё равно поддерживается равновесие. С точки зрения механики нельзя эту систему назвать равновесной (сумма сил равна 0, сумма моментов сил равна 0 должна быть) – механическое равновесие. В термодинамике – термодинамическое равновесие: система, находящаяся в термодинамическом равновесии, если ответственные за обмен с внешней средой характеристики имеют одинаковые значения в системе и во внешней среде. Еще есть химическое равновесие. Есди система теплоизолирована, то не будет переноса тепла и выравнивания не будет.
27. Открытые и закрытые системы.
Изолированная система – ничем не могут обмениваться.
Закрытая система – могут обмениваться энергией, но не могут веществом (тут устанавливается равновесие, направление t выравнивается). Понятие равновесия – не потоков.
Открытая система – могут обмениваться и энергией, и веществом (живые системы всегда открытые).
В химическом равновесии химические потенциалы должны быть одни (отсутствие градиентов химических потенциалов).
В физике 19 века считали, что нет необратимых процессов. В конце 19 века после теории теплопроводности описали выравнивание температуры. И задумались, что необратимые процессы есть. Часто механически нельзя описать все процессы.
Обратимые и необратимые процессы
Вы будете перенаправлены на Автор24
Рассмотрим систему тел или просто систему. Как уже отмечалось, состояние системы характеризуется рядом параметров, которые называются параметрами состояния ($p,V,T$). Равновесным состоянием системы называется такое состояние, при котором все параметры системы имеют определенные значения, которые не изменяются бесконечно долго при отсутствии внешнего воздействия. В термодинамической диаграмме равновесное состояние изображается точкой. Понятно, что неравновесное состояние так не изобразишь, так как хотя бы один из параметров в этом случае не будет иметь определенного значения.
Обратимый процесс
Необратимый процесс
Готовые работы на аналогичную тему
Необратимым термодинамическим процессом называют процесс, который нельзя повернуть вспять без изменения во внешней среде.
Все реальные процессы идут с конечной скоростью. В ходе этих процессов возникают силы трения, теплообмен, диффузия. Понятно, что они все необратимы. Любой необратимый процесс в «прямом направлении» протекает сам, а для того, чтобы система вернулась в начальное состояние, необходимо изменение во внешней среде (внешних телах). Необратимые процессы нельзя отобразить на термодинамических диаграммах. Можно лишь условно изобразить необратимый процесс, если попытаться разделить его на куски, процессов которые считать равновесными. Это изображение все равно будет лишь условным. Так как в действительном необратимом процессе система будет проходить через другие состояния, которым соответствуют точки на диаграмме. Неравновесный процесс не может быть обратимым, он всегда необратим.
Простым примером необратимого процесса, который часто рассматривается в термодинамике, является переход тепла от нагретого тела к холодному.
Изменение состояния системы всегда связано с переходом в неравновесное состояние. Возвращение системы в равновесие всегда требует времени.
Если мы пытаемся в системе провести ряд равновесных процессов, то мы всегда столкнемся со словосочетанием почти равновесных. Потому что само равновесное состояние реализуется при помощи флуктуаций через неравновесные состояния.
Сделаем ряд выводов:
При тепловом контакте тел их температуры выравниваются.
Из (1.1) выразим температуру:
Опишем процесс передачи тепла с точки зрения обратимого и необратимого процесса. В необратимом процессе мы имеем ситуацию из условий задачи. А именно: два тела были изолированы друг от друга и имели разную температуру. Потом их приводят в тепловой контакт. В результате теплообмена их температура выравнивается и становится равной T (1.2). Однако переход из состояния 1 в состояние 2 можно совершить с помощью обратимых процессов. А именно: будем считать, что тела изолированы, и каждое из них обратимым процессом переводится в состояние при температуре T. После этого они приводятся в контакт, но это уже не меняет их состояние. В первом и втором процессах (обратимом и необратимом) начальные и конечные состояния одинаковы, следовательно, одинаково будет и изменение энтропии. Рассчитаем его с помощью формулы (изменения энтропии для обратимого процесса):
\[\delta Q=mc_VdT\ \left(1.4\right).\]
Подставим (1.4) для каждого тела в (1.3), получим:
Подставим в (1.5) T из (1.2), сравним с нулем:
Рассмотрим, какие процессы происходят (разберем текст задачи). Сосуд имеет две части, одна заполнена газом, во второй вакуум. Когда поршень, который разделяет газ, отпустили, газ расширяется, двигает поршень. Происходит необратимый процесс. Изменяется давление, объем газа, но не изменяется температура (сосуд теплоизолированный). Через некоторый промежуток времени система приходит в состояние равновесия. Начинается процесс сжатия газа, процесс можно считать равновесным, так как сказано, что он медленный.
\[\triangle U=\frac<2>R\triangle T\ \left(2.1\right),\]
Второй процесс обратим и происходит в теплоизолированном сосуде, следовательно, его считаем адиабатным, т.е.:
Показатель адиабаты можно рассчитать через число степеней свободы молекулы как:
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 26 11 2021
ОБРАТИМЫЙ ПРОЦЕСС
Смотреть что такое «ОБРАТИМЫЙ ПРОЦЕСС» в других словарях:
ОБРАТИМЫЙ ПРОЦЕСС — в термодинамике, процесс перехода термодинамич. системы из одного состояния в другое, допускающий возможность возвращения её в первонач. состояние через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимых в… … Физическая энциклопедия
ОБРАТИМЫЙ ПРОЦЕСС — в термодинамике процесс, который возможно осуществить в обратном направлении, последовательно повторяя в обратном порядке все промежуточные состояния прямого процесса. Обратимым процессом может быть только равновесный процесс. Реальные процессы,… … Большой Энциклопедический словарь
ОБРАТИМЫЙ ПРОЦЕСС — ОБРАТИМЫЙ ПРОЦЕСС, всякий процесс, который может при определенных условиях протекать в обратном направлении, т.е. так, что параметры, определяющие систему, изменяются в обратном порядке относительно их первоначальных значений. Если при прямом… … Научно-технический энциклопедический словарь
обратимый процесс — Термодинамический процесс, после которого система и взаимодействующие с ней системы (окружающая среда) могут возвратиться в начальное состояние без того, чтобы в системе и окружающей среде возникали какие либо остаточные изменения. [Сборник… … Справочник технического переводчика
обратимый процесс — – процесс, протекающий в данных условиях равновесно в прямом и обратном направлении. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Обратимый процесс — Эта статья слишком короткая. Пожалуйста … Википедия
обратимый процесс — в термодинамике, процесс, который возможно осуществить в обратном направлении, последовательно повторяя в обратном порядке все промежуточные состояния прямого процесса. Обратимый процесс может быть только равновесный процесс. Реальные процессы,… … Энциклопедический словарь
обратимый процесс — [reversible process] процесс перехода термодинамической системы из одного состояния в другое, допускающее возможность возвращения ее в первоначальное состояние через ту же последовательность промежуточных состояний, но в обратном порядке.… … Энциклопедический словарь по металлургии
обратимый процесс — Термодинамический процесс, после которого система и взаимодействующие с ней системы (окружающая среда) могут возвратиться в начальное состояние без того, чтобы в системе и окружающей среде возникали какие либо остаточные изменения. обратимый… … Политехнический терминологический толковый словарь
обратимый процесс — grįžtamasis vyksmas statusas T sritis Standartizacija ir metrologija apibrėžtis Sistemos būsenos kitimas, kuris gali vykti įprastine ir atvirkštine tvarka, nekeisdamas aplinkos. atitikmenys: angl. reversible process vok. reversibler Prozess, m;… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
обратимый процесс — grįžtamasis procesas statusas T sritis chemija apibrėžtis Sistemos būsenos kitimas, kuris gali vykti įprastine ir atvirkštine tvarka, nekeisdamas aplinkos. atitikmenys: angl. reversible process rus. обратимый процесс … Chemijos terminų aiškinamasis žodynas


