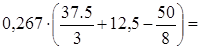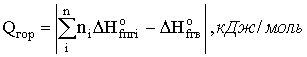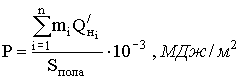Что понимается под теоретически необходимым расходом воздуха на горение
Теоретический и практический расход воздуха на горение.
Расчет объема воздуха, необходимого для горения, предполагает вычисление:
Горение может происходить не только при стехиометрическом соотношении компонентов, но и при значительном отклонении от него. Как правило, в условиях пожара на сгорание вещества воздуха затрачивается больше, чем определяется теоретическим расчетом. Избыточный воздух DVв в реакции горения не расходуется и удаляется из зоны реакции вместе с продуктами горения. Таким образом, практический объем воздуха равен:
и, следовательно, избыток воздуха будет равен:
Обычно в расчетах избыток воздуха при горении учитывается с помощью коэффициента избытка воздуха (a). Коэффициент избытка воздуха показывает, во сколько раз в зону горения поступило воздуха больше, чем это теоретически необходимо для полного сгорания вещества:
Для горючих смесей стехиометрического состава (т.е. состава, соответствующего уравнению реакции горения) коэффициент избытка воздуха a = 1, при этом реальный расход воздуха равен теоретическому. В этом случае обеспечивается оптимальный режим горения.
Зная содержание кислорода в продуктах горения, можно определить коэффициент избытка воздуха (коэффициент участия воздуха в горении) на реальном пожаре:
Расчет выполняется двумя способами: по уравнению химической реакции и по элементному составу вещества:
Способ
Записываем уравнение реакции горения изобутилового спирта:
По условию масса изобутилового спирта равна 1 кг., условия нормальные, тогда:


Способ
Процентный элемент состава изобутилового спирта:
Найдем объем воздуха на горение по формуле для изобутилового спирта с известным процентным составом, тогда:
Vв теор =
объем воздуха равен 5 м 3 при коэффициенте избытка воздуха
Теоретический и практический расход водуха на горение



Удельным теоретическим расходом воздуха Vв° называется минимальное его количество, необходимое для полного сгорания единицы массы горючего вещества при нормальных условиях.
Теоретическое количество воздуха (или другого окислителя) рассчитывается по уравнению материального баланса горения с учетом стехиометрических коэффициентов, то есть когда горючее и окислитель находятся в стехиометрическом соотношении.
Стехиометрическое количество воздуха в уравнении реакции горения предполагает, что при данном соотношении компонентов, участвующих в реакции горения, воздух расходуется полностью. Объем воздуха в данном случае называется теоретическим (Vв теор ).
Горение может происходить не только при стехиометрическом соотношении компонентов, но и при значительном отклонении от него. Как правило, в условиях пожара на сгорание вещества воздуха затрачивается больше, чем определяется теоретическим расчетом. Избыточный воздух DVв в реакции горения не расходуется и удаляется из зоны реакции вместе с продуктами горения. Таким образом, практический объем воздуха равен :
и, следовательно, избыток воздуха будет равен
Обычно в расчетах избыток воздуха при горении учитывается с помощью коэффициента избытка воздуха (a). При этом следует помнить, что в избыток воздуха входит только кислород и азот.
Коэффициент избытка воздуха при кинетическом горениипоказывает отклонение газопаровоздушной смеси от стехиометрической концентрации. При стехиометрической концентрации α=1. В данном случае коэффициент избытка воздуха может быть как больше, так и меньше 1, но ограничен область воспламенения.
Величина a является важной характеристикой машин и агрегатов, в которых осуществляется организованное горение.
Для горючих смесей стехиометрического состава (т.е. состава, соответствующего уравнению реакции горения), где коэффициент избытка воздуха a = 1, реальный расход воздуха равен теоретическому. В этом случае обеспечивается оптимальный режим горения. Однако добиться полной однородности смеси чрезвычайно трудно. Существующие для этой цели технические средства не позволяют в полной мере обеспечить стехиометрическое соотношение компонентов при реакции горения и создать однородную смесь. Регулирование значения коэффициента избытка воздуха дает возможность максимально приблизиться к оптимальным условиям сжигания.
Почти всегда a несколько больше единицы и находится в интервале значений:
1,02 – 1,3 в зависимости от характера сжигаемого вещества. Именно этим обусловлено название коэффициента a— коэффициент избытка воздуха. В действительности для кинетического горения его значения могут быть как больше, так и меньше 1.
В условиях пожара обычно преобладает диффузионный режим горения.В закрытом объеме диффузионное горение большинства горючих материалов возможно только до определенной пороговой концентрации кислорода, так называемой остаточной концентрации кислорода в продуктах горения. Т.е. при диффузионном горении, кислород воздуха не весь задействуется на горение. Для различных веществ и материалов остаточное содержание кислорода в продуктах сгорания может составлять 8-16%. Таким образом, на горение расходуется только часть кислорода, поэтому для полного сгорания рассматриваемого вещества потребуется воздуха больше, чем теоретически необходимое.
Коэффициент избытка воздуха для диффузионного горения правильнее назвать коэффициент участия воздуха в горении. Эта характеристикаболее полно отражает суть процесса горения на пожаре и не дает ошибочных представлений и понятий. Это важный параметр, определяющий динамику развития пожара и, как следствие, развитие его опасных факторов.
Отношение объема воздуха, практически пошедшего на горение при диффузионном горении, к теоретически необходимому, называется коэффициентом избытка воздуха и обозначается греческой буквой α (альфа):
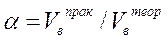
его можно определить также по выражению:
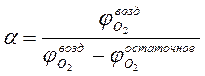
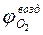
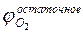
Физический смысл коэффициента избытка воздуха при диффузионном горении заключается в том, на сколько не полностью может быть (или был) задействован кислород воздуха при горении.
Формула для расчета практического объема воздуха для сгорания заданного количества горючего вещества имеет вид:
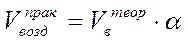
Очевидным является, что при горении в диффузионном режиме, коэффициент избытка воздуха может иметь значения более 1. На практике значение этого коэффициента обычно составляет 2-5.
Расчет объема воздуха, необходимого для горения, предполагает вычисление:
Алгоритм расчета теоретического количества воздуха зависит от агрегатного состояния вещества и его химической природы. Для удобства вычислений горючие вещества подразделяют на три основные группы:
· индивидуальные химические соединения с известной химической формулой (метан, ацетон, спирты и т.д.);
· конденсированные горючие вещества неизвестного химического строения, но с известным элементным составом (элементный состав отражает содержание в веществе химических элементов С, Н, О, S, N, C1 и др. в % масс.);
Теоретический и практический расход воздуха на горение
Удельным теоретическим расходом воздуха 
Теоретическое количество воздуха (или другого окислителя) рассчитывается по уравнению материального баланса горения с учетом стехиометрических коэффициентов, то есть когда горючее и окислитель находится в стехиометрическом соотношении.
Стехиометрическое соотношение воздуха в уравнении реакции горения предполагает, что при данном соотношении компонентов, участвующих в реакции горения, воздух расходуется полностью. Объем воздуха в данном случае называется теоретическим ( 
Горение может происходить не только при стехиометрическом соотношении компонентов, ни и при значительном отклонении от него. Как правило, в условиях пожара не сгорание вещества воздуха затрачивается больше, чем определяется теоретическим расчетом. Избыточный воздух 
Избыток воздуха обычно рассчитывается с помощью коэффициента избытка воздуха (α).
Коэффициент избытка воздуха при кинетическом горении показывает отклонение газопаровоздушной смеси от стехиометрической концентрации. При стехиометрической концентрации α=1. Почти всегда α больше единицы и находится в интервале значений: 1,02 – 1,3 в зависимости от характера сжигаемого вещества.
При α>1 горючую смесь называют бедной по горючему компоненту, а при α 1, поэтому следует учесть избыток воздуха при горении:
7. Практический расход воздуха равен:
Ответ: удельный теоретический расход воздуха при горении диоксан при заданных условиях составляет 6,22 

Решение 2.2.2.Расчёт расхода воздуха по элементному составу вещества
Определим теоретический и практический объем воздуха для полного сгорания 1 кг диоксан C4H8O2 при температуре 15 
1.Вычислим массовые доли элементов в веществе:
Молярная масса диоксана составляет

2.Найдем начальный теоретический объём воздуха

4.Корэффициент избытка воздуха по условию задачи
5.Практический расход воздуха равен:
Ответ: удельный теоретический расход воздуха при горении диоксана при заданных условиях составляет 6,3 

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Что понимается под теоретически необходимым расходом воздуха на горение
Параметры процесса горения определяются его материальным и энергетическим балансом.
Основные понятия материального баланса процесса горения.
Материальный баланс процесса горения соотношение (равенство) между количеством веществ, которые вступают в реакцию горения, и количеством веществ (продуктов горения), которые получаются вследствие этой реакции.
Расход воздуха на горение
При горении происходит взаимодействие между молекулами горючего вещества и окислителя, при этом получаются продукты сгорания.
Горючее вещество + Окислитель ⇒ Продукты сгорания
Как правило, окислителем при горении выступает кислород воздуха. Схематично химическую реакцию сгорания одного моля вещества в воздухе можно представить уравнением:
Это лишь суммарная реакция, но она достаточна для проведения практических расчетов и является обобщенной записью материального баланса реакции горения.
Таким образом, действительный удельный объем воздуха равняется:
Часть воздуха, неизрасходованная на горение, переходит в продукты горения.
В случае кинетического горения при α в = 1, смесь горючего с воздухом является стехиометрической. Величина тепловыделения на единицу продуктов сгорания при этом максимальна вследствие чего температура в зоне горения также максимальна.
При α в в > 1 смесь называется бедной. В ней недостаток горючего вещества и излишек окислителя. При этом продукты горения включают в себя избыток воздуха.
Продукты горения это газообразные, твердые и жидкие вещества, образующиеся в процессе горения.
Состав продуктов горения зависит от состава горючего вещества и условий протекания реакции горения. Продукты горения образуют дым.
Дым дисперсная система, состоящая из твердых и жидких частиц (дисперсной фазы), находящихся в газовой дисперсионной среде.
Свойства дыма характеризуются следующими параметрами:
Концентрация дыма это масса продуктов горения, находящихся в единице объема. В зоне задымления концентрация продуктов горения находится в интервале от 1·10 4 до 5·10 3 кг/м³.
Наличие конденсированной фазы обуславливает непрозрачность дыма. Степень снижения прозрачности зависит от концентрации, размера и природы частиц дисперсной фазы. Параметром, характеризующим оптические свойства дыма, является плотность задымления.
Содержание кислорода. В обычных условиях содержание кислорода в воздухе составляет 21% (объемный). Снижение концентрации кислорода в воздухе приводит к кислородному голоданию людей. Так при снижении концентрации ниже 16% работа без индивидуальных средств защиты органов дыхания невозможна.
Токсичность продуктов горения способность продуктов горения вызвать отравления людей, находящихся без индивидуальных средств защиты органов дыхания.
Температура дыма.Температура продуктов горения непосредственно возле зоны горения может достигать 1000°С, но в помещениях температура дыма обычно существенно ниже. Основным фактором, влияющим на температуру дыма, являются условия газообмена. При увеличении коэффициента избытка воздуха температура продуктов горения снижается. Однако опасной для людей температурой считается уже температура 70°С. Продолжительное пребывание при такой температуре связано с риском для жизни из-за перегрева организма.
Продукты неполного сгорания, образующиеся при горении веществ и материалов в закрытых помещениях, при поступлении свежего воздуха могут образовывать горючую смесь. Горение при этом происходит в кинетическом режиме (взрыв).
ОСНОВНЫЕ ПОНЯТИЯ ЭНЕРГЕТИЧЕСКОГО БАЛАНСА ПРОЦЕССА ГОРЕНИЯ
Под тепловым эффектом реакции понимают количество теплоты, которое выделяется или поглощается системой в ходе реакции.
В тех случаях, когда теплосодержание системы после реакции уменьшается (реакция идет с выделением энергии), реакция является экзотермической. Если теплосодержание конечных продуктов выше исходных (реакция идет с поглощением энергии), реакция является эндотермической.
Теплосодержание системы определяется теплотами образования компонентов системы (продуктов горения и исходного вещества). Таким образом тепловой эффект реакции можно записать:
где ΔH o fпг и ΔH o f гв теплота образования продуктов горения и исходных горючих веществ соответственно.
Теплота образования веществ определяется по справочникам или рассчитывается исходя из структуры вещества.
Теплотой сгорания называется количество тепла, выделяющееся при полном сгорании единицы количества вещества при условии, что начальные и конечные продукты находятся в стандартных условиях.
Различают молярную Q для одного моля (кДж/моль), массовую Q′ − для одного килограмма (кДж/кг), объемную Q″ − для одного кубического метра вещества (кДж/м³) теплоту сгорания.
В зависимости от агрегатного состояния воды, образовавшейся в процессе горения, различают высшую Q в и низшую Q н теплоту сгорания.
Высшей теплотой сгорания называется количество тепла, которое выделяется при полном сгорании единицы количества горючего вещества (жидком) состоянии.
Низшей теплотой сгорания называется количество тепла, которое выделяется при полном сгорании единицы количества горючего вещества при условии, что вода в продуктах горения находится в газообразном состоянии.
Молярную теплоту сгорания рассчитывают в соответствии с законом Гесса:
Для переcчета молярной теплоты сгорания Q в массовую Q′ можно использовать формулу:
Для веществ в газообразном состоянии при пересчете из стандартной теплоты сгорания Q в объемную Q″ используют формулу:
где Vμ объем киломоля газа, который при стандартных условиях составляет 22,4 м³/кмоль.
Для сложных горючих веществ или смесей можно вывести формулу определения теплоты сгорания исходя из состава и процентного содержания компонентов.
Достаточно точные результаты дает формула Менделеева для высшей теплоты сгорания:
Q в ′ = 339,4·φ С + 1256,8·φ Н + 108,9(φ S − φ O – φ N ), кДж/кг,
Для низшей теплоты сгорания:
Q н ′ = Q в ′ 25,1(9·φ Н + W%), кДж/кг,
где W% − содержимое влаги в горючем веществе.
Теплота сгорания имеет большое практическое значение при расчете пожарной нагрузки и параметров пожара.
Под пожарной нагрузкой Р пож понимают количество тепла, которое может выделиться при сгорании веществ и материалов, приходящихся на один квадратный метр поверхности пола помещения, МДж/м².
Пожарная нагрузка является количественной характеристикой, определяющей тепловое влияние пожара на строительные конструкции. Пожарную нагрузку рассчитывают как сумму произведений масс всех горючих материалов на их низшую теплоту сгорания, отнесенную к единице поверхности пола по формуле:
Низшая теплота сгорания также используется для определения пожарной опасности горючих веществ. Экспериментально доказано, что вещества являются негорючими, если они не относятся к взрывоопасным и их низшая теплота сгорания меньше, чем 2100 кДж/кг или 1830 кДж/м³.
Тепло, выделяющееся в зоне горения, расходуется на нагревание продуктов горения и теплопотери (к последним относятся предварительный нагрев горючего вещества и излучение из зоны горения в окружающую среду).
Максимальная температура в зоне горения, до которой нагреваются продукты горения, называется температурой горения.
В зависимости от условий, в которых протекает процесс горения различают калориметрическую, теоретическую, адиабатическую и действительную температуры горения.
Под калориметрической температурой горения понимают температуру, до которой нагреваются продукты горения при соблюдении следующих условий:
1) все тепло, выделившееся в процессе реакции, идет на нагревание продуктов горения;
2) происходит полное сгорание стехиометрической горючей смеси, коэффициент избытка воздуха α в = 1 ;
3) в процессе образования продуктов горения не происходит их диссоциация;
4) горючая смесь находится при начальной температуре 273К и давлении 101,3 кПа.
Теоретическая температура горения отличается от калориметрической тем, что в расчетах учитываются теплопотери на диссоциацию продуктов горения.
Диссоциацию продуктов горения нужно учитывать при температурах выше 1700°С.
Адиабатическая температура горения отличается от калориметрической тем, что определяется с учетом коэффициента избытка воздуха.
Действительная температура горения это температура, до которой нагреваются продукты горения в реальных условиях.
Температуру горения используют при расчетах давления взрыва, для определения площади легкосбрасываемых конструкций, температуры пожара и других параметров.
Расход воздуха при горении
Минимальное количество воздуха, необходимое для полного сгорания единицы массы (кг) или объема (м 3 )горючего вещества, называется теоретически необходимым и обозначается 
| Горючее вещество | Количество воздуха для сгорания 1 кг вещества при 101,3 кПа | Горючее вещество | Количество воздуха для сгорания 1 кг вещества при 101,3 кПа | ||
| кг | м 3 | кг | м 3 | ||
| Ацетон | 9,45 | 7,35 | Ацетилен | 15,4 | 11,9 |
| Бензол | 13,2 | 10,25 | Бутан | 39,8 | 30,94 |
| Бензин | 14,3 | 11,1 | Водород | 3,08 | 2,38 |
| Древесина | 5,4 | 4,18 | Водяной газ | 2,84 | 2,2 |
| Керосин | 14,85 | 11,5 | Метан | 12,3 | 9,52 |
| Нефть | 13,9 | 10,8 | Окись углерода | 3,08 | 2,38 |
| Толуол | 12,9 | 10,0 | Пропан | 30,6 | 23,8 |
| Торф (воз-душно-сухой) | 7,5 | 5,8 | Природ-ный газ | 6,45 | 5,0 |
В таблице 1.2 приведены значения теоретически необходимых количеств воздуха для полного сгорания различных веществ при 0 °С и 101,3 кПа. Значения величин, приведенных для древесины, торфа, бензина, керосина, нефти и водяного газа, являются средними, так как состав этих горючих материалов непостоянен.
Теоретически необходимое количество воздуха для сгорания 1 кг вещества равно (из пропорции):

Подобным образом выводится уравнение для определения теоретически необходимого количества воздуха для сгорания 1 м 3 горючих газов:

Если объемы воздуха, полученные по формулам (1.2) и (1.3), необходимо привести к иным условиям температуры и давления, то пользуются формулой:

где 

Такие вещества, как древесина, торф, каменный уголь, нефть, являясь горючими веществами, представляют собой сложную смесь химических соединений. При определении теоретически необходимого для их сгорания объема воздуха нужно знать элементарный состав горючего вещества, выраженный в весовых процентах, т. е. содержание углерода, водорода, кислорода, серы, азота, золы и влаги. Элементарный состав вещества определяют в аналитических лабораториях.
Для вывода уравнения расчета 
12 + 32 = 44; 4 + 32 = 36; 32 + 32 = 64;
Если для сгорания 12 кг углерода требуется 32 кгкислорода, то для 0,01 кг углерода (1 весовой процент) потребуется кислорода 0,01·32/12 = 0,01·8/3 (кг), для водорода соответственно потребуется 0,01·32/4 = 0,01·8 (кг) кислородаи для серы 0,01·32/32 = 0,01·1 (кг) кислорода.
Для полного сгорания 1 кг горючего вещества потребуется кислорода (в кг):
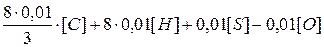
где [С], [Н], [S] и [О] — содержание углерода, водорода, серы и кислорода в горючем веществе; весовой процент.
На вычисленное количество кислорода в воздухе приходится в 77/23 раза больше азота. Сумма азота и кислорода составляет количество воздуха (в кг). Количество воздуха 

Проведя преобразования, получим:


Рассмотрим горючее вещество, как смесь газов. К этой группе веществ относятся горючие газы, например, природный, доменный, коксовый и др. Все они в том или ином количестве содержат СО, СН4, H2, H2S, C2Н4 и другие компоненты. Состав горючих газов обычно выражают в объемных процентах.
Для вывода формулы расчета 
Для полного сгорания 1 м 3 горючего газа потребуется кислорода (в м 3 ):

где [СН4], [Н2], [СО], [H2S] и [О2] — содержание метана, водорода, окиси углерода, сероводорода и кислорода, объемный процент.
В воздухе на этот объем кислорода приходится в 79/21 раза больше азота. Сумма азота и кислорода составляет объем (м 3 ) воздуха, необходимый для сгорания 1 м 3 газа:
Сделав преобразования, получим:

Практически при горении во время пожара расходуется воздуха значительно больше теоретически необходимого. Разность между количеством воздуха, практически расходуемым на горение и теоретически необходимым, называется избытком воздуха. Отношение же количества воздуха, практически расходуемого на горение ( 
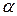

Для ориентировочных расчетов необходимое количество воздуха для сгорания 1 кг горючего вещества можно рассчитать по формуле:

где 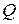
Тепловая способность горючего вещества 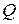

где 

В условиях пожара, когда горение протекает с естественным притоком воздуха, коэффициент избытка воздуха в большинстве случаев больше единицы и колеблется в широких пределах.
Температура горения
Выделяющееся в зоне горения тепло воспринимается продуктами сгорания, вследствие чего они нагреваются до высокой температуры. Та температура, до которой в процессе горения нагреваются продукты сгорания, называется температурой горения. Различают калориметрическую, теоретическую и действительную температуры горения. Действительная температура горения для условий пожара называется температурой пожара.
Под калориметрической температурой горения понимают ту температуру, до которой нагреваются продукты полного сгорания при следующих условиях:
1) все выделяющееся при горении тепло расходуется на нагревание продуктов сгорания (потери тепла равны нулю);
2) начальная температура воздуха и горючего вещества равна 0 °С;
3) количество воздуха равно теоретически необходимому ( 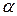
4) происходит полное сгорание.
Калориметрическая температура горения зависит только от состава горючего вещества и не зависит от его количества.
Теоретическая температура, в отличие от калориметрической, характеризует горение с учетом эндотермического процесса диссоциации продуктов сгорания при высокой температуре:
2СОз → 2СО + О2 — 570,2 кДж
Практически диссоциацию продуктов сгорания необходимо учитывать только при температурах выше 1700 °С. При диффузионном горении веществ в условиях пожара действительные температуры горения не достигают таких значений, поэтому для оценки условий пожара используют только калориметрическую температуру горения и температуру пожара. Различают температуру внутреннего и наружного пожара.
В действительности не вся теплота, выделяющаяся при горении в условиях пожара, расходуется на нагревание продуктов сгорания. Большая часть ее расходуется на нагревание конструкций, подготовку горючих веществ к горению, нагревание избыточного воздуха и др. В связи с этим температура внутреннего пожара значительно ниже калориметрической. Так, через 10 мин после
развития внутреннего пожара температура пожара составляет примерно от 0,1 до 0,2 части калориметрической температуры, через 20 мин от 0,2 до 0,3, через 30 мин от 0,3 до 0,35, через 40 мин от 0,35 до 0,4. Пользуясь этими данными, можно по калориметрической температуре находить температуру внутреннего пожара.
На рисунке 1.2 показано изменение температуры внутреннего пожара (температурный режим пожара) при горении различных твердых материалов. Как показывает ход кривых, температура пожара при горении всех веществ первоначально растет, достигая максимума, а затем по мере выгорания материала постепенно понижается.
Диффузионное пламя
Пространство, где сгорают пары и газы, называется пламенем или факелом. Пламя может быть кинетическим или диффузионным в зависимости от того, горит ли заранее подготовленная смесь паров или газов с воздухом или такая смесь образуется непосредственно в пламени в процессе горения. В условиях пожара газы, жидкости и твердые вещества горят диффузионным пламенем.
Структура диффузионного пламени существенно зависит от сечения потока горючих паров и газов и его скорости. По характеру потока различают ламинарное и турбулентное диффузионное пламя. Ламинарное пламя возникает при малых сечениях потока паров или газов, движущихся с небольшой скоростью (пламя свечи, спички, газа в горелке небольшого диаметра и т. д.). На пожарах при горении всех веществ образуется турбулентное пламя. Оно меньше изучено, и для объяснения этого явления используют положения теории ламинарного пламени. На рисунке 1.3 показано строение ламинарного диффузионного пламени на примере пламени жидкости, горящей в сосуде небольшого диаметра. Пламя состоит из зоны горения и зоны паров, последняя занимает почти весь объем пламени.
| Воздух |
| Воздух |
Подобное по строению пламя образуется также при горении газов и твердых веществ, если скорость движения газов и паров находится в ламинарном режиме. Зона горения в диффузионном пламени представляет очень тонкий слой, в котором протекает реакция горения. Превращение веществ и выделение тепла в этом слое вызывает возникновение молекулярной диффузии в прилегающих к нему слоях воздуха и горючего. Причиной молекулярной диффузии является разность парциальных давлений и температур газов, участвующих в горении.
 |
Температура зоны горения пламени меняется по его высоте. Объясняется это изменением состава стехиометрической смеси в зоне горения и затратой тепла на нагрев поступающего в нее воздуха. В нижней части пламени, хотя и образуется стехиометрическая смесь с наибольшей теплотой горения, однако, температура горения не является здесь максимальной, так как значительное количество тепла затрачивается на нагрев холодного воздуха. В средней части пламени теплота горения стехиометрической смеси меньше, чем в нижней, за счет диффузии в нее продуктов сгорания, однако, поступающий в зону горения нагретый воздух компенсирует потери тепла, и температура горения в этой части пламени является максимальной. В верхней части диффузионного пламени стехиометрическая смесь имеет еще меньшую теплоту горения, и нагретый воздух, поступающий для ее образования, не может компенсировать всех потерь тепла, поэтому температура горения здесь минимальная. В связи с этим в верхней части пламени часто образуется сажа.
Турбулентное пламя отличается от ламинарного тем, что не имеет четких очертаний и постоянного положения фронта пламени. Температура его при горении нефтепродуктов составляет: бензина 1200 °С, керосина 1100 °С, нефти 1100 °С, мазута 1000 °С. При горении древесины в штабелях температура турбулентного пламени достигает от 1200 до 1300 °С.
Горение может осуществляться в двух режимах:
— самовоспламенения, заключающемся в самопроизвольном возникновении пламенного горения предварительно нагретой до некоторой критической температуры горючей смеси (называемой температурой самовоспламенения) и проявляющегося в одновременном (в виде вспышки) сгорании всей горючей смеси;
— режиме распространения волны горения (распространения фронта пламени) по холодной смеси при ее локальном зажигании (воспламенении) внешним источником.
Для получения представлений о распространении волны горения поместим гомогенную горючую смесь в стеклянную трубку, открытую с одного конца, и воспламеним ее внешним источником у открытого конца.
Если же закрыть свободный конец трубки, то горячие продукты сгорания будут, как поршень, давить на пламя и увеличивать скорость его перемещения. Суммарная скорость такого перемещения фронта пламени называется видимой скоростью пламени 

где 

Степень расширения продуктов сгорания 

где 
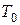


В случае диффузионного горения, пламя как бы стоит на месте, а в него втекают с одной стороны горючие пары, с другой стороны – воздух. Наиболее характерным примером диффузионного пламени является горящая свеча.
Тепловая теория пламени, разработанная Я.Б.Зельдовичем, исходит из подобия полей концентраций и температур во фронте пламени.
Многочисленные опытные данные свидетельствуют, что скорость пламени углеводородо-воздушных смесей с давлением уменьшается по закону:

где 
Анализируя это выражение, можно видеть, что порядок реакции при горении таких смесей имеет дробную величину. Это свидетельствует о сложном немолекулярном механизме химических превращений в пламени.