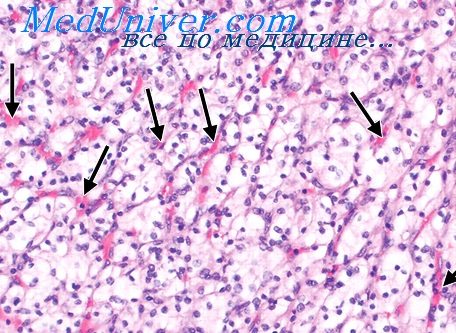
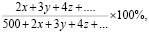Что понимают под агрегацией эритроцитов
Что понимают под агрегацией эритроцитов
При гиперемии эритроциты в расширенных сосудистых терминалях располагаются изолированно друг от друга, будучи разделенными плазмой. При этом обособленность эритроцитов определяется как на светооптическом, так и на электронно-микроскопическом уровнях. При сладжировании крови происходит слипание эритроцитов и образование в микрососудах клеточных агрегатов, разделенных плазмой; в подобных случаях плазма обнаруживается также между агрегатами и эндотелиальной выстилкой соответствующих сосудистых терминалеи.
Процесс агрегации эритроцитов не сопровождается разрушением их оболочки, что подтверждается электронной микроскопией. При стазе крови наблюдается склеивание эритроцитов и частичный их гемолиз. Это приводит к разрушению оболочки клеток и исчезновению границ между ними. Плазмы в таких микрососудах мало, что дает основание говорить о переходе крови при стазе в «плотное» состояние.
А.М.Чернух, П.Н.Александров, О.В.Алексеев (1984) на основании собственных экспериментальных исследований пришли к заключению, что сладж может быть вызван различными воздействиями: внутривенным введением высокомолекулярных веществ (декстрана, денатурированного белка, метилцеллюлозы, бактериальных токсинов, серотонина, норадреналина, брадикинина), перевязкой сосудов, перегреванием и охлаждением животных, массивной кровопотерей и многими другими факторами.
При этом внутрисосудистые гемореологические изменения при всех названных воздействиях характеризуются однотипностью внешних проявлений: агрегацией эритроцитов, сепарацией плазмы (отделением ее от форменных элементов), более или менее быстрым увеличением размеров агрегатов, их осаждением и замедлением кровотока вплоть до полной остановки его в отдельных микрососудах.
При образовании крупных клеточных агрегатов в артериолах в прекапилляры и капилляры поступает кровь с выраженным дефицитом эритроцитов или преимущественно плазма, в связи с чем в тканях уменьшается число обменных микрососудов, содержащих цельную кровь (Г.И.Мчедлишвили, 1989). Агрегация эритроцитов в венулах приводит к замедлению оттока венозной крови из модулей микроциркуляции и депонированию ее в тканях, также отрицательно сказывающихся на циркуляции крови в капиллярах. Кровоток в сосудистых терминалях при сладже может быть либо зернистым (гранулярным), либо прерывистым.
Механизмы агрегации эритроцитов до сих пор во многом остаются неясными. А.М.Чернух, П.Н.Александров, О.В.Алексеев (1984), Dintenfass (1971) полагают, что в возникновении данного феномена важная роль принадлежит сдвигам в белковых фракциях крови, сопровождающимся увеличением содержания в плазме высокомолекулярных белков (глобулинов, фибриногена).
Есть основание считать, что формированию агрегатов предшествуют процессы адсорбции белковых макромолекул на поверхности эритроцитов, что снижает их заряд и способствует сближению и слипанию. Известно, что сохранение суспензионной стабильности крови зависит от величины отрицательного заряда поверхности эритроцитов, препятствующего в физиологических условиях их сближению и агрегации.
Соединение положительно заряженных белковых преципитатов с отрицательно заряженной поверхностью эритроцитов приводит к снижению заряда последних и нарушению реологических свойств крови, проявляющемуся ее сладжированием.
Что понимают под агрегацией эритроцитов
Являясь основной частью клеточной популяции крови млекопитающих, эритроциты и тромбоциты в значительной степени определяют ее реологические свойства [4]. Весьма велика в этом плане роль их агрегации и поверхностной геометрии, и в этой связи остаются весьма востребованными методические подходы к изучению микрореологических эритроцитов и тромбоцитов у людей и животных, что позволит своевременно и адекватно проводить у них их оценку и при необходимости контролируемую, предотвращая дисциркуляторные нарушения в жизненно важных органах [3, 5].
Не вызывает сомнений, что микрореологические дисфункции эритроцитов и тромбоцитов являются также и важным патогенетическим фактором развития многих заболеваний. В условиях патологии ухудшение их реологических свойств может стать первоосновой нарушения функций внутренних органов, что во многом способно определить тяжесть состояния человека или животного и дальнейший прогноз. Все это подчеркивает диагностическую ценность лабораторной оценки агрегации и цитоархитектоники эритроцитов и тромбоцитов.
Имеющие место в кровотоке межэритроцитарные поверхностные взаимодействия определяются пространственной плотностью и качественным составом мембраны (фосфатные, аминные, карбоксильные и др. химические группы) [8]. Понижение плотности поверхностного отрицательного заряда эритроцитов приводит к дестабилизации их суспензии, возможно, за счет сорбции на поверхности мембраны эритроцита макромолекул (чаще всего фибриноген) [10].
Наблюдаемая физиологическая агрегация эритроцитов имеет характер линейных цепочек в виде монетных столбиков, состоящих из 5–6 клеток, с возможностью полной гидродинамической дезагрегации эритроцитов в сосудистом русле. При очень низких скоростях сдвига эритроциты даже в норме почти полностью объединены в монетные столбики. При повышении скорости сдвига монетные столбики полностью разрушаются и кровь течет по сосудам, состоя из отдельных клеток [11].
Наиболее важным признаком патологической агрегации эритроцитов является глыбчатая их агрегация с увеличением прочности сцепления между эритроцитами, сохраняющаяся даже при 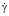
Изменения формы эритроцитов от дискоидной до сферической приводит к невозможности свободной упаковки эритроцитов, что ведет к увеличению площади соприкосновения (следовательно, к патологической агрегации). При этом, эхиноцитарная трансформация существенно увеличивает прочность агрегатов.
Колебания соотношения альбумина и фибриногена в плазме является дополнительным показателем суспензионной стабильности крови. Альбумин – наиболее эффективный дезагрегант и естественный антагонист фибриногена [1, 10]. При уменьшении соотношения между концентрацией альбумина и крупномолекулярными белками (глобулины, фибриногеном и продуктами деградации фибрина) ослабляет суспензионную стабильность крови.
Для оценки агрегации эритроцитов кровь из вены забирают в утренние часы после 14-часового голодания из вены через толстую иглу самотеком в пробирку с цитратом натрия в соотношении 9:1 и центрифугируют 10 мин. при 3 000 об./мин. В 96 луночной планшетке заполняют 2 лунки 0,2 мл плазмы обследуемого. Из пробирки удаляется вся плазма и слой лейкоцитов. Эритроциты ресуспепдируются стандартным фосфатным буфером в соотношении 1:4 с последующим центрифугированием в течение 10 мин. при 3 000 об./мин., что позволяет отмыть их от остатков плазмы при удалении надосадочной жидкости. После этого берется 0,02 мл эритроцитов и ресуспендируется в первой заполненной аутологичной плазмой лунке 96 луночной планшетки, что позволяет получить 10 % гематокрит. Затем из этой лунки забирают чистой сухой пипеткой 0,02 мл содержимого и помещают во вторую заполненную лунку, что позволяет получить 1 % гематокрит. После этого 1 сетку в камере Горяева заполняют полученной суспензией эритроцитов, выдерживают 3 мин. для возникновения спонтанной агрегации и проводят подсчет свободных эритроцитов (в т.ч. 2 эритроцита вместе) и агрегатов, начиная с 3 эритроцитов, соединенных в виде «монетных столбиков») в 2-х больших квадратах камеры (объектив х 40, окуляр х 10). Считаются количество «монетных столбиков» и количество эритроцитов, вовлеченных в них.
Агрегационную активность эритроцитов можно регистрировать с помощью светового микроскопа путем подсчета в камере Горяева количества агрегатов эритроцитов, агрегированных и неагрегированных эритроцитов во взвеси отмытых эритроцитов в плазме крови с вычислением среднего размера агрегата (СРА) [5]:
где СЭА – сумма всех эритроцитов в агрегате;
КА – количество агрегатов.
Показатель агрегации (ПА) рассчитывается по следующей формуле:
ПА = (СРА х КА + КСЭ) / (КА + КСЭ),
где КСЭ – количество свободных эритроцитов.
Процент неагрегированных эритроцитов (ПНА) определяется:
ПНА = (КСЭ х 100) / (СРА х КА + КСЭ).
Оценка цитоархитектоники эритроцитов ведется с применением световой фазовоконтрастной микроскопии. Для исследования поверхностной геометрии эритроцитов кровь фиксируется в 1 % растворе глутарового альдегида («Fluka», Switzerland) на среде 199 (рН 7,4) при температуре 4 ºС в течение одних суток, после чего готовится препарат «раздавленная капля». Подсчет клеток производится в процентах на 200 эритроцитов. Регистрируемые эритроциты типируются согласно классификации, предложенной Г.И. Козинцем с соавт. [2], подразделяющей эритроциты на десять классов: дискоциты; дискоциты с одним выростом; дискоциты с гребнем; дискоциты с множественными выростами; эритроциты в виде тутовой ягоды; куполообразные эритроциты (стоматоциты); сфероциты с гладкой поверхностью; сфероциты с шипиками на поверхности; эритроциты в виде «спущенного мяча»; дегенеративные формы эритроцитов.
Первые пять классов эритроцитов (дискоциты, в т.ч. с признаками эхиноцитарной трансформации) считаются обратимо деформированными в виду их способности спонтанно восстанавливать форму. Остальные классы эритроцитов относят к группе необратимо деформированных или предгемолитических форм.
Современная оценка микрореологических свойств крови немыслима без определения агрегации тромбоцитов, осуществляющейся визуальным способом [7], хорошо показавшим себя на практике [6]. С этой целью кровь забирают с цитратом натрия 3,8 % в соотношении 9:1, центрифугируют 5 мин. при 1000 об/мин. для получения богатой тромбоцитами плазмы (БТП). Часть плазмы отбирают, а оставшуюся центрифугируют при 3000 об/мин. в течение 20 мин., получают бедную тромбоцитами плазму (БеТП). БТП стандартизируют по числу тромбоцитов (до 200·109/л.).
Из получившегося объема стандартизированной плазмы отбирают из расчета по 0,02 мл плазмы на каждый исследуемый индуктор и их комбинацию. Оставшийся объем плазмы можно использовать для других гематологических и биохимических исследований. Из отобранного объема стандартизированной плазмы на предметное стекло наносят 0,02 мл плазмы и разными пипетками по 0,02 мл раствора индуктора. В качестве агонистов возможно применение, в т.ч. АДФ (0,5×10-4 М), коллагена (разведение 1:2 основной суспензии), тромбина (0,125 ед/мл), адреналина (5,0×10-6 М), ристомицина (0,8 мг/мл), перекиси водорода (7,3×10-3 м). Стеклянной палочкой смешивают плазму с индукторами и включают секундомер. Смесь перемешивают так, чтобы жидкость занимала окружность диаметром около 2 см. Покачивая стекло круговыми движениями в проходящем свете осветителя, на черном фоне следят через лупу за возникновением агрегатов. При появлении отчетливых агрегатов, просветлении раствора и прилипании части агрегатов к стеклу секундомер отключают и фиксируют время агрегации тромбоцитов. Реакцию повторяют 2–3 раза с каждым индуктором и находят среднее арифметическое из полученных результатов.
Оптимальными значениями агрегации тромбоцитов при концентрации тромбоцитов 200·109/л составляет для АДФ – 37–50 с, коллаген – 27–36 с, ристомицин – 38–50 с, тромбин – 48–59 с, адреналин – 81–106 с, перекись водорода – 40–60 с.
Регистрация внутрисосудистой активности тромбоцитов возможна по методу [9], когда из локтевой вены берут 2 мл в силиконированную центрифужную пробирку с 8 мл раствора 0,125 % глутаральдегида и сразу центрифугируют 6 мин при 1000 об/мин. Супернатант разводят раствором глутаральдегида в четыре раза (0,1 мл + 0,3 мл раствора), перемешивают пипеткой 5 раз и заполняют камеру Горяева, которую помещают на 20 мин. в увлажненную чашку Петри.
При помощи фазовоконтрастного микроскопа определяют процентное распределение описанных выше форм тромбоцитов на 200 клеток. Первым видимым проявлением активации кровяных пластинок является изменение их формы, которое может служить для адекватной оценки этого процесса как индуцируемого in vitro, так и развивающегося в организме. В сосудистом русле при отсутствии патологических активирующих влияний подавляющее большинство интактных тромбоцитов, называемых дискоцитами, имеет характерную дискоидную форму или форму чечевицы и практически гладкую поверхность. Интактное состояние тромбоцитов, сопряженное с формой дискоцита, – один из важнейших факторов, препятствующих неоправданному развитию внутрисосудистого тромбоза. Механизмы его обеспечения достаточно сложны. Это отчасти связано с тем, что интактное состояние этих клеток сочетается с потенциальной возможностью быстрых и специфичных преобразований при появлении в кровотоке активирующих стимулов. Характерное изменение формы при индуцировании гемостатических реакций кровяных пластинок отражает определенные процессы их внутренней ультраструктурной и биохимической перестройки [12]. При этом развивается типичная последовательность изменений: от формы интактного тромбоцита – дискоцита к активированным клеткам – дискоэхиноциту, т.е. дискоциту, у которого на поверхности появляются отростки, и далее к сфероциту или сфероэхиноциту. У последнего не только форма становится все более сферичной, но и возрастает число отростков.
Оценка степени агрегации осуществляется также по относительному числу всех тромбоцитов, вовлеченных в агрегационную реакцию. Последнее может быть выявлено по процентному отношению числа агрегировавших тромбоцитов к общему их числу в препарате (т.е. к сумме свободно лежащих клеток и вовлеченных в агрегацию) по формуле:
где x, y, z и т.д. – число агрегатов соответствующего размера на 500 свободных тромбоцитов.
Оценка состояния основных микрореологических свойств эритроцитов и тромбоцитов не требует дорогостоящего оборудования, дает полную информацию об их динамике. При применении данных морфофункциональных методов установлено, что и у здорового человека и животных в циркулирующей крови лишь у небольшой части эритроцитов и тромбоцитов изменена форма. Однако в патологических условиях изменения этих показателей могут быть намного более выражены вследствие внутрисосудистой альтерации эритроцитов и кровяных пластинок. Это обуславливает то, что при патологических состояниях микроциркуляция может значительно ухудшаться, т.к. появляется значительное количество эритроцитов и тромбоцитов с измененной формой и их внутрисосудистых агрегатов.
Таким образом, оценка агрегации и цитоархитектоники – это важный элемент диагностики состояния животных и человека, позволяющий при необходимости своевременно определять сроки начала корректирующего вмешательства.
Рецензенты:
Громнацкий Н.И., д.м.н., профессор, профессор кафедры терапии № 2 Курского государственного медицинского университета, г. Курск;
Жукова Л.А., д.м.н., профессор, заведующий кафедрой эндокринологии и диабетологии Курского государственного медицинского университета, г. Курск.
Агрегация эритроцитов
Многим людям, не имеющим медицинского образования, может показаться, что агрегация эритроцитов — это название какого-нибудь лабораторного анализа. На самом деле, это такое состояние, в борьбе с которым медицина находится долгие годы.
Вспомним всем известный аспирин. Он принимается не только как жаропонижающее средство. Аспирин является дезагрегантом, то есть препятствует агрегации, правда, тромбоцитов, но ведь кровь является единой системой.
Существует целая группа препаратов, которые называют дезагреганты (антиагреганты). И все они служат для того, чтоб не произошло этого феномена агрегации разных клеток крови. Всем известен так называемый особенный, «сердечный» аспирин. Его задача, говоря простыми словами, «разжижать» кровь.
Конечно, он вовсе не разряжает кровь, а препятствует агрегации. Агрегация — это склеивание эритроцитов, тромбоцитов и любых форменных элементов.
Агрегация и агглютинация, в чем разница?
С точки зрения физики, агрегация является соединением различных частиц, на которые влияют силы притяжения, и различные межмолекулярные силы. Результатом агрегации является постепенное укрупнение частиц. Если же речь идет о расщепление крупной частицы на отдельные мелкие фрагменты, то речь идет о дезагрегации.
Говоря простым языком, агрегация — это слипание. В результате агрегации частиц они постепенно становятся такими тяжелыми, что просто не способны находиться во взвешенном состоянии, и начинают постепенно оседать. Этот процесс называется седиментацией.
Что касается агглютинации, то существует разница между ней и между агрегацией. При агглютинации склеиваются и также выпадают в осадок самые разные образования, например, клетки крови, клетки тканей, бактерии, различные неживые химические частицы, на которых находятся различные активные молекулы.
Разница состоит в том, что в результате реакцию агглютинации вызывают антитела, и эти антитела называются агглютининами. Реакция агглютинации как раз и является важным лабораторным анализом, который позволяет идентифицировать различные антитела. Их можно обнаружить в крови, в различных тканях, в жидкостях организма, и реакция агглютинации часто используется в диагностике инфекционных болезней, и иммунных расстройств. Классическим примером реакции агглютинации является реакция Видаля, которая используется для диагностики брюшного тифа.
Как видно, обе реакции протекают в человеческом организме, но агрегация эритроцитов является универсальным процессом, которая рано или поздно приводит к тромбообразованию, к инфарктам, к инсультам, и вызывает сосудистые катастрофы.
Поэтому именно агрегация эритроцитов — это такое состояние, с которым нужно бороться, поскольку в конечном итоге именно этот процесс запускает длительный механизм, ведущей к ранней смерти и инвалидизации. Рассмотрим подробнее феномен агрегации эритроцитов, и факторов, способствующих агрегации эритроцитов.
Как происходит агрегация эритроцитов?
Самую простую агрегацию эритроцитов можно видеть под обычным микроскопом, когда на предметном стекле находится маленькая капля крови. В ней постепенно образуются склеенные столбики, «пачки» эритроцитов, которые называются монетными столбиками.
Плотность этих столбиков постепенно возрастает, и затем уже не видно, что они склеены из отдельных эритроцитов. Они представляют цельный конгломерат. Этот феномен в лаборатории называется гомогенизацией.
К счастью, этот процесс вполне обратим, и в организме эритроцитарные сладжи (такое название есть у подобных структур) могут распадаться на отдельные клетки.
Важное клиническое значение агрегации эритроцитов в том, что эти сгустки из отдельных клеток нарушают капиллярный кровоток, поскольку они ухудшают текучесть крови, или ее реологические свойства. В крупных сосудах, таких как аорта, подключичная артерия, крупные сосуды печени агрегация эритроцитов незаметна.
Но в мелких капиллярах ее игнорировать уже нельзя. Этот феномен может развиться быстро и сильно, сразу во всем организме, что наблюдается при некоторых заболеваниях.
В том случае, если агрегация эритроцитов происходит по причине какого-либо токсина, острой инфекции, например, при малярии, при крупозной пневмонии, при различных шоках, то во всём организме возникает серьезное препятствие для микроциркуляции. Кровь очень плохо поступает из мелких артерий в капиллярную систему.
Кроме этого агрегация, если она произошла внутри мелких капилляров, очень плохо воздействует на газообмен в тканях. Существует наука патофизиология, которая изучает типичные патофизиологические процессы, повреждающие различные структуры организма. С точки зрения этой науки, пределом вредности является полная остановка капиллярного кровотока, или стаз.
В результате возникает выраженный метаболический и тканевой ацидоз, или происходит повышение кислотности крови. Это состояние требует лечения, Но в данном случае применяется вовсе не сердечный аспирин, а специфическая терапия, направленная на выведение токсинов из организма человека, интенсивная терапия, направленная на восстановление капиллярного кровотока и микроциркуляторной функции. Наиболее частыми причинами агрегации эритроцитов являются:
На этот фактор в значительной степени влияет концентрация эритроцитов. Понятно, что если у пациента возникло обезвоживание, то эритроциты находятся близко друг к другу, и их агрегация произойдёт наверняка,
Этот фактор определяет состояние плазмы крови и нахождение в ней различных веществ, которые помогают эритроцитам сблизиться или оттолкнуться. Именно плазменным фактором дезагрегации будет являться прием аспирина. Его молекулы, находясь в плазме крови, препятствуют сближению эритроцитов их слипанию.
Наконец, третий фактор является электростатическим. Это не что иное, как обычные силы кулоновского притяжения разноименных зарядов. Этот фактор также помогает эритроцитам слипнуться в комочки, и они становятся склеены.
Об аспирине
Надо открыть секрет. Применение аспирина, других препаратов, которые относят к антиагрегантам, таких как клопидогрель, тиклопидин, дипиридамол начинают влиять вовсе не на эритроциты, а на тромбоциты. Классическим механизмом обладает аспирин: он сначала замедляет действие, а потом разрушает фермент циклооксигеназу, который является ферментом воспаления.
В результате в тромбоцитах прекращается образование такого соединения, которое называется тромбоксаном. А этот тромбоксан как раз и способствует слипанию тромбоцитов, и суживает сосуды.
Применение аспирина предотвращает образование тромбоцитарных комочков, но нужно помнить, что любое вмешательство в нормальную текучесть крови тут же отражается и на наиболее часто встречающихся клетках — на эритроцитах. В этом и состоит лечебное влияние дезагрегантов. А что касается лечения собственно агрегации эритроцитов – это инфузии различных кристаллоидных и коллоидных растворов, и препаратов, усиливающих микроциркуляцию.
Современные возможности лабораторных исследований реологических свойств крови
Понимание состояний реологических свойств крови является важным компонентом оценки микроциркуляции пациента и является непростой задачей для врача, даже в современных условиях. Действительно, особенности реологического поведения крови человека обуславливают состояния его обмена на уровне микроциркуляции. Одним из наиболее важных и широко применяемых методов оценки является измерение вязкости цельной крови методом ротационной вискозиметрии, позволяющей получить кривую вязкости крови применительно практически ко всем участкам сосудистого русла. Наиболее широко для этих целей применяются ротационные вискозиметры, создающие скорости сдвига в диапазонах от менее 1 обратной секунды до тысяч обратных секунд, перекрывая таким образом, весь профиль скоростей движения крови в сосудистом русле.
В настоящее время для исследований крови человека наибольшее распространение получили зарубежные ротационные вискозиметры таких фирм, например, как “Contraves” (Швейцария). Эти приборы представляют собой классические ротационные вискозиметры с различными измерительными системами, такими как цилиндр-цилиндр, пластина-пластина, конус-пластина и др. Приборы этих фирм отличает высокая технология, позволяющая измерять вязкостные характеристики маленького объема образца крови в очень широком диапазоне скоростей сдвига. Имеющиеся дополнительные возможности позволяют оценить и вязко-пластические свойства биологических образцов, например, таких как синовиальная жидкость.
Однако высокие пользовательские характеристики этих приборов сопровождаются весьма высокой стоимостью (40-50 тысяч долларов США), что практически делает их недоступными для использования в нашей стране.
Ротационные вискозиметры отечественного производства до недавнего времени были представлены ротационным вискозиметром АКР-2. Однако в настоящее время его прозводство прекращено.
Несмотря на высокую клиническую востребованность исследований вязкости крови, необходимо отметить, что показатель вязкости цельной крови, представляет собой интегральную величину, определяемую:
· концентрацией эритроцитов (гематокритом);
Последние два обстоятельства являются основными, определяющими так называемое «неньютоновское» поведение крови в потоке, характеризуемое ее различной вязкостью при разных скоростях кровотока (Рис. 1).

Понятно, что наибольший клинический интерес могут представлять эти два показателя реологического поведения крови: агрегация и деформируемость эритроцитов.
Агрегация эритроцитов (АЭ)
В настоящее время в соответствии с рядом рекомендаций (1, 2) предлагается несколько методов исследования агрегации эритроцитов: измерение скорости седиментации эритроцитов (СОЭ), измерение светопропускания или светоотражения суспензии эритроцитов до и после ее интенсивного перемешивания (силлектометрия), микроскопическая оценка агрегатов эритроцитов, метод определения коэффициента отношений вязкости крови при низкой и высокой скорости сдвига, ультразвуковая оценка агрегации эритроцитов.
Все эти методики имеют ту или иную степень распространения и эффективности. В настоящее время большинство исследователей оценивает метод силлектометрии как наиболее адекватный метод оценки агрегации эритроцитов (АЭ).
Одним из наиболее современных приборов, позволящих оценить АЭ методом силлектометрии, является анализатор Rheoscan A производства фирмы Rheomeditech (Ю. Корея) (Рис. 2).

Данный прибор позволяет использовать 8 мкл стабилизированной цельной крови и в течении 10 сек рассчитывает основные показатели АЭ: максимальную агрегацию (МА) и время достижения 50% максимальной агрегации Тмакс (Рис. 3).

Наряду с подобным методом исследования АЭ, в приборе Rheoscan AND 300 реализован оригинальный метод исследования АЭ, основанный на измерении минимального напряжения сдвига, необходимого для дезагрегации эритроцитов и достижения диспергированного состояния пробы крови, т. е. предельного напряжения сдвига (Рис. 4). Важной особенностью данного показателя является его независимость от концентрации клеток в пробе крови.

Ряд исследований последних лет показывает хорошую эффективность оценки АЭ с использованием приборов Rheoscan A при септических состояниях, диабете и его осложнениях, коронарном синдроме и пр. (3, 4, 5, 6).
Деформируемость эритроцитов (ДЭ)
Исследованиями, проведенными в последние десятилетия, показано, что важнейшим свойством эритроцитов, обусловливающим их способность выполнять транспортные функции в системе сосудов микроциркуляции, является их деформируемость (7, 8). Она зависит от функциональной геометрии клетки, ее мембранной вязкоэластичности и цитоплазматической вязкости (9).
Вместе с тем, вязкость внутреннего содержимого эритроцитов вносит существенный вклад в деформируемость клетки только при высоких концентрациях гемоглобина, > 50 г/дл, тогда как при его нормальных концентрациях деформация эритроцитов в основном связана с эластичностью мембраны клетки (10).
Одним из наиболее ранних методов оценки ДЭ является метод фильтрации, основанный на измерении времени фильтрации образца крови через калиброванный поликарбонатный фильтр с размерами пор 3-5 мкм (11). Метод микропипеточной аспирации основан на оценке отрицательного давления, необходимого для всасывания в микропипетку части или всего эритроцита (11).
Значительное распространение в настоящее время получил метод лазерной эллипсометрии или эктацитометрии. Данный метод предполагает математическую оценку дифракционного изображения эритроцита при воздействии на него высоких скоростей сдвига в измерительной камере ротационного вискозиметра или при прохождении пробы крови через калиброванный капилляр (Рис. 5). Основным показателем данного исследования является так называемый «индекс эластичности», рассчитываемый прибором на основании изменения геометрических размеров изображения эритроцита.

Измерения ДЭ с использованием Rheоscan AND 300 производится в специальном одноразовом картридже. Для исследования в автоматическом режиме необходимо 3 мкл кровии и 5 с времени, что позволяет говорить о приборе как о РОС анализаторе. В настоящее время с использованием этого прибора проведены исследования больных гематологическими заболеваниями, диабетом, онкологическими заболеваниями, диабетической офтальмо и нефропатиями и пр.
Линейку приборов для исследования микрореологических свойств крови производства фирмы Rheomeditech (Ю. Корея) на рынке России представляет ООО «ТПО МедиоЛаб».
А. Б. Косырев,
кандидат медицинских наук, доцент кафедры биохимии РМАПО М3 РФ
Литература:
1. R. M. Bauersachs, R. B. Wenby and H. J. Meiselman, Determination of specific red blood cell aggregation indices via an automatedsystem, Clin. Hemorheol. 9 (1989), 1-25.
2. G. Barshtein, D. Wajnblum and S. Yedgar, Kinetics of linear rouleaux formation studied by visual monitoring of red cell dynamic organization, Biophys. J. 78 (2000), 2470-2474.
3. Sakr Y, Dubois MJ, De Backer D, et al: Persistentmicrocirculatory alterations are associated with organ failure and death in patientswith septic shock. Crit Care Med 2004;32:1825-1831
4. A. Vaya, J. Iborra, C. Falco, I. Moreno, P. Bolufer, F. Ferrando, M.L. Perez and A. Justo, Rheological behaviour of red blood cells in beta and deltabeta thalassemia trait., Clin. Hemorheol. Microcirc. 28 (2003), 71-78.
5. Le Devehat C, Boisseau M, Vimeux M, et al. Hemorheologicalfactors in the pathophysiology of venous diseases. ClinHemorheol9: 861-870, 1989.
6. Kesmarky G, Toth K, Habon L, et al. Hemo- rheological parametersin coronary artery disease. ClinHemorheolMicrocirc 18: 245-251, 1998.
8. Chierego M, Verdant C, De Backer D: Microcirculatory alterations in critically ill patients. Minerva Anestesiol 2006; 72:199-205.
11. O. K. Baskurt et al. New guidelines for hemo- rheological laboratory techniques.
Косырев А.Б., ООО «ТПО» Медио Лаб» / Современная лабораторная диагностика // Отраслевые справочники, №1 (24) ’18.