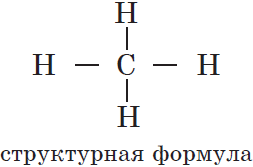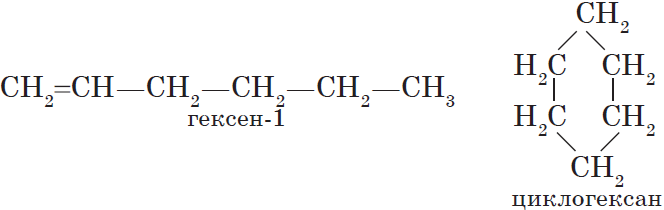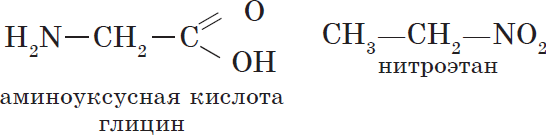Что понимают под химическим строением
Теория строения органических соединений. Типы связей в молекулах органических веществ
Теория к заданию 12 из ЕГЭ по химии
Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Теория химического строения органических соединений А. М. Бутлерова
Подобно тому, как для неорганической химии основой развития являются Периодический закон и Периодическая система химических элементов Д. И. Менделеева, для органической химии основополагающей стала теория строения органических соединений А. М. Бутлерова.
Основным постулатом теории Бутлерова является положение о химическом строении вещества, под которым понимается порядок, последовательность взаимного соединения атомов в молекулы, т.е. химическая связь.
Под химическим строением понимают порядок соединения атомов химических элементов в молекуле согласно их валентности.
Основные положения теории А. М. Бутлерова
Теория строения органических соединений является динамичным и развивающимся учением. По мере развития знаний о природе химической связи, о влиянии электронного строения молекул органических веществ стали пользоваться, кроме эмпирических и структурных, электронными формулами. В таких формулах указывают направление смещения электронных пар в молекуле.
Квантовая химия и химия строения органических соединений подтвердили учение о пространственном направлении химических связей (цис- и трансизомерия), изучили энергетические характеристики взаимных переходов у изомеров, позволили судить о взаимном влиянии атомов в молекулах различных веществ, создали предпосылки для прогнозирования видов изомерии и направления и механизма протекания химических реакций.
Органические вещества имеют ряд особенностей:
Изомерия и гомология органических веществ
Свойства органических веществ зависят не только от их состава, но и от порядка соединения атомов в молекуле.
Изомерия — это явление существования разных веществ — изомеров с одинаковым качественным и количественным составом, т.е. с одинаковой молекулярной формулой.
Различают два вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связи атомов в молекуле; стереоизомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.
Выделяют следующие разновидности структурной изомерии: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию).
Структурная изомерия
Изомерия положения обусловлена различным положением кратной связи, заместителя, функциональной группы при одинаковом углеродном скелете молекулы:
Изомерами являются углеводород, относящийся к алкинам, — бутин-1 и углеводород с двумя двойными связями в цепи бутадиен-1,3:
Изомеры этого типа содержат различные функциональные группы и относятся к разным классам веществ. Поэтому они отличаются по физическим и химическим свойствам значительно больше, чем изомеры углеродного скелета или изомеры положения.
Пространственная изомерия
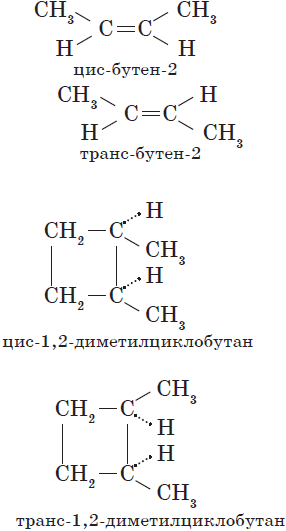
Пространственная изомерия подразделяется на два вида: геометрическую и оптическую. Геометрическая изомерия характерна для соединений, содержащих двойные связи, и циклических соединений. Так как свободное вращение атомов вокруг двойной связи или в цикле невозможно, заместители могут располагаться либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение). Обозначения цис- и транс- обычно относят к паре одинаковых заместителей:
Геометрические изомеры различаются по физическим и химическим свойствам.
Изучение оптической изомерии необходимо при рассмотрении многих реакций, протекающих в организме. Большинство этих реакций идет под действием ферментов — биологических катализаторов. Молекулы этих веществ должны подходить к молекулам соединений, на которые они действуют, как ключ к замку, следовательно, пространственное строение, взаимное расположение участков молекул и другие пространственные факторы имеют для течения этих реакций большое значение. Такие реакции называются стереоселективными.
Большинство природных соединений являются индивидуальными энантиомерами, и их биологическое действие резко отличается от свойств их оптических антиподов, полученных в лаборатории. Подобное различие в биологической активности имеет огромное значение, так как лежит в основе важнейшего свойства всех живых организмов — обмена веществ.
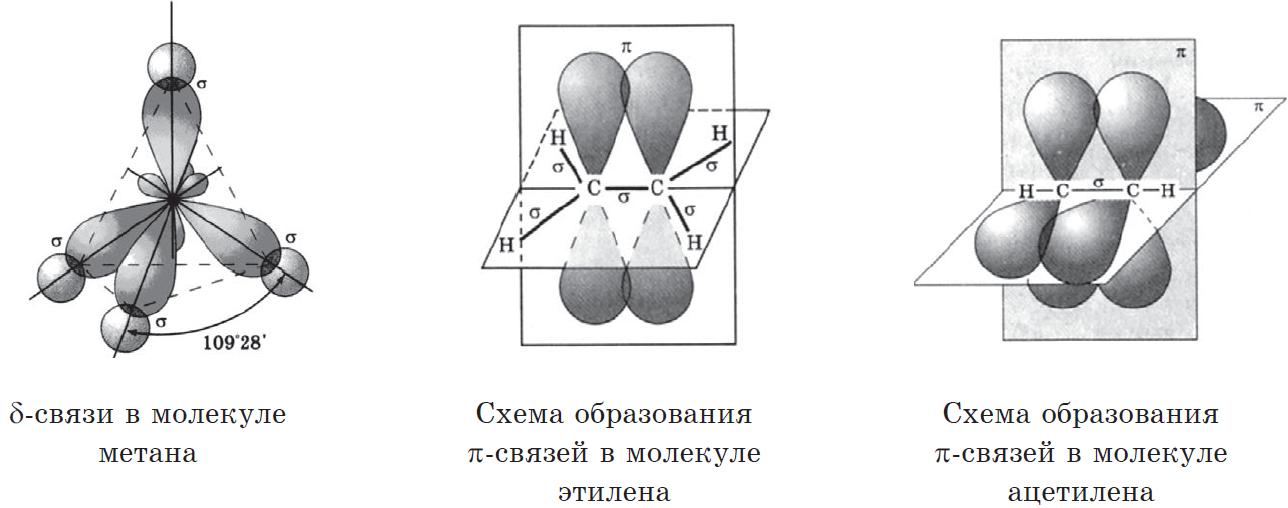
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ.
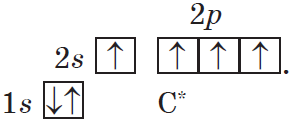
Такой атом имеет четыре неспаренных электрона и может принимать участие в образовании четырех ковалентных связей.
Характеристики одинарных и кратных связей между атомами С.
| Молекула | Тип гибридизации | Валентный угол | Длина связи, нм | Энергия связи, кДж/моль |
| $CH_3-CH_3$ | $sp^3$ | $109°5’$ | $0.154$ | $369$ |
| $CH_2=CH_2$ | $sp^2$ | $120°$ | $0.134$ | $712$ |
| $CH≡CH$ | $sp^3$ | $180°$ | $0.120$ | $962$ |
Радикал. Функциональная группа.
Одной из особенностей органических соединений является то, что в химических реакциях их молекулы обмениваются не отдельными атомами, а группами атомов. Если эта группа атомов состоит только из атомов углерода и водорода, то она называется углеводородным радикалом, если же она имеет атомы других элементов, то она называется функциональной группой. Так, например, метил ($СН_3$—) и этил ($С_2Н_5$—) являются углеводородными радикалами, а оксигруппа (—$ОН$), альдегидная группа (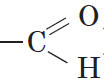
Как правило, функциональная группа определяет химические свойства органического соединения и поэтому является основой их классификации.
§ 2. Теория химического строения А.М. Бутлерова
Теория (от греч. theoria — «исследование») — это система обобщённых знаний, объясняющих те или иные стороны действительности. Ядро любой теории составляют её основные понятия и законы, а суть теории выражают её основные положения. Теория является важным инструментом научного познания, направлена на обобщение, систематизацию, объяснение и предсказание явлений. Изученная и усвоенная теория становится средством добывания новых знаний.

К концу 50-х гг. XIX в. органическая химия накопила массу фактов об органических веществах и их свойствах. Методом экспериментального анализа были определены качественный и количественный состав многих природных органических соединений и их молекулярные формулы. Но этот материал не был достаточно систематизирован. Ряд особенностей органических соединений (они рассмотрены в § 1) не находили объяснения на основе имеющихся в то время теоретических представлений, например явление изомерии, открытое ещё в 20-е гг. XIX столетия. Учёных смущало и то, что многие органические соединения имели несколько химических формул. Например, хорошо известной уксусной кислоте приписывали два десятка формул.
В науке насущными стали вопросы: являются ли молекулы органических веществ беспорядочным нагромождением атомов, или же они имеют упорядоченное строение, и можно ли его установить путём экспериментального исследования веществ?

Убеждённым сторонником познаваемости строения органических веществ был А.М. Бутлеров.
К 50-м гг. XIX в. острой стала задача выявления зависимости свойств веществ не только от состава, но и от их строения. Требовалась теория, способная обобщить и систематизировать накопленный материал, объяснить строение органических веществ. Её отсутствие заметно тормозило развитие науки.
Такую теорию в 60-е гг. создал известный русский химик Александр Михайлович Бутлеров, назвавший её теорией химического строения. Основную идею и положения своей теории А.М. Бутлеров сформулировал в 1861 г. в статье «О химическом строении вещества». Под химическим строением он понимал последовательность соединения атомов в молекулах.
При создании теории учёный опирался на известные к тому времени представления о четырёхвалентности атома углерода, способности его атомов соединяться между собой, образуя углеродные цепи, а также на уже разграниченные понятия «атом» и «молекула». А.М. Бутлеров отмечал, что чёткие представления о химической частице и определение понятий «атом» и «молекула» были самым существенным успехом химии, позволившим перейти к выявлению химического строения веществ.

В основу теории химического строения были положены фундаментальные понятия: «химические частицы (атомы, молекулы)», «валентность», «химическое строение», «изомерия».
Основные положения теории химического строения
1. Атомы в молекулах соединены в определённой последовательности химическими связями. Порядок связи атомов называется химическим строением. Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами.
2. Соединение атомов в молекулу происходит в соответствии с их валентностью. Валентность углерода в органических веществах равна IV.
3. Свойства веществ зависят не только от их качественного и количественного состава, но и от того, в каком порядке атомы в молекуле соединены, т. е. от химического строения их молекул.
4. Многие органические вещества способны к изомерии.
5. Порядок связи атомов (химическое строение молекул) можно изучать и устанавливать химическими методами.
6. Атомы или группы атомов в молекуле взаимно влияют друг на друга, что сказывается на реакционной способности молекулы. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой. Это положение в равной степени относится как к органическим, так и к неорганическим веществам.
Следствия теории химического строения
Изомерия — важнейший объект, явленние и понятие теории химического строения.

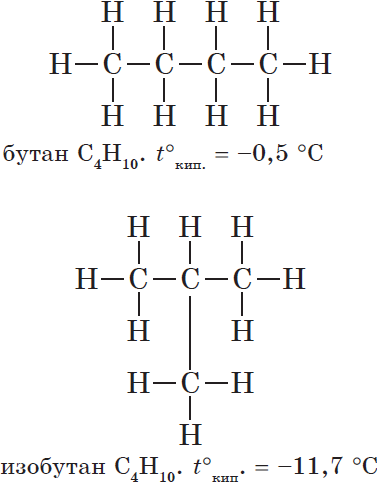
Важным положением теории А.М. Бутлерова является объяснение способности многих органических веществ к изомерии, установление причины этого явления. Утверждению этого положения теории способствовало предсказание Бутлеровым существования двух изомеров бутана с общей формулой С4Н10: СН3—СН2—СН2—СН3 (нормальный бутан) и 
Предсказание и синтез изомеров бутана стали блестящим подтверждением правильности теории Бутлерова и выявили её основные функции — объяснение и прогнозирование.
А.М. Бутлеров вскрыл причину изомерии. Она состоит в том, что вещества с одинаковой общей формулой могут иметь разную последовательность соединения атомов в молекуле, то есть различаться химическим строением. Позднее такие соединения были названы структурными изомерами.
Структурная изомерия — это явление существования соединений, имеющих одинаковый качественный и количественный состав, но отличающихся последовательностью связывания атомов в молекуле, а следовательно, строением и свойствами.
Каждой теории химии присущ свой научный язык (символика, номенклатура, терминология). Для изображения структурных изомеров А.М. Бутлеров использовал структурные формулы, которые отражают химическое строение молекул, го есть последовательное соединение их атомов, и подтвердил, что каждое вещество имеет только одну структурную формулу.
Например, вещества с молекулярной формулой С5Н19 можно изобразить следующими структурными формулами, которые отражают строение трёх разных соединений, отличающихся друг от друга физическими и химическими свойствами:
Исходя из этого примера можно сделать следующий вывод.
Что понимают под химическим строением
В ходе изучения данной темы продолжаем краткий экскурс в историю развития науки, показывая развитие представлений о строении органических соединений. Важно, чтобы учащиеся четко осознали, что вплоть до конца XIX века, когда формировалась теория химического строения, не то что никаких понятий о строении атома и электронной природе химической связи еще не существовало, но и существование атомов и молекул было далеко не очевидно. Кроме того, в ходе урока вводятся понятия гомологические ряды и гомологическая разность, структурная формула, изомеры, изомерия, виды изомерии (структурной).
Возможность описать строение органических молекул появилась после того, как английский химик Э. Франкланд 
Для развития теории строения органических веществ очень плодотворным было предположение немецкого ученого Ф.Кекуле, что атомы углерода в органических соединениях всегда образуют четыре связи, т.е. четырехвалентны. Четырехвалентные атомы углерода могут соединяться друг с другом и образовывать цепочки.
Однако многие химики того времени считали, что с помощью химических формул нельзя отразить строение соединения, и тем более невозможно на основании формулы предсказать свойства вещества.
Для того чтобы разобраться в многообразии органических веществ, был необходим критический взгляд на господствовавшие в химии представления. Молодой российский ученый А.М.Бутлеров выступил на конгрессе с основными положения теории строения органических соединений. Сущность теории Бутлерова состоит в следующем: свойства молекулы определяются свойствами атомов, составляющих ее, их числом и расположением в молекуле.
Бутлеров ввел понятие «химическое строение молекулы», под которым он понимал порядок соединения атомов в молекуле.
| Отметим, что в настоящее время обычно просто говорят «строение молекулы», не добавляя «химическое». Дело в том, что во времена Бутлерова порядок расположения атомов в молекуле можно было определить лишь химическим путем, изучая химические свойства вещества. Но позднее оказалось, что определить положение атомов в молекуле можно не только химическими, но и физическими методами. Поэтому сейчас используют термин «строение молекулы». |
Формулы, отражающие последовательность атомов в молекуле, называют структурными. Каждую ковалентную связь в них изображают черточкой.
На примере формул все тех же веществ можно показать, что coкращенные структурные формулы, в которых не указаны черточки-связи между атомами С и Н, несут ту же информацию о веществе, но при этом намного удобнее.
Строение вещества устанавливают, изучая его химические свойства с помощью так называемых качественных реакций
Попросите учащихся привести известные им из неорганической химии примеры качественных реакций. Существуют качественные реакции на разные классы органических соединений.
В настоящее время строение молекул изучают и с помощью различных физических методов.
| Например, вещества разного строения ведут себя по-разному, если их поместить в магнитное поле или воздействовать на них различными излучениями. На этом основано изучение строения веществ методами ядерного магнитного резонанса, инфракрасной и ультрафиолетовой спектроскопии. А с помощью рентгеноструктурного анализа можно получить прямую информацию о том, как расположены друг относительно друга атомы в кристалле. |
Имеет смысл после обсуждения суммировать основные положения теории строения органических соединений:
| 1. Атомы в молекуле расположены в определенном порядке друг относительно друга в соответствии с их валентностью. Последовательность расположения атомов в молекуле называют строением молекулы. |
2. Свойства веществ зависят не только от их состава (вида и числа атомов, входящих в молекулу), но и от строения молекул. Атомы в молекуле оказывают друг на друга взаимное влияние, от которого зависят физические и химические свойства веществ.
3. Строение вещества можно установить экспериментально, изучая его химические и физические свойства, и выразить химической формулой.
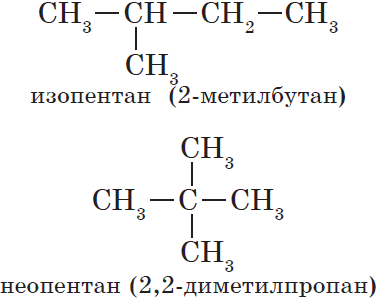
Число изомеров с увеличением числа атомов углерода в молекуле углеводорода быстро возрастает. Например, для соединения состава С5H12 возможно существование трех изомеров, С6H14 — пяти, С10H22 — 75, а число возможных веществ состава С20Н42 огромно и составляет 366319.
В ходе семинарского занятия на ту же тему школьники составляют структурные формулы веществ, определяют число изомеров данного состава, продолжают решать задачи на определение состава веществ.
Очень важно, чтобы учащиеся уверенно отвечали на вопросы типа: сколько веществ изображено следующими формулами (можно записать в различном виде структурную формулу одного и того же вещества, например, хлорэтана, у которого атом хлора расположен слева или справа, сверху или сбоку). Если учащиеся затрудняются отвечать на подобные вопросы, следует как можно больше использовать компьютерные или пластмассовые трехмерные модели веществ.
Примеры заданий для семинара:
1. Напишите структурные формулы соединений: С2H5Cl, CH4O, CH5N, СН4S.
2. Напишите все возможные структурные формулы для изомеров состава С5Н12 и С6Н14.
3. Сколько может существовать изомеров состава C4H9Br и С3Н6Сl2? Напишите их структурные формулы.
4. Известно семь соединений состава С4Н10О. Напишите их структурные формулы.
Когда учащиеся достаточно уверенно будут составлять структурные формулы, можно попросить их обсудить, например, подобные вопросы:
Может ли существовать устойчивое соединение с молекулярной формулой С3H5?
Возможно ли существование углеводородов с нечетным числом атомов водорода в молекуле?
Можно попробовать вывести общую формулу насыщенных углеводородов (обычно, если класс сильный, формулу CnH2n+2 выводят довольно легко).
И, конечно, необходимо продолжать решать задачи на определение состава органических веществ, дополнив их заданием: по найденной молекулярной формуле написать возможные структурные формулы.
В ходе занятия, работая с формулами и моделями, очень важно кратко комментировать, что за вещества описывают данные формулы, зачем они применяются.
Это необходимо для того, чтобы учащиеся понимали, что за химической формулой всегда стоит конкретное вещество, чтобы химия из науки о веществе не превращалась в науку манипулирования формулами.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Большая Энциклопедия Нефти и Газа
Химическое строение вещества и характер заместителей влияют на взрывчатые свойства. [2]
Химическое строение вещества определяет его физические и химические свойства. Изменение последовательности связи атомов приводит к появлению нового вещества. Этим объясняется явление изомерии, суть которого заключается в том, что вещества с одинаковым качественным и количественным составом имеют разное строение и поэтому обладают различными свойствами. [3]
Химическое строение веществ определяет их физические и химические свойства. [6]
Химическое строение смолисто-асфальтообразных веществ до сих пор достаточно не выяснено, так как они являются смесью высокомолекулярных соединений, легко поддающихся химическим превращениям, в частности окислению. [7]
Чтобы определить химическое строение вещества при исследовании деструктивных превращений, используют различные физико-химические методы, которые позволяют измерить параметры вещества, зависящие от его строения. Выбор физического параметра определяется обычно чувствительностью этого параметра к изменению структуры и задачами исследования. [10]
В оценке химического строения вещества и характера связей между атомами Бутлеров был более прав, нежели Менделеев, который ограничивал понятия атомности, или валентности, эмпирическими представлениями о пределе и о формах соединений. [11]
Изучение влияния химического строения веществ на их ионизацию целесообразно по многим причинам. [12]
Связь между химическим строением веществ и их биологическим действием является центральной проблемой в токсикологии и фармакологии. Известно, что все свойства вещества обусловлены его химическим строением. Отсюда следует, что различия в токсическом действии веществ связаны с различиями в структуре их молекул. [13]