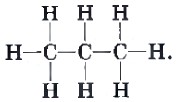
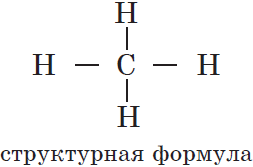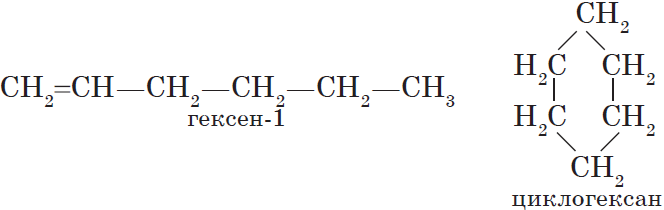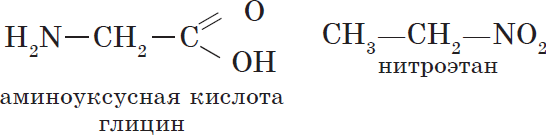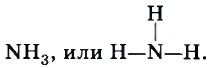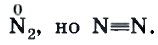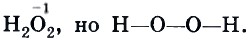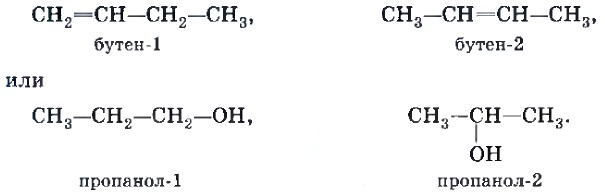Что понимают под химическим строением молекул органических
Теория строения органических соединений. Типы связей в молекулах органических веществ
Теория к заданию 12 из ЕГЭ по химии
Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах
Теория химического строения органических соединений А. М. Бутлерова
Подобно тому, как для неорганической химии основой развития являются Периодический закон и Периодическая система химических элементов Д. И. Менделеева, для органической химии основополагающей стала теория строения органических соединений А. М. Бутлерова.
Основным постулатом теории Бутлерова является положение о химическом строении вещества, под которым понимается порядок, последовательность взаимного соединения атомов в молекулы, т.е. химическая связь.
Под химическим строением понимают порядок соединения атомов химических элементов в молекуле согласно их валентности.
Основные положения теории А. М. Бутлерова
Теория строения органических соединений является динамичным и развивающимся учением. По мере развития знаний о природе химической связи, о влиянии электронного строения молекул органических веществ стали пользоваться, кроме эмпирических и структурных, электронными формулами. В таких формулах указывают направление смещения электронных пар в молекуле.
Квантовая химия и химия строения органических соединений подтвердили учение о пространственном направлении химических связей (цис- и трансизомерия), изучили энергетические характеристики взаимных переходов у изомеров, позволили судить о взаимном влиянии атомов в молекулах различных веществ, создали предпосылки для прогнозирования видов изомерии и направления и механизма протекания химических реакций.
Органические вещества имеют ряд особенностей:
Изомерия и гомология органических веществ
Свойства органических веществ зависят не только от их состава, но и от порядка соединения атомов в молекуле.
Изомерия — это явление существования разных веществ — изомеров с одинаковым качественным и количественным составом, т.е. с одинаковой молекулярной формулой.
Различают два вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связи атомов в молекуле; стереоизомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.
Выделяют следующие разновидности структурной изомерии: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию).
Структурная изомерия
Изомерия положения обусловлена различным положением кратной связи, заместителя, функциональной группы при одинаковом углеродном скелете молекулы:
Изомерами являются углеводород, относящийся к алкинам, — бутин-1 и углеводород с двумя двойными связями в цепи бутадиен-1,3:
Изомеры этого типа содержат различные функциональные группы и относятся к разным классам веществ. Поэтому они отличаются по физическим и химическим свойствам значительно больше, чем изомеры углеродного скелета или изомеры положения.
Пространственная изомерия
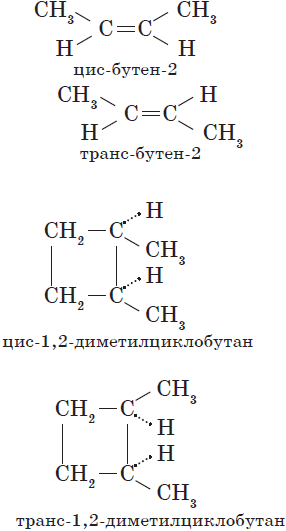
Пространственная изомерия подразделяется на два вида: геометрическую и оптическую. Геометрическая изомерия характерна для соединений, содержащих двойные связи, и циклических соединений. Так как свободное вращение атомов вокруг двойной связи или в цикле невозможно, заместители могут располагаться либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение). Обозначения цис- и транс- обычно относят к паре одинаковых заместителей:
Геометрические изомеры различаются по физическим и химическим свойствам.
Изучение оптической изомерии необходимо при рассмотрении многих реакций, протекающих в организме. Большинство этих реакций идет под действием ферментов — биологических катализаторов. Молекулы этих веществ должны подходить к молекулам соединений, на которые они действуют, как ключ к замку, следовательно, пространственное строение, взаимное расположение участков молекул и другие пространственные факторы имеют для течения этих реакций большое значение. Такие реакции называются стереоселективными.
Большинство природных соединений являются индивидуальными энантиомерами, и их биологическое действие резко отличается от свойств их оптических антиподов, полученных в лаборатории. Подобное различие в биологической активности имеет огромное значение, так как лежит в основе важнейшего свойства всех живых организмов — обмена веществ.
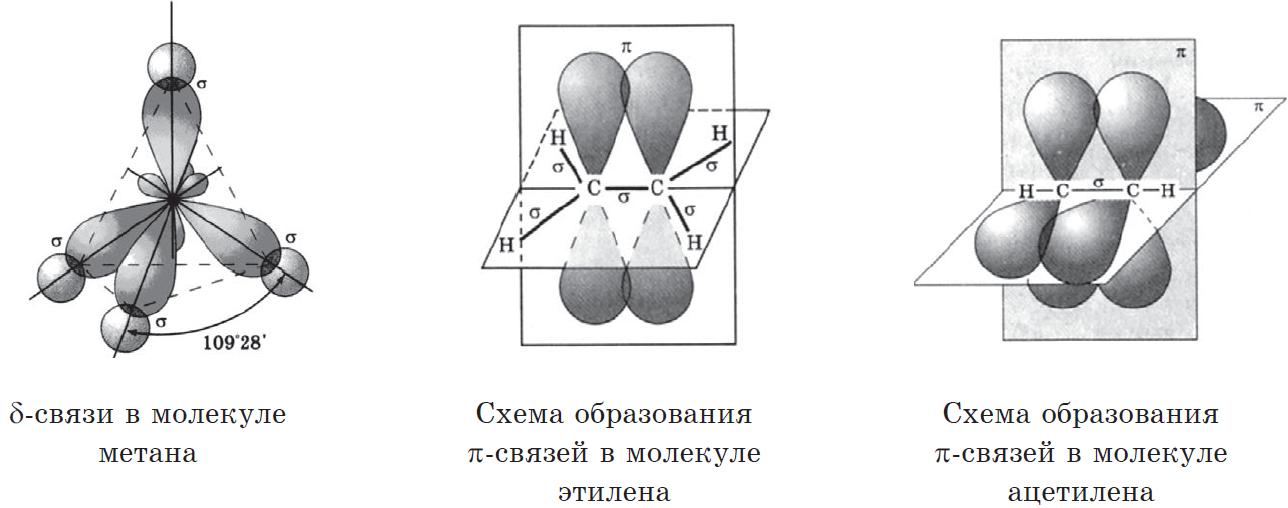
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ.
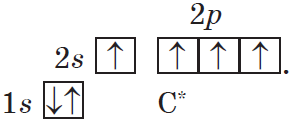
Такой атом имеет четыре неспаренных электрона и может принимать участие в образовании четырех ковалентных связей.
Характеристики одинарных и кратных связей между атомами С.
| Молекула | Тип гибридизации | Валентный угол | Длина связи, нм | Энергия связи, кДж/моль |
| $CH_3-CH_3$ | $sp^3$ | $109°5’$ | $0.154$ | $369$ |
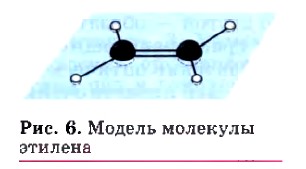
| $CH_2=CH_2$ | $sp^2$ | $120°$ | $0.134$ | $712$ |
| $CH≡CH$ | $sp^3$ | $180°$ | $0.120$ | $962$ |
Радикал. Функциональная группа.
Одной из особенностей органических соединений является то, что в химических реакциях их молекулы обмениваются не отдельными атомами, а группами атомов. Если эта группа атомов состоит только из атомов углерода и водорода, то она называется углеводородным радикалом, если же она имеет атомы других элементов, то она называется функциональной группой. Так, например, метил ($СН_3$—) и этил ($С_2Н_5$—) являются углеводородными радикалами, а оксигруппа (—$ОН$), альдегидная группа (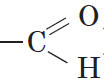
Как правило, функциональная группа определяет химические свойства органического соединения и поэтому является основой их классификации.
§ 2. Теория строения органических соединений
Подобно тому как в неорганической химии основополагающей теоретической базой являются Периодический закон и Периодическая система химических элементов Д. И. Менделеева, так в органической химии ведущей научной основой служит теория строения органических соединений Бутлерова—Кекуле—Купера.
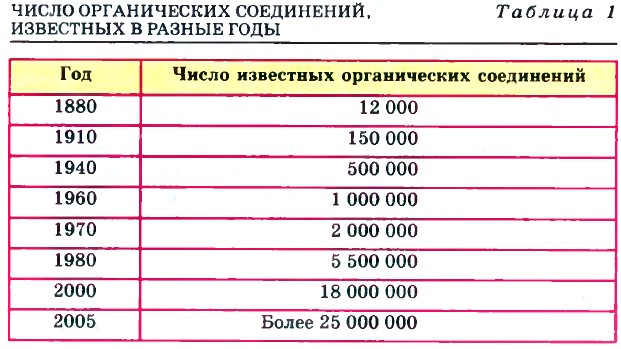
Как и любая другая научная теория, теория строения органических соединений явилась результатом обобщения богатейшего фактологического материала, который накопила органическая химия, оформившаяся как наука в начале XIX в. Открывались все новые и новые соединения углерода, количество которых лавинообразно возрастало (табл. 1).
Объяснить это многообразие органических соединений ученые начала XIX в. не могли. Еще больше вопросов вызывало явление изомерии.
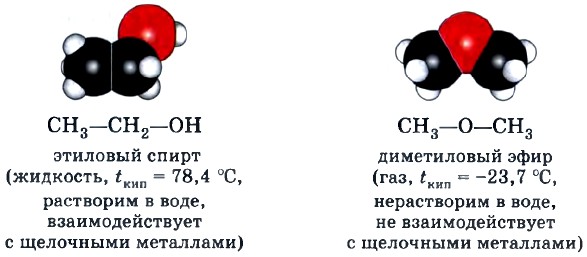
Например, этиловый спирт и диметиловый эфир — изомеры: эти вещества имеют одинаковый состав С2Н6O, но разное строение, т. е. различный порядок соединения атомов в молекулах, а потому и разные свойства.
Уже известный вам Ф. Вёлер в одном из писем к Й. Я. Берцелиусу так описывал органическую химию: «Органическая химия может сейчас кого угодно свести с ума. Она кажется мне дремучим лесом, полным удивительных вещей, безграничной чащей, из которой нельзя выбраться, куда не осмеливаешься проникнуть. »
Большое влияние на развитие химии оказали работы английского ученого Э. Франкланда, который, опираясь на идеи атомистики, ввел понятие валентность (1853).
В молекуле водорода Н2 образуется одна ковалентная химическая связь Н—Н, т. е. водород одновалентен. Валентность химического элемента можно выразить числом атомов водорода, которые присоединяет к себе или замещает один атом химического элемента. Например, сера в сероводороде и кислород в воде двухвалентны:
а азот в аммиаке трехвалентен:
В органической химии понятие «валентность» является аналогом понятия «степень окисления», с которым вы привыкли работать в курсе неорганической химии в основной школе. Однако это не одно и то же. Например, в молекуле азота N2 степень окисления азота равна нулю, а валентность — трем:
Обычно по отношению к ионным соединениям (хлорид натрия NaCl и многие другие неорганические вещества с ионной связью) не используют термин «валентность» атомов, а рассматривают их степень окисления. Поэтому в неорганической химии, где большинство веществ имеют немолекулярное строение, предпочтительнее применять понятие «степень окисления», а в органической химии, где большинство соединений имеют молекулярное строение, как правило, используют понятие «валентность».
Теория химического строения — результат обобщения идей выдающихся ученых-органиков из трех европейских стран: немца Ф. Кекуле, англичанина А. Купера и русского А. Бутлерова.
В 1857 г. Ф. Кекуле отнес углерод к четырехвалентным элементам, а в 1858 г. он одновременно с А. Купером отметил, что атомы углерода способны соединяться друг с другом в различные цепи: линейные, разветвленные и замкнутые (циклические).
Работы Ф. Кекуле и А. Купера послужили основой для разработки научной теории, объясняющей явление изомерии, взаимосвязь состава, строения и свойств молекул органических соединений. Такую теорию создал русский ученый А. М. Бутлеров. Именно его пытливый ум «осмелился проникнуть» в «дремучий лес» органической химии и начать преобразование этой «безграничной чащи» в залитый солнечным светом регулярный парк с системой дорожек и аллей. Основные идеи этой теории впервые были высказаны А. М. Бутлеровым в 1861 г. на съезде немецких естествоиспытателей и врачей в г. Шпейере.
Кратко сформулировать основные положения и следствия теории строения органических соединений Бутлерова—Кекуле—Купера можно следующим образом.
1. Атомы в молекулах веществ соединены в определенной последовательности согласно их валентности. Углерод в органических соединениях всегда четырехвалентен, а его атомы способны соединяться друг с другом, образуя различные цепи (линейные, разветвленные и циклические).
Органические соединения можно расположить в ряды сходных по составу, строению и свойствам веществ — гомологические ряды.
Нетрудно заметить, что для гомологических рядов можно вывести общую формулу ряда. Так, для алканов эта общая формула СnН2n + 2.
2. Свойства веществ зависят не только от их качественного и количественного состава, но и от строения их молекул.
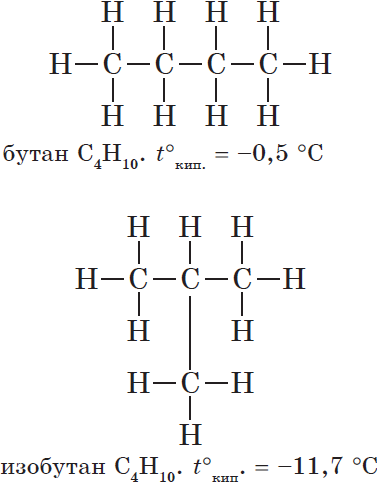
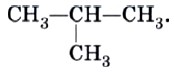
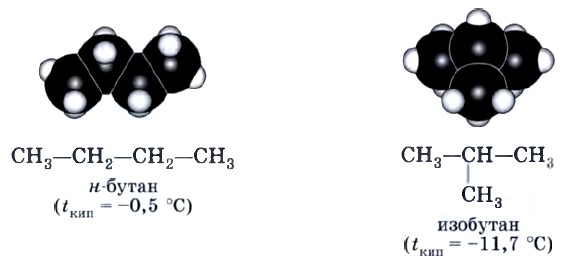
Это положение теории строения органических соединений объясняет явление изомерии. Очевидно, что для бутана С4Н10, помимо молекулы линейного строения СН3—СН2—СН2—СН3, возможно также и разветвленное строение:
Это уже совершенно новое вещество со своими индивидуальными свойствами, отличными от свойств бутана линейного строения.
Бутан, в молекуле которого атомы расположены в виде линейной цепочки, называют нормальным бутаном (н-бутаном), а бутан, цепь атомов углерода которого разветвлена, называют изобутаном.
Существует два основных типа изомерии — структурная и пространственная.
В соответствии с принятой классификацией различают три вида структурной изомерии.
Изомерия углеродного скелета. Соединения отличаются порядком расположения углерод-углеродных связей, например рассмотренные н-бутан и изобутан. Именно этот вид изомерии характерен для алканов.
Изомерия положения кратной связи (С=С, С=С) или функциональной группы (т. е. группы атомов, определяющих принадлежность соединения к тому или иному классу органических соединений), например:
Межклассовая изомерия. Изомеры этого вида изомерии относятся к разным классам органических соединений, например рассмотренные выше этиловый спирт (класс предельных одноатомных спиртов) и диметиловый эфир (класс простых эфиров).
Различают два вида пространственной изомерии: геометрическую и оптическую.
Геометрическая изомерия характерна, прежде всего, для соединений с двойной углерод-углеродной связью, так как по месту такой связи молекула имеет плоскостное строение (рис. 6). Например, для бутена-2, если одинаковые группы атомов у атомов углерода при двойной связи находятся по одну сторону от плоскости С=С-связи, то молекула является цисизомером, если по разные стороны — трансизомером.
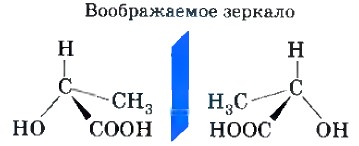
Оптической изомерией обладают, например, вещества, молекулы которых имеют асимметрический, или хиральный, атом углерода, связанный с четырьмя различными заместителями. Оптические изомеры являются зеркальным изображением друг друга, подобно двум ладоням, и не совместимы. (Теперь вам, очевидно, стало понятным второе название этого вида изомерии: греч. хирос — рука — образец несимметричной фигуры.) Например, в виде двух оптических изомеров существует 2-оксипропановая (молочная) кислота, содержащая один асимметрический атом углерода.
У хиральных молекул возникают изомерные пары, в которых молекулы изомеров относятся по своей пространственной организации одна к другой так же, как соотносятся между собой предмет и его зеркальное отображение. Пара таких изомеров всегда обладает одинаковыми химическими и физическими свойствами, за исключением оптической активности: если один изомер вращает плоскость поляризованного света по часовой стрелке, то другой — обязательно против. Первый изомер называют правовращающим, а второй — левовращающим.
Значение оптической изомерии в организации жизни на нашей планете очень велико, так как оптические изомеры могут существенно отличаться как по своей биологической активности, так и по совместимости с другими природными соединениями.
3. Атомы в молекулах веществ влияют друг на друга. Взаимное влияние атомов в молекулах органических соединений вы рассмотрите при дальнейшем изучении курса.
Современная теория строения органических соединений основывается не только на химическом, но и на электронном и на пространственном строении веществ, которое подробно рассматривается на профильном уровне изучения химии.
В органической химии широко используют несколько видов химических формул.
Молекулярная формула отражает качественный состав соединения, т. е. показывает число атомов каждого из химических элементов, образующих молекулу вещества. Например, молекулярная формула пропана: С3Н8.
Структурная формула отражает порядок соединения атомов в молекуле согласно валентности. Структурная формула пропана такова:
Часто нет необходимости детально изображать химические связи между атомами углерода и водорода, поэтому в большинстве случаев используют сокращенные структурные формулы. Для пропана такую формулу записывают так: СН3—СН2—СН3.
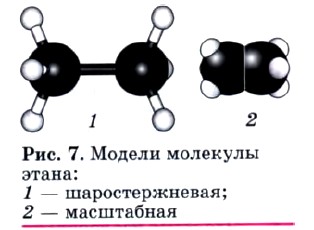
Строение молекул органических соединений отражают с помощью различных моделей. Наиболее известны объемные (масштабные) и шаростержневые модели (рис. 7).
1. Что такое валентность? Чем она отличается от степени окисления? Приведите примеры веществ, в которых значения степени окисления и валентности атомов численно одинаковы и различны.
2. Определите валентность и степень окисления атомов в веществах, формулы которых Сl2, СO2, С2Н6, С2Н4.
3. Что такое изомерия; изомеры?
4. Что такое гомология; гомологи?
5. Как, используя знания об изомерии и гомологии, объяснить многообразие соединений углерода?
6. Что понимают под химическим строением молекул органических соединений? Сформулируйте положение теории строения, которое объясняет различие в свойствах изомеров. Сформулируйте положения теории строения, которые объясняют многообразие органических соединений.
7. Какой вклад внес каждый из ученых — основоположников теории химического строения — в эту теорию? Почему ведущую роль в становление этой теории сыграл вклад русского химика?
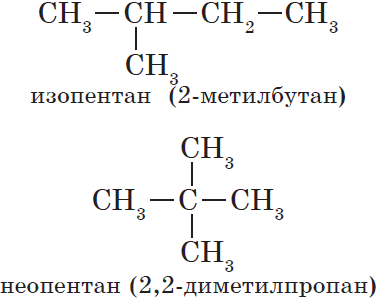
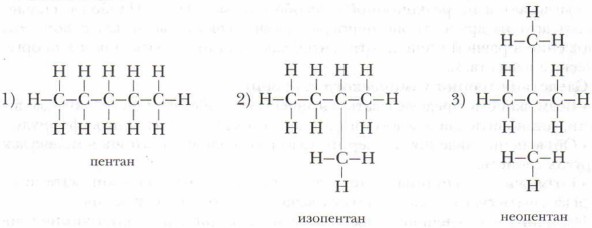
8. Возможно существование трех изомеров состава С5Н12. Запишите их полные и сокращенные структурные формулы.
9. По представленной в конце параграфа модели молекулы вещества (см. рис. 7) составьте его молекулярную и сокращенную структурную формулы.
§ 2. Теория химического строения А.М. Бутлерова
Теория (от греч. theoria — «исследование») — это система обобщённых знаний, объясняющих те или иные стороны действительности. Ядро любой теории составляют её основные понятия и законы, а суть теории выражают её основные положения. Теория является важным инструментом научного познания, направлена на обобщение, систематизацию, объяснение и предсказание явлений. Изученная и усвоенная теория становится средством добывания новых знаний.

К концу 50-х гг. XIX в. органическая химия накопила массу фактов об органических веществах и их свойствах. Методом экспериментального анализа были определены качественный и количественный состав многих природных органических соединений и их молекулярные формулы. Но этот материал не был достаточно систематизирован. Ряд особенностей органических соединений (они рассмотрены в § 1) не находили объяснения на основе имеющихся в то время теоретических представлений, например явление изомерии, открытое ещё в 20-е гг. XIX столетия. Учёных смущало и то, что многие органические соединения имели несколько химических формул. Например, хорошо известной уксусной кислоте приписывали два десятка формул.
В науке насущными стали вопросы: являются ли молекулы органических веществ беспорядочным нагромождением атомов, или же они имеют упорядоченное строение, и можно ли его установить путём экспериментального исследования веществ?

Убеждённым сторонником познаваемости строения органических веществ был А.М. Бутлеров.
К 50-м гг. XIX в. острой стала задача выявления зависимости свойств веществ не только от состава, но и от их строения. Требовалась теория, способная обобщить и систематизировать накопленный материал, объяснить строение органических веществ. Её отсутствие заметно тормозило развитие науки.
Такую теорию в 60-е гг. создал известный русский химик Александр Михайлович Бутлеров, назвавший её теорией химического строения. Основную идею и положения своей теории А.М. Бутлеров сформулировал в 1861 г. в статье «О химическом строении вещества». Под химическим строением он понимал последовательность соединения атомов в молекулах.
При создании теории учёный опирался на известные к тому времени представления о четырёхвалентности атома углерода, способности его атомов соединяться между собой, образуя углеродные цепи, а также на уже разграниченные понятия «атом» и «молекула». А.М. Бутлеров отмечал, что чёткие представления о химической частице и определение понятий «атом» и «молекула» были самым существенным успехом химии, позволившим перейти к выявлению химического строения веществ.

В основу теории химического строения были положены фундаментальные понятия: «химические частицы (атомы, молекулы)», «валентность», «химическое строение», «изомерия».
Основные положения теории химического строения
1. Атомы в молекулах соединены в определённой последовательности химическими связями. Порядок связи атомов называется химическим строением. Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами.
2. Соединение атомов в молекулу происходит в соответствии с их валентностью. Валентность углерода в органических веществах равна IV.
3. Свойства веществ зависят не только от их качественного и количественного состава, но и от того, в каком порядке атомы в молекуле соединены, т. е. от химического строения их молекул.
4. Многие органические вещества способны к изомерии.
5. Порядок связи атомов (химическое строение молекул) можно изучать и устанавливать химическими методами.
6. Атомы или группы атомов в молекуле взаимно влияют друг на друга, что сказывается на реакционной способности молекулы. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой. Это положение в равной степени относится как к органическим, так и к неорганическим веществам.
Следствия теории химического строения
Изомерия — важнейший объект, явленние и понятие теории химического строения.

Важным положением теории А.М. Бутлерова является объяснение способности многих органических веществ к изомерии, установление причины этого явления. Утверждению этого положения теории способствовало предсказание Бутлеровым существования двух изомеров бутана с общей формулой С4Н10: СН3—СН2—СН2—СН3 (нормальный бутан) и 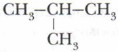
Предсказание и синтез изомеров бутана стали блестящим подтверждением правильности теории Бутлерова и выявили её основные функции — объяснение и прогнозирование.
А.М. Бутлеров вскрыл причину изомерии. Она состоит в том, что вещества с одинаковой общей формулой могут иметь разную последовательность соединения атомов в молекуле, то есть различаться химическим строением. Позднее такие соединения были названы структурными изомерами.
Структурная изомерия — это явление существования соединений, имеющих одинаковый качественный и количественный состав, но отличающихся последовательностью связывания атомов в молекуле, а следовательно, строением и свойствами.
Каждой теории химии присущ свой научный язык (символика, номенклатура, терминология). Для изображения структурных изомеров А.М. Бутлеров использовал структурные формулы, которые отражают химическое строение молекул, го есть последовательное соединение их атомов, и подтвердил, что каждое вещество имеет только одну структурную формулу.
Например, вещества с молекулярной формулой С5Н19 можно изобразить следующими структурными формулами, которые отражают строение трёх разных соединений, отличающихся друг от друга физическими и химическими свойствами:
Исходя из этого примера можно сделать следующий вывод.