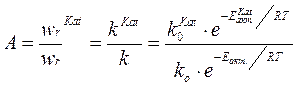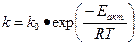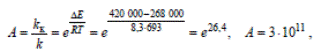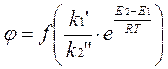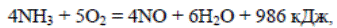Что понимают под температурой зажигания катализатора
Большая Энциклопедия Нефти и Газа
Температура зажигания катализаторов зависит от содержания в них калия. [2]
Температура зажигания катализатора является одним из важнейших параметров процесса каталитической очистки, определяющим не только температурный режим работы реактора, но и аппаратурное оформление всей установки и расход спецстали. Чем химически активнее катализатор, тем ниже его температура зажигания. [3]
Температурой зажигания катализатора Т3 называется минимальная температура, при которой процесс начинает протекать с достаточной для технологических целей скоростью. [4]
Температурой зажигания катализатора называют минимальную температуру реагирующей смеси, при которой процесс начинает протекать с достаточной для практических целей скоростью. Чем активнее катализатор, тем ниже температура зажигания, что особенно важно при проведении экзотермических обратимых реакций, так как при этом соответственно повышается степень превращения. [6]
Полученные значения температур зажигания катализаторов несколько условны, поскольку состав и скорость газа в опытах оыли отличны от условий промышленных контактных аппаратов. Однако разработанная методика может быть использована для сравнительной характеристики катализаторов по температуре зажигания. [7]
Этот метод определения температуры зажигания катализаторов нами усовершенствован путем применения автоматической записи кривых нагревания. [8]
Подогрев газа: до температуры зажигания катализатора ( при экзотермических процессах) или более высокой ( при эндотермических процессах) происходит в выносных теплообменниках, подогревателях, печах. Вез теплообменных элементов могут работать и однослойные аппараты с большим тепловым эффектом процесса. [10]
Температура работы катализатора
Дорогие друзья, в данной статье я не «открываю Америку» и не подливаю масло в огонь о спорах причин выхода из строя катколлектора (далее — кат), выбора моторных масел и так далее. Ниже представлено только моё личное мнение, если буду не прав, то исправьте и дополните!
Я очень трепетно отношусь к техническому состоянию любой техники, дабы я технарь, «гайки у меня всегда затянуты», масло меняется часто (7000 — 8000 км максимум), бензин только одного производителя (проверенного в моём регионе годами) и на одной заправке.
Я всё больше становлюсь сторонником того, что кат не убивает ДВС, а ДВС умирает по каким либо причинам и кат в дальнейшем «страдает» от этого. Кат умирает от повышенной температуры (в основном, на мой взгляд), но откуда берётся «жара», уже нужно искать.
По моим наблюдениям, причиной выхода из строя ката служит следующее (информация вся взята мною из блогов пользователей на drive2):
1. Расход (жор) масла в ДВС. Всем понятно, что при попадании в кат моторного масла, ничего хорошего из этого не выйдет. Кат забьётся, и как пирожок в печке спечётся. Почему так может быть? Тут вариантов много, но я бы выделил: перегрев ДВС (залягут кольца и так далее), неправильный выбор масла, либо масло оказалось подделкой. Я беру масло из бочки у ОД Shell Helix 5w-30 extra. Да, ресурс масла не велик, но для моего пробега между заменой (7-8т км) достаточно. По мере пробега щуп всегда на максимуме. Даже ОД мне заявили, что в исправном GAMMA ДВС и при правильно выбранном масле жор будет нулевым! Может и есть расход в 20-30 мл, но на щупе НИКАК не сказывается. Всегда на максимуме и точка.
Далее, возможно, что залегли кольца, что опять же приведёт к «жору» и спеканию ката. Исходя из этой причины, умерший кат — следствие, а не причина.
2. В камере сгорания топливо сгорает не полностью. Тут, собственно, всё понятно. Всё по аналогии с маслом: перегрев. По моим наблюдениям, такое происходит из-за некачественных (старых, бракованных, неподходящих) свечей, умерших катушках, смещения угла зажигания (привет прошивкам) при нашем качестве готовых нефтепродуктов. Вывод: умерший кат — следствие, а не причина.
3. Некачественный бензин, низкооктановый бензин и детонация. Топливо догарает в кате, кат перегревается, плавится и выходит из строя. Возможны задиры из-за детонации, масложорство и исход ясен. Вывод: умерший кат — следствие, а не причина. Исход и вывод, как в пункте 1 и 2.
4. Высокооктановый бензин и очень агрессивная езда. Думаю, что можно объединить. Возможно ли, что это будет причиной? Думаю, что да. Температура в кате неумолимо растет (ниже будут показатели), порог в 9хх градусов может быть преодолён. А дальше разрушение ката.
5. Долгий прогрев! Такая теория тоже есть, но я не совсем понимаю, с чем это связано.
6. Дефект производителя. Но на сколько это часто встречается?
Но как можно контролировать «здоровье» ката при том, что мы уверены в ДВС и его «здоровье» до того, как мы заправились, сменили масло, сменили свечи или помыли двигатель.
1. Приобрести эндоскоп. Открутить лямбду и проверить соты. Это визуальный осмотр.
2. Контролировать уровень масла. Если нет жора, то значит это уже не может быть причиной.
3. Качество топлива можно проверить косвенно, если знать температуру выхлопных газов в катализаторе.
4. Да и про правильно выбранные свечи забывать не стоит.
В ближайшее время проверю эндоскопом обязательно. Лежит уже давно, руки никак не доходят. Щуп проверяется раз в 3 — 5 дней (привет опыт эксплуатации уаз хантер). Теперь привычка.
А вот температуру в кате я начал замерять недавно и было очень интересно наблюдать за нагревом ката на разных оборотах, простое и так далее:
Температура воздуха сегодня на момент теста (20.08.17) составляла 27-28 градусов в тени. Для теста я использовал «свежий» OBD сканер ELM 327 v1.5 из Китая и прекрасную программку для него на телефоне.
Вот мои наблюдения:
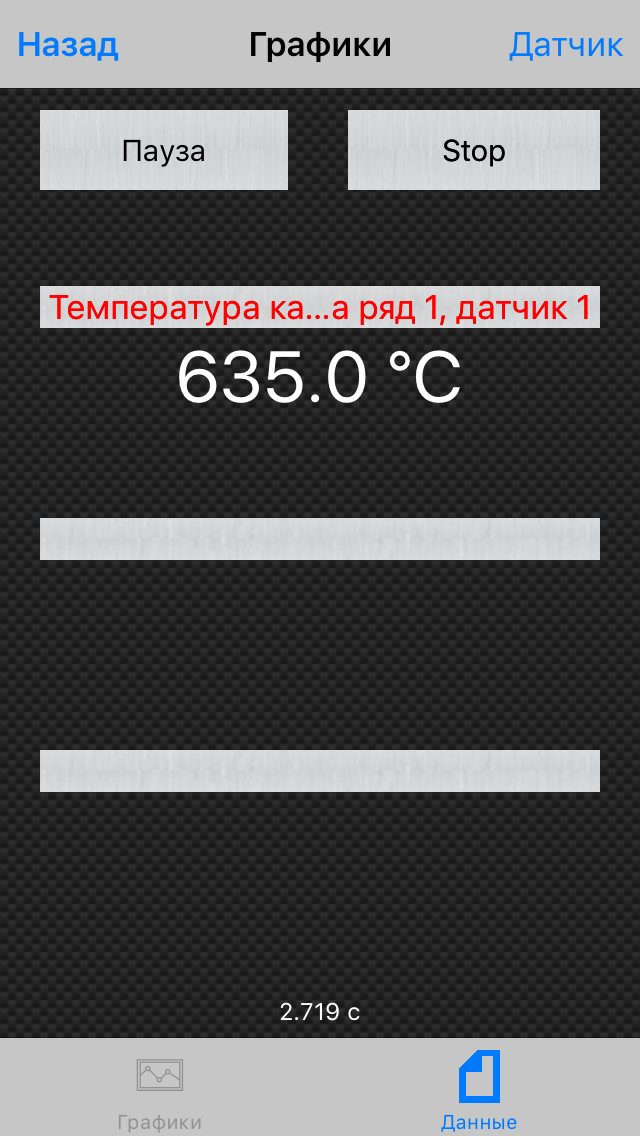
Кат прогревается моментально! Всё благодаря его расположению в коллекторе. За то время, как я завел авто и подключил настроенную прогу на телефоне к уже вставленному в разьем OBD сканеру (минута — полторы), температура была 330 градусов:
На более менее прогретом ДВС температура продолжила расти уже не так быстро и я покатился на первой передаче на отметке в 370 градусов:
Далее, езда не спеша на 1 — 3 (обороты не более 2000) передаче при выезде со двора:
Ну что, поехали по городу…езда строго спокойная, обороты 2000 — 2500, передачи 1 — 4 с учётом светофоров.
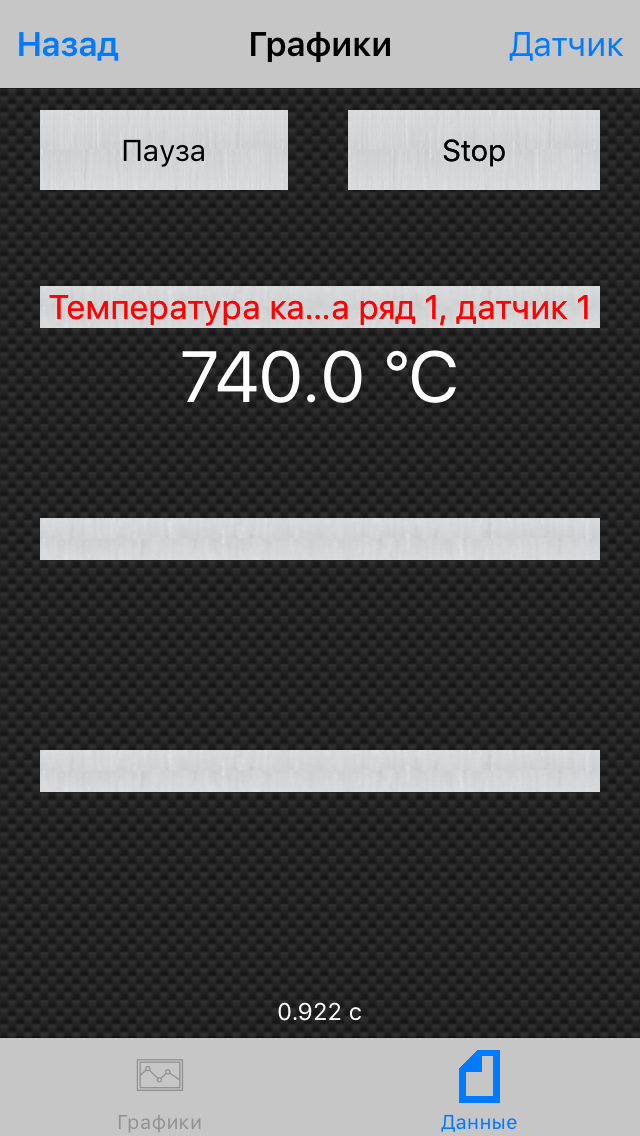
Температура при 2000 оборотах и на четвёртой передаче максимально составила 740 градусов:
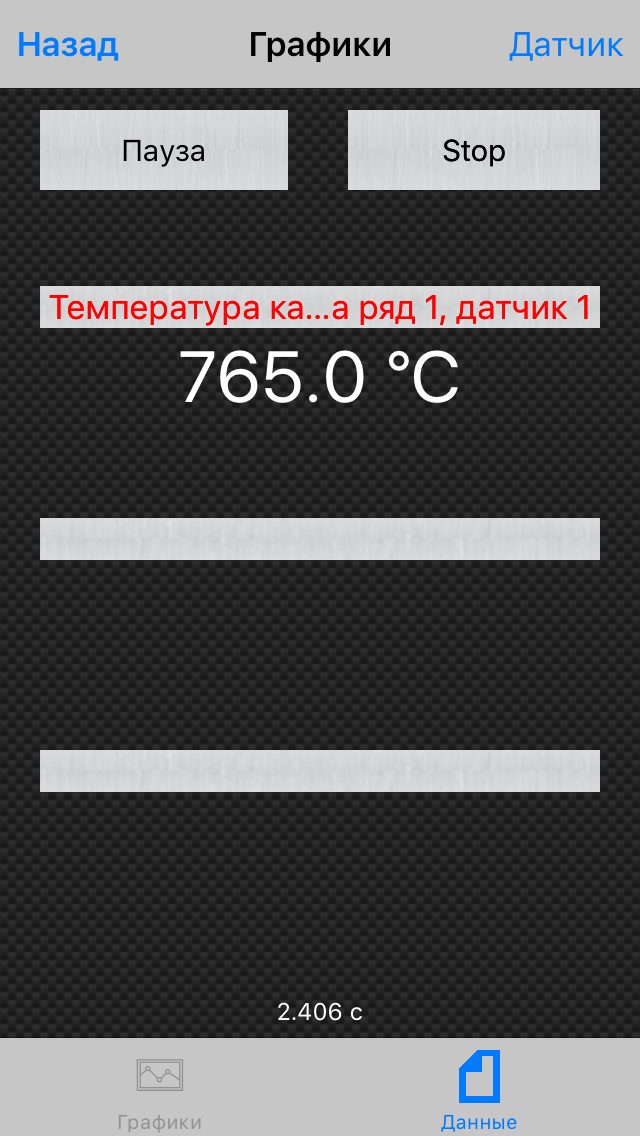
При 2500 оборотах уже 765 градусов:
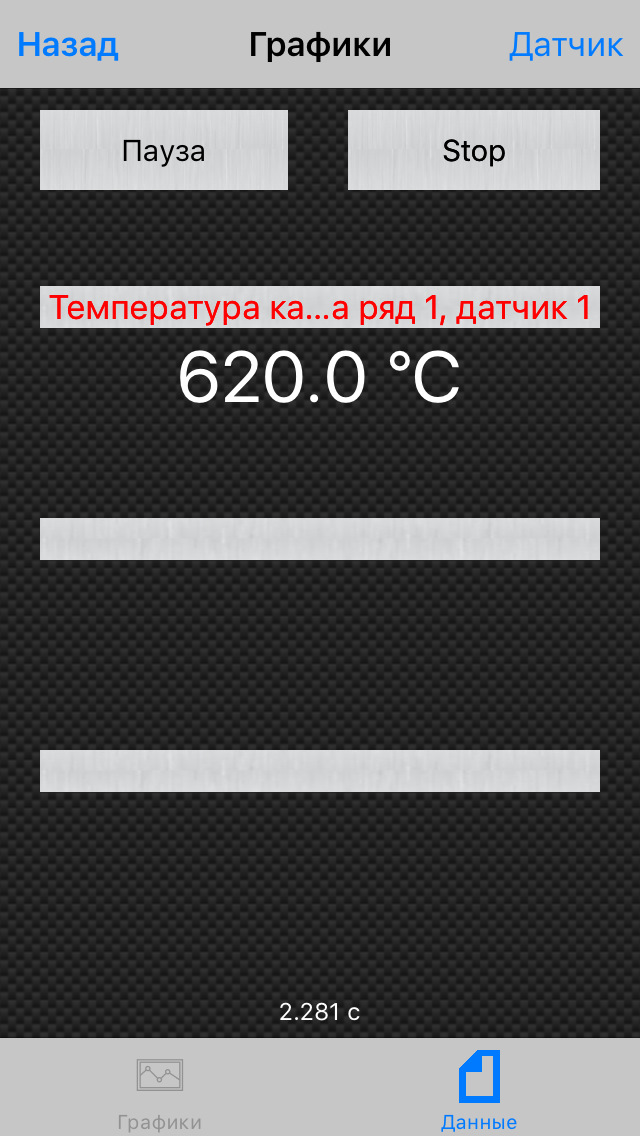
При остановке на светофорах (10 — 20 секунд) температура ката падает быстро и стоит на отметке в 620 градусов:
Далее, более агрессивная езда, быстрый набор оборотов, но не более 3000 оборотов, передачи те же 1 — 4 (выходной день, пробки, светофоры).
При переключении на 3000 оборотах и езде в этом же диапазоне, температура стремительно возрастает:
Не стал дальше проводить тест, видно, что температура в кате моментально меняется в зависимости от режима езды. Кстати, на трассе на 5 — 6 передаче и скорости в 70 — 90 км в час, кат имеет температуру не менее 850 градусов. Вот так.
Очевидно, что кат надо располагать дальше, чтобы не был такой горячий, но экология требует. Из этого видно, что даже одной заправки плохим бензином достаточно, чтобы получить перегрев ката. Особенно на трассе. Как ни странно.
Думаю, что свести к минимуму отмазки ОД от ремонта можно лишь обслуживая авто у того же ОД. Масло их, свечи их. При условии, что бензин будет хорошим, деваться им некуда… Мой ОД при использовании их расходников (естественно я не говорю о салонном фильтре, например) делает скидку на некоторые вещи, становится даже дешевле у них произвести работы ТО-1,5 у ОД. Решать Вам, деньги ВАШИ.
Технологические характеристики твердых катализаторов
При практическом применении большое значение имеет технологическая характеристика промышленных катализаторов (активность, температура зажигания, производительность, селективность, отравляемость, прочность и др.).
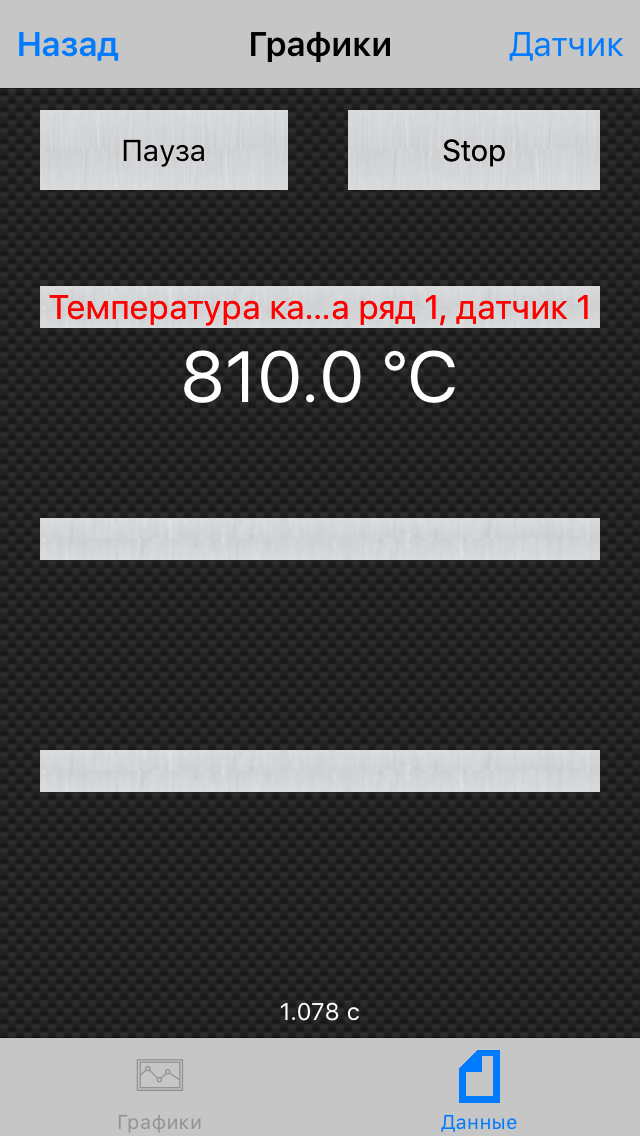
1. Активность катализатора А – мера ускоряющего воздействия по отношению к данной реакции:
Из уравнения Аррениуса:
Ускоряющее действие катализатора можно наглядно проследить на примере окисления сернистого ангидрида
Реакция в отсутствие катализатора протекает крайне медленно (при 420 °С, или 693 К энергия активации составляет приблизительно 420 000 Дж/моль). При проведении этой реакции на ванадиевом катализаторе (V2O5) Eк = 268 000 Дж / моль К, подставив эти величины в уравнение и учитывая, что R = 8,3 Дж / моль К, получаем
т.е. скорость реакции возрастает в сотни миллиардов раз.
Несмотря на то, что kat имеют высокую цену в стоимости нефтехимической продукции (цена kat составляет 0,001-0,1 %) технологическое и экономическое преимущество kat реализуется не за счет снижения цены kat в структуре себестоимости, а за счет экономии сырья, снижения энергозатрат процесса.
2. Температура зажигания Т˚заж – это минимальная температура, при которой технологический процесс начинает идти с достаточной для практических целей скоростью wr..
Понятие «зажигание» означает, что при возрастании температуры выше предельной, равной Т˚заж, происходит резкое, скачкообразное увеличение скорости реакции. «Зажигание» может иметь место и в некаталитических реакциях.
С технологической точки зрения лучше использовать катализаторы с низкой температурой зажигания Т˚заж, что позволяет снизить энергетический затраты на предварительный нагрев реакционной смеси, упрощается конструкция реактора, становится устойчивее технологический режим.
Особенно важно иметь невысокую температуру зажигания катализатора при проведении обратимых экзотермических реакций (невысокие температуры проведения процесса позволяют сместить равновесии реакции в сторону обр-я продуктов)
3. Селективность. Сложные каталитические реакции могут протекать по нескольким термодинамически возможным направлениям с образованием большого числа различных продуктов. Преобладающее течение реакции зависит от используемого катализатора, причем не всегда ускоряется процесс, термодинамически самый выгодный из нескольких возможных.
Селективностью или избирательностью катализатора φKat. называют его способность избирательно ускорять целевую реакцию при наличии нескольких побочных.
Экономия сырья осуществляется ч/з повышение селективности Kat. Современные Kat. должны иметь селективность не
Если одновременно протекает несколько параллельных реакций, можно подобрать разные селективные катализаторы для каждой из этих реакций.
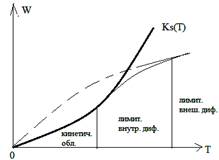
Селективность зависит не только от выбранного катализатора, но и от условий проведения процесса, области протекания гетерогенного каталитического процесса (кинетической, диффузионной).
Для сложной параллельной реакции протекающей по схеме:

Из этого уравнения видно, что при некоторой заданной температуре Т путем подбора соответствующего катализатора можно изменять разность E2 − E1 и, таким образом, создавать возможности для получения только или главным образом целевого продукта.
Примером избирательности катализатора может служить реакция окисления NH3 до NO на платиновом катализаторе
протекающая полностью за десятитысячные доли секунды, т.е. практически мгновенно. Одновременно с указанной реакцией протекают две параллельные реакции при которых образуются N2О и N2
Эти реакции термодинамически более выгодны, поскольку они сопровождаются выделением большого количества тепла, однако практически они не протекают, поскольку в присутствии платинового катализатора их скорость неизмеримо мала.
Особенно сильно селективность проявляется в сложных органических реакциях. Так, например, этиловый спирт в зависимости от типа катализатора и условий проведения процесса катализа может превращаться в следующие продукты: этилен СН2–СН2, диэтиловый эфир СН3–СН2–О–СН2–СН3, ацетон СН3СОСН3, бутадиен СН2 = СН–СН = СН2, ацетальдегид СН3СНО и другие продукты. Следовательно, применяя соответствующий катализатор, из одного и того же сырья можно получить различные целевые продукты.
4. Пористая и кристаллическая структура катализатора. Важным свойством катализатора является пористая структура, которая характеризуется размерами и формой пор, пористостью (отношением свободного объема пор к общему объему 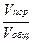
При выборе твердого вещества в качестве катализатора важную роль играет доступность поверхности катализатора для реагирующих газов. Чем больше для каждого данного катализатора поверхность, доступная для реагирующего газа, тем выше скорость расходования реагентов в единицу времени при использовании того же количества катализатора.
Промышленные катализаторы всегда имеют развитую внутреннюю поверхность, весьма небольшая, быстро подвергалась бы отправлению, и катализатор вскоре утрачивал бы активность А. Чем выше пористость катализатора и чем меньше диаметр пор, тем больше внутренняя поверхность. Современные катализаторы, характеризуются большими значениями удельной поверхности (до 10-100 м 2 /г).
В качестве катализаторов стараются применить природные или искусственные высокопористые адсорбенты (алюмосиликаты, цеолиты, силикагель, активированный уголь и т.д.) Эти вещества используют в качестве носителей, на поверхность которых наносят активные компоненты.
Наряду с пористой структурой большое значение имеет кристаллическая структура катализаторов. Различные кристаллические модификации одного и того же вещества могут обладать сильно отличающейся каталитической активностью. Например, переход γ-Al2O3 в α-Al2O3 на несколько порядков снижает активность этого вещества как катализатора дегидрирования.
5. Механическая прочность контактной массы должна быть такой, чтобы она не разрушалась под действием собственного веса в аппаратах с неподвижным слоем катализатора и не истиралась в аппаратах с движущимся слоем катализатора.
6. Промотирование и отравление катализаторов. Часто введение очень небольшого количества (долей %) какой-либо посторонней добавки к основному катализатору приводит либо к резкому повышению его активности ↑А, либо, наоборот, к снижению активности ↓А на несколько порядков. В первом случае говорят о промотировании, во втором – об отравлении катализатора.
Механизм промотирования твердых катализаторов может быть различным. Добавки могут вступать с основным катализатором в химическое взаимодействие, образуя на поверхности продукты, обладающие более высокой каталитической активностью. Они могут изменить условия взаимодействия с реагентами в местах контакта основного компонента и промотора, а также увеличить дисперсность или стабилизировать пористую и кристаллическую структуру катализатора и т.п.
Практическому использованию каталитических процессов часто препятствует снижение активности катализатора при воздействии на него веществ, называемых каталитическими ядами.
Это объясняется теорией активных центров, согласно которой каталитическую активность проявляет не вся поверхность катализатора, а лишь некоторые ее участки, обладающие определенным энергетическим и геометрическим соответствием реагирующим молекулам, – активные центры. Каталитические яды блокируют активные центры, образуя с ними поверхностные химические соединения. (Хромоксидные катализаторы дегидрирования УВ отравляются водой)
Отравление бывает обратимым и необратимым. При обратимом отравлении активность катализатора постепенно восстанавливается, если в реакционной смеси больше не содержится каталитического яда. При необратимом отравлении действием свежей реакционной смеси активность восстановить не удается, в этом случае требуется замена катализатора. Одно и то же вещество может вызвать и обратимое и необратимое отравления, в зависимости от продолжительности его действия, концентрации в реакционной смеси, температуры процесса.
7. Устойчивость к контактным ядам является важнейшим свойством промышленных катализаторов. Для удлинения срока службы катализатора в промышленных условиях в технологических схемах предусматривают тщательную очистку реагирующих веществ от примесей, являющихся каталитическими ядами.
В ряде случаев катализатор отравляется побочными продуктами реакции. Так, в реакциях органических соединений (крекинга, дегидрирования, изомеризации) отравление катализаторов часто происходит в результате образования высокоуглеродистой полимерной пленки (так называемого кокса) покрывающей поверхность катализатора. Для ее удаления цикл катализа сменяют циклом регенерации – катализатор продувают при высокой температуре воздухом для перевода кокса в СО2. Часто процесс оформляют по такой схеме: в одном реакторе идет химическая реакция, а в другом идет регенерация катализатора, заключающаяся в выжиге кокса с поверхности катализатора. В настоящее время в одном и том же реакторе есть зона реакции и зона регенерации.
Существуют каталитические яды, которые вызывают необратимое отравление катализатора и поэтому для некоторых процессов очень важна предварительная очистка сырья.
8. Так как большинство промышленных процессов протекает при достаточно высоких температурах, большое значение имеет стойкость катализаторов к таким температурам и резким их перепадам.
БИЛЕТ №14.



2) Гетерогенно-каталитические процессы. Технологические характеристики катализаторов. Механизм действия катализаторов.
Каталитические процессы подразделяют на гомогенные и гетерогенные. В промышленности наибольшее распространение получили гетерогенно-каталитические. при протекании большинства гетерогенно-каталитических процессов границей раздела фаз служит поверхность твердого катализатора, находящегося в газообразной реакционной среде. Преимуществом таких процессов является простота разделения продуктов реакции и частиц катализатора для повторного использования катализатора.
Катализ – процесс, в котором под влиянием веществ (катализаторов) изменяется механизм реакции и она протекает по энергетически более выгодному пути.
Катализатор – которое, многократно вступая в промежуточное взаимодействие с участниками реакции, изменяет ее механизм и увеличивает скорость реакции. Он восстанавливает свой химический состав после каждого цикла промежуточных взаимодействий.
1) ускоряет реакцию
2) изменяет диапазон температур
3) изменяет состав продуктов реакции
Сущность каталитического процесса:
1) снижается энергия активации (энергетический барьер)
Еак – энергия активации, сниженная благодаря действию катализатора
2) реакция протекает через ряд стадий
3) ускоряется достижение равновесия
Под влиянием катализаторов скорость может возрастать или уменьшаться, количество используемого катализатора очень мало. Реакции, в которых исходный или конечный продукт является катализатором, называются автокаталитические.
Механизм действия катализаторов связан с тем, что они изменяют энергию активации реакции за счет образования промежуточных соединений.
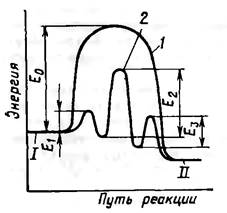
Влияние катализатора на механизм химической реакции поясним на примере. Пусть протекает одностадийная реакция с энергией активации Е0.
Ход реакции на энергетической диаграмме – кривая 2. В присутствии катализатора (Кт) механизм реакции изменяется, она протекает через несколько последовательных стадий (кривая 1).
Первая стадия – образование промежуточного активированного комплекса Акт:
Затем активированный комплекс реагирует со вторым реагентом с образованием комплекса катализатора и продукта: АКт+В→RКт.
Последняя стадия – разложение комплекса RКт с образованием продукта R и высвобождением катализатора для нового каталитического цикла: RКт→R+Кт.
каждая из этих последовательных стадий характеризуется своими значениями энергии активации Е1, Е2, Е3, но в большинстве случаев высота каждого из этих потенциальных барьеров ниже энергии активации Е0. Таким образом, в присутствии катализатора реакция протекает по энергетически более выгодному пути, что позволяет проводить процесс с большей скоростью.
Исходное I и конечное II энергетические состояния реакционной системы в присутствии катализатора и без него остаются одинаковыми. Катализатор не может изменить состояние химического равновесия, которое не зависит от пути реакции. Роль катализатора состоит в изменении скорости достижения состояния равновесия.
Некоторые химические реакции без катализаторов практически неосуществимы, например, из-за слишком большой энергии активации.
Важна роль катализаторов в осуществлении сложных реакций, т.к. катализаторы обладают способностью избирательно влиять на скорость только какой-то одной нужной реакции (крекинг нефтепродуктов).
Технологические характеристики твердых катализаторов:
1) активность катализатора – мера ускоряющего воздействия по отношению к данной реакции.
При сравнении разных катализаторов обычно выбирают более активный, если он удовлетворяет основным технологическим требованиям. Сравнивают катализаторы по константам скоростей, по скорости реакции или степени превращения реагентов, по производительности катализатора.
Если каталитическая реакция имеет такой же порядок, что и некаталитическая, т.е. их константы скорости kкат и k имеют одинаковые единицы измерения, активность катализатора А равна отношению констант:
Активность тем выше, чем больше снижается активация в присутствии катализатора. Однако рост активности из-за снижения энергии активации сдерживается уменьшением k0 кат по сравнению с k0.
2) селективность (избирательность)
Селективностью катализатора называют его способность избирательно ускорять целевую реакцию при наличии нескольких побочных. Селективность зависит не только от выбранного катализатора, но и от условий проведения процесса, области протекания гетерогенно-каталитического процесса (кинетической, внешне- или внутридиффузионной).
3) стойкость к каталитическим ядам.
Введение небольшого количества посторонней добавки к катализатору приводит либо к резкому повышению его активности (промотирование), либо к снижению активности на несколько порядков. Снижение активности связано с тем, что данная добавка по отношению к данному катализатору выступает в роли каталитического яда.
Отравление бывает обратимым и необратимым. При обратимом отравлении активность катализатора восстанавливается, если в реакционной смеси больше не содержится каталитического яда. При необратимом – активность не восстанавливается.
4) температура зажигания катализатора Тзаж.
Температура зажигания – это минимальная температура, при которой технологический процесс начинает идти с достаточной для практических целей скоростью.
Понятие «зажигание» означает, что при возрастании температуры выше предельной, равной Тзаж, происходит резкое, скачкообразное увеличение скорости реакции.
С технологической точки зрения лучше использовать катализаторы с низкой температурой зажигания, что позволяет снизить энергетические затраты на предварительный нагрев реакционной смеси.
5) пористая и кристаллическая структура катализатора.
Пористая структура характеризуется размерами, формой пор, пористостью (отношением свободного объема пор к общему объему), удельной поверхностью катализатора.
Твердые катализаторы – в основном высокопористые вещества с развитой внутренней поверхностью.
Чем больше для каждого данного катализатора поверхность, доступная для реагирующего газа, тем выше скорость расходования реагентов в единицу времени при использовании того же количества катализатора.
Поэтому в качестве катализаторов используют природные и искусственные высокопористые адсорбенты – алюмосиликаты, цеолиты, силикагель, активированный уголь.
Большое значение имеет кристаллическая структура катализатора. Различные кристаллические модификации одного и того же вещества могут обладать сильно отличающейся каталитической активностью.
Влияние температуры на каталитическую гетерогенную реакцию.
3) Паровая конверсия оксида углерода в производстве технологического газа для синтеза аммиака. Физико-химические основы процесса, выбор технологического режима, аппаратурное оформление.
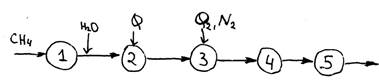
Принципиальная схема получения азотоводородной смеси.
2 – трубчатая печь, паровая конверсия
3 – кислородная конверсия
5 – очистка СО и СО2
Основным источником сырья для получения синтез-газа является твердое топливо, которое перерабатывается по следующим реакциям:
Синтез-газ получают по первой реакции, а необходимая температура слоя топлива достигается благодаря проведению второй реакции. Полученный водяной газ содержит 50-53% Н2 и 36% СО. Для дальнейшего использования в производстве водяной газ очищают от сернистых соединений и проводят конверсию оксида углерода по реакции:
Эта реакция частично осуществляется уже на стадии паровой конверсии метана, однако степень превращения оксида углерода при этом очень мала и в выходящем газе содержится до 11% СО и более. Для получения дополнительных количеств водорода и снижения до минимума концентрации СО в конвертированном газе осуществляют самостоятельную стадию каталитической конверсии СО водяным паром.
Синтез-газ из углеводородных газов является основным источником получения аммиака и метанола.
В соответствии с условиями термодинамического равновесия повысить степень конверсии СО можно удалением диоксида углерода из газовой смеси, увеличением содержания водяного пара или проведением процесса при возможно низкой температуре (∆H