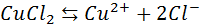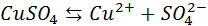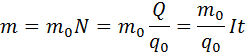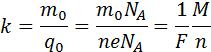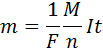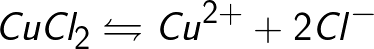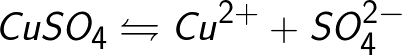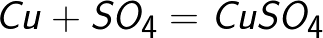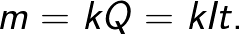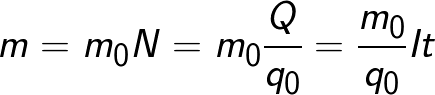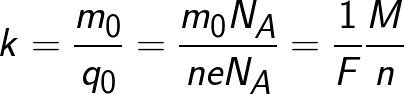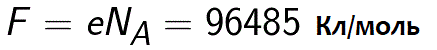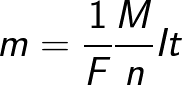Что представляет ток в электролитах
Электрический ток в электролитах
Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом вещества. Носителями свободных зарядов в электролитах являются положительно и отрицательно заряженные ионы. К электролитам относятся многие соединения металлов в расплавленном состоянии, а также некоторые твердые вещества. Однако основными представителями электролитов, широко используемыми в технике, являются водные растворы неорганических кислот, солей и оснований.
Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза.
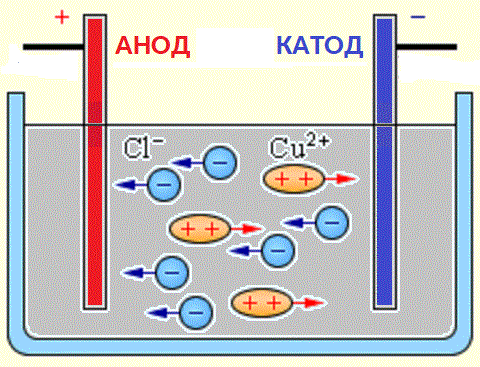
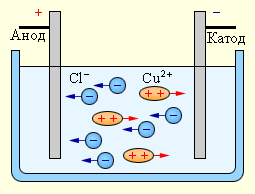
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией. Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора:
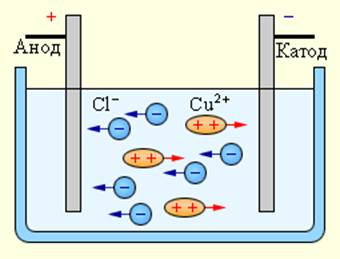
При подключении электродов к источнику тока ионы под действием электрического поля начинают упорядоченное движение: положительные ионы меди движутся к катоду, а отрицательно заряженные ионы хлора – к аноду (рис 1.15.1).
Достигнув катода, ионы меди нейтрализуются избыточными электронами катода и превращаются в нейтральные атомы, оседающие на катоде. Ионы хлора, достигнув анода, отдают по одному электрону. После этого нейтральные атомы хлора соединяются попарно и образуют молекулы хлора Cl2. Хлор выделяется на аноде в виде пузырьков.
Во многих случаях электролиз сопровождается вторичными реакциями продуктов разложения, выделяющихся на электродах, с материалом электродов или растворителей. Примером может служить электролиз водного раствора сульфата меди CuSO4 (медный купорос) в том случае, когда электроды, опущенные в электролит, изготовлены из меди.
Диссоциация молекул сульфата меди происходит по схеме
Нейтральные атомы меди отлагаются в виде твердого осадка на катоде. Таким путем можно получить химически чистую медь. Ион 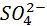
Образовавшаяся молекула сульфата меди переходит в раствор.
Таким образом, при прохождении электрического тока через водный раствор сульфата меди происходит растворение медного анода и отложение меди на катоде. Концентрация раствора сульфата меди при этом не изменяется.
Электролиз водного раствора хлорида меди
Закон электролиза был экспериментально установлен английским физиком Майклом Фарадеем в 1833 году. Закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе:
Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду Q, прошедшему через электролит:
Величину k называют электрохимическим эквивалентом.
Масса выделившегося на электроде вещества равна массе всех ионов, пришедших к электроду:
Здесь m0 и q0 – масса и заряд одного иона, 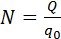
Так как заряд иона равен произведению валентности вещества n на элементарный заряд e (q0 = ne), то выражение для электрохимического эквивалента k можно записать в виде
Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде одного моля одновалентного вещества.
Закон Фарадея для электролиза приобретает вид:
Явление электролиза широко применяется в современном промышленном производстве.
Электрический ток в электролитах
Электрический ток в электролитах всегда связан с переносом вещества. В металлах и в полупроводниках, например, вещество, при прохождении через них тока, не переносится, поскольку в этих средах носителями тока являются электроны и дырки, а в электролитах — переносится. Так происходит потому, что в электролитах носителями свободных зарядов выступают положительно и отрицательно заряженные ионы вещества, а вовсе не электроны или дырки.
Многочисленные соединения металлов будучи расплавленными, а также некоторые твердые вещества — относятся к электролитам. Но главными представителями данного типа проводников, которые широко используются в технике, являются водные растворы неорганических кислот, оснований и солей.
Вещество, при прохождении электрического тока через среду электролита, выделяется на электродах. Данное явление называется электролизом. Когда через электролит течет электрический ток, положительно и отрицательно заряженные ионы вещества движутся одновременно в противоположных направлениях.
Отрицательно заряженные ионы (анионы) устремляются к положительному электроду источника тока (аноду), а положительно заряженные (катионы) — к отрицательному его полюсу (катоду).
Источниками ионов в водных растворах кислот, щелочей и солей являются нейтральные молекулы, часть которых расщепляется под действием приложенной электрической силы. Данное явление расщепления нейтральных молекул называется электролитической диссоциацией. К примеру хлорид меди CuCl2 распадается при диссоциации в водном растворе на ионы хлора (отрицательно заряженный) и меди (положительно заряженный).
Когда электроды подключаются к источнику тока, электрическое поле начинает действовать на ионы в растворе или расплаве, при этом анионы хлора движутся к аноду (положительному электроду), а катионы меди — к катоду (отрицательному электроду).
По достижении отрицательного электрода, положительно заряженные ионы меди нейтрализуются избытком электронов на катоде и становятся нейтральными атомами, которые на катоде и оседают. По достижении положительного электрода, отрицательно заряженные ионы хлора отдают по одному электрону в ходе взаимодействия положительным зарядом анода. При этом образовавшиеся нейтральные атомы хлора объединяются парами в молекулы Cl2, и хлор выделяется в виде пузырьков газа на аноде.
Молекула сульфата меди диссоциирует с образованием положительно заряженного иона меди Cu+ и отрицательно заряженного сульфат-иона SO4-. Нейтральные атомы меди оседают твердым осадком на катоде. Таким путем добывают химически чистую медь.
Сульфат-ион отдает положительному электроду два электрона и становится нейтральным радикалом SO4, который тут же реагирует с медным анодом (вторичная реакция на аноде). Продукт реакции на аноде — сульфат меди, который переходит в раствор.
Получается, что когда электрический ток пропускается через водный раствор сульфата меди, медный анод просто постепенно растворяется, а на катоде оседает медь. При этом концентрация водного раствора сульфата меди не изменяется.
В 1833 году английский физик Майкл Фарадей в ходе экспериментальной работы установил закон электролиза, который называется теперь его именем.
Закон Фарадея позволяет определить количество первичных продуктов, которые выделятся на электродах в процессе электролиза. Закон звучит так: «Масса m вещества, выделяющегося на электроде при электролизе прямо пропорциональна заряду Q, который прошел через электролит».
Коэффициент пропорциональности k в данной формуле называется электрохимическим эквивалентом.
Масса вещества, которое выделяется на электроде при электролизе, равна суммарной массе всех ионов, которые пришли к данному электроду:
В формуле присутствует заряд q0 и масса m0 одного иона, а также прошедший через электролит заряд Q. N – это количество ионов, которые пришли к электроду при прохождении заряда Q через электролит. Электрохимическим эквивалентом k поэтому называется отношение массы иона m0 к его заряду q0.
Поскольку заряд иона численно равен произведению валентности вещества на элементарный заряд, то химический эквивалент может быть представлен в следующем виде:
Где: Nа — постоянная Авогадро, М — молярная масса вещества, F – постоянная Фарадея.
Фактически постоянная Фарадея может быть определена как величина заряда, который должен пройти через электролит, чтобы на электроде при этом выделился один моль одновалентного вещества. Закон Фарадея для электролиза тогда приобретает вид:
Явление электролиза находит широчайшее применение в современном производстве. Например, путем электролиза в промышленности получают алюминий, медь, водород, диоксид марганца, пероксид водорода. Многие металлы извлекаются из руд и перерабатываются с помощью электролиза (электрорафинирование и электроэкстракция).
Также благодаря электролизу функционируют химические источники тока. Электролиз служит в очистке сточных вод (электроэкстракция, электрокоагуляция, электрофлотация). Многие вещества (металлы, водород, хлор и др.) получаются благодаря электролизу при гальваностегии и гальванопластике.
Если Вам понравилась эта статья, поделитесь ссылкой на неё в социальных сетях. Это сильно поможет развитию нашего сайта!
Подписывайтесь на наш канал в Telegram!
Просто пройдите по ссылке и подключитесь к каналу.
Не пропустите обновления, подпишитесь на наши соцсети:
Электрический ток в электролитах
Электролиты – это проводящие среды, в которых протекает электрический ток, сопровождающийся переносом вещества.
Какие вещества являются электролитами. Электролиз
Положительно и отрицательно заряженные ионы являются носителями свободных зарядов в электролитах. Соединения металлов в расплавленном состоянии, некоторые твердые вещества относят к электролитам. Основными их представителями являются водные растворы неорганических кислот, солей, оснований. Их широко применяют в технике.
При прохождении электрического тока через электролит происходит одновременное выделение веществ на электродах. Данное явление получило название электролиза.
Электрический ток в электролитах рассматривается как перемещение ионов с обоими знаками в противоположных направлениях.
Движение положительных ионов направлено к отрицательному электроду (катоду), а отрицательных – к положительному электроду (аноду). Появление ионов с противоположными знаками в водных растворах солей, кислот, щелочей является следствием расщепления нейтральных молекул. Явление получило название электролитической диссоциации.
При диссоциации в водном растворе хлорида меди CuCl 2 на ионы меди и хлора получаем выражение:
Многие реакции электролиза сопровождаются вторичными реакциями продуктов разложения, которые выделяются на электродах, с его материалом или растворителями.
Примером может служить электролиз раствора сульфата меди (медного купороса) CuSO 4 при опущенных в электролит электродов, изготовленных их меди.
Диссоциация молекул сульфата меди идет согласно формуле:
Получившаяся молекула сульфата меди переходит в раствор. Это показывает прохождение электрического тока через водный раствор сульфата меди для растворения медного анода и оседания меди на катоде. Концентрация данного раствора не меняется.
Закон электролиза
В 1833 году М. Фарадеем был установлен закон электролиза.
Постоянная Фарадея численно равняется заряду, который следует пропустить через электролит, для выделения на электроде одного моля одновалентного вещества.
Запись закона Фарадея для электролиза имеет вид
Явление электролиза широко применимо в современном промышленном производстве.
Что представляет ток в электролитах
Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом вещества. Носителями свободных зарядов в электролитах являются положительно и отрицательно заряженные ионы.
Основными представителями электролитов, широко используемыми в технике, являются водные растворы неорганических кислот, солей и оснований. Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза (рис.9.10).
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией.
Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году.
Первый закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе: масса m вещества, выделившегося на электроде, прямо пропорциональна заряду q, прошедшему через электролит:
где k – электрохимический эквивалент вещества:
F = eNA = 96485 Кл / моль. – постоянная Фарадея.
Второй закон Фарадея электрохимические эквиваленты различных веществ относятся их химические эквиваленты 
Объединенный закон Фарадея для электролиза:
Электролитические процессы классифицируются следующим образом:
получение неорганических веществ (водорода, кислорода, хлора, щелочей и т.д.);
получение металлов (литий, натрий, калий, бериллий, магний, цинк, алюминий, медь и т.д.);
очистка металлов (медь, серебро,…);
получение металлических сплавов;
получение гальванических покрытий;
обработка поверхностей металлов (азотирование, борирование, электрополировка, очистка);
получение органических веществ;
электродиализ и обессоливание воды;
нанесение пленок при помощи электрофореза.
Практическое применение электролиза
Электрохимические процессы широко применяются в различных областях современной техники, в аналитической химии, биохимии и т. д. В химической промышленности электролизом получают хлор и фтор, щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, химически чистые водород и кислород и т. д. При этом одни вещества получают путем восстановления на катоде (альдегиды, парааминофенол и др.), другие электроокислением на аноде (хлораты, перхлораты, перманганат калия и др.).
Электролиз в гидрометаллургии является одной из стадий переработки металлсодержащего сырья, обеспечивающей получение товарных металлов. Электролиз может осуществляться с растворимыми анодами – процесс электрорафинирования или с нерастворимыми – процесс электроэкстракции. Главной задачей при электрорафинировании металлов является обеспечения необходимой чистоты катодного металла при приемлемых энергетических расходах. В цветной металлургии электролиз используется для извлечения металлов из руд и их очистки.
Электролизом расплавленных сред получают алюминий, магний, титан, цирконий, уран, бериллий и др. Для рафинирования (очистки) металла электролизом из него отливают пластины и помещают их в качестве анодов 1 в электролизер 3 (рис.9.11). При пропускании тока металл, подлежащий очистке 1, подвергается анодному растворению, т. е. переходит в раствор в виде катионов. Затем эти катионы металла разряжаются на катоде 2, благодаря чему образуется компактный осадок уже чистого металла. Примеси, находящиеся в аноде, либо остаются нерастворимыми 4, либо переходят в электролит и удаляются.
На рисунке 9.11 приведена схема электролитического рафинирования меди.
Гальванотехника – область прикладной электрохимии, занимающаяся процессами нанесения металлических покрытий на поверхность как металлических, так и неметаллических изделий при прохождении постоянного электрического тока через растворы их солей. Гальванотехника подразделяется на гальваностегиюи гальванопластику.
Гальваностегия (от греч. покрывать) – это электроосаждение на поверхность металла другого металла, который прочно связывается (сцепляется) с покрываемым металлом (предметом), служащим катодом электролизера (рис. 9.12).
Способом гальваностегии можно покрыть деталь тонким слоем золота или серебра, хрома или никеля. С помощью электролиза можно наносить тончайшие металлические покрытия на различных металлических поверхностях. При таком способе нанесения покрытий, деталь используют в качестве катода, помещенного в раствор соли того металла, покрытие из которого необходимо получить. В качестве анода используется пластинка из того же металла.
 |  |
| Рис. 9.12 | Рис. 9.13 |
Рекомендуем просмотреть демонстрацию «Гальванопластика».
Гальванопластика – получение путем электролиза точных, легко отделяемых металлических копий значительной толщины с различных как неметаллических, так и металлических предметов, называемых матрицами (рис. 9.13).
С помощью гальванопластики изготовляют бюсты, статуи и т. д. Гальванопластика используется для нанесения сравнительно толстых металлических покрытий на другие металлы (например, образование «накладного» слоя никеля, серебра, золота и т. д.).
Электрический ток в электролитах
Содержание:
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду).
На странице -> решение задач по физике собраны решения задач и заданий с решёнными примерами по всем темам физики.
Электрический ток в электролитах
Электролиты – вещества, растворы или расплавы которых способны проводить электричество. Движение электрического тока в электролитах называется электролизом.
Электролитическая диссоциация
Рассмотрим прохождение электрического тока через растворы кислот, солей и щелочей.
Чистая дистиллированная вода — практически диэлектрик. Это можно показать с помощью следующего опыта: если последовательно с лампой накаливания соединить ванну с дистиллированной водой, в которую опущены металлические пластины, и включить лампу и ванну в сеть, то лампа не горит. Оказывается, раствор сахара в воде тоже не проводит тока. Если же с помощью пипетки ввести в ванну с водой несколько капель кислоты, то лампа ярка загорается. Значит, раствор кислоты в воде — хороший проводник тока. Рассмотрим причины этих явлений.
(стрелки показывают, что процесс протекает в обоих направлениях). Распад молекул на ионы под действием растворителя называют электролитической диссоциацией. Число, показывающее, какую часть всех молекул растворенного вещества составляют молекулы, распавшиеся на ионы, называется степенью диссоциации.
Итак, подвижными носителями зарядов в растворах являются только ионы. При диссоциации ионы водорода и всех металлов оказываются заряженными положительно. Ионы в растворе часто представляют собой группу из нескольких атомов.
Заметим еще, что диссоциацию молекул на ионы может вызвать не только растворитель. Например, при сильном нагревании вещества его молекулы, состоящие из ионов, могут диссоциировать на отдельные ионы. Поэтому расплавы солей тоже являются проводниками электрического тока.
Таким образом, согласно теории электролитической диссоциации, в растворах солей, кислот и щелочей всегда имеются свободные ионы, так как они появляются в момент растворения вещества в воде или в другом растворителе.
Электролиз
Выясним подробнее, как проходит ток через раствор, в котором имеются подвижные ионы.
Жидкий проводник, в котором подвижными носителями зарядов являются только ионы, называют электролитом. Пусть в ванну налит раствор серной кислоты в воде. Диссоциация молекул серной кислоты происходит в соответствии с уравнением
Опустим в ванну платиновые пластины и соединим их через амперметр с батареей (рис. 19.2). Эти пластины называются электродами. Электрод, соединенный с положительным полюсом батареи, называют анодом, электрод, соединенный с отрицательным полюсом, — катодом. Если замкнуть цепь ключом, то в электролите между электродами возникнет электрическое поле. Под действием сил этого поля ионы водорода Н + устремятся к катоду, а ионы кислотного остатка 
Оказывается, что в описанном случае кроме ионов 
Обозначая абсолютную величину заряда электрона буквой е, все эти процессы можно записать следующим образом:
*) Вертикальная стрелка означает, что газ выделяется из раствора.
Итак, из раствора уходят составные части молекул воды, а составные части молекул кислоты остаются в растворе. Это означает, что по мере прохождения тока количество воды в растворе убывает, а концентрация раствора возрастает. Вот почему описанный процесс иногда называют разложением воды электрическим током.
Из описанного выше видно, что прохождение электрического тока через электролиты сопровождается превращением вещества, т. е. ток в электролитах производит химическое действие. Прохождение электрического тока через электролиты, сопровождающееся химическими превращениями вещества и выделением его на электродах, называется электролизом. Сосуд с электродами, в котором находится электролит, называют электролитической ванной.
Положительные ионы в растворе называют катионами (так как при электролизе они идут к катоду), а отрицательные ионы — анионами. Напомним, что катионами являются ионы водорода и металлов.
В приведенном примере вещество выделяется на обоих электродах. Как мы увидим в следующем параграфе, это не всегда бывает так. Выделение вещества на обоих электродах происходит при неактивном аноде, который не растворяется в электролите. В нашем примере пластины не реагируют с электролитом. В технике для такого электролиза чаще пользуются угольными или графитовыми электродами.
Ток в электролите подчиняется закону Ома, т. е. изменяется прямо пропорционально напряжению. При нагревании электролитов уменьшается их вязкость и в них возрастает подвижность ионов. Кроме того, при нагревании электролита возрастает степень диссоциации молекул растворенного вещества, т. е. увеличивается количество носителей тока в электролите. Это означает, что сопротивление электролитов при нагревании уменьшается.
Электролиз, сопровождающийся растворением анода
Выше говорилось, что вещество при электролизе не всегда выделяется на обоих электродах. Если в электролитическую ванну налит раствор соли того вещества, из которого сделан анод, то вещество выделяется только на катоде, а анод растворяется. В этом случае анод называют активным, так как он реагирует с электролитом. В качестве примера такого электролиза рассмотрим очищение серебра от примесей, которое называется рафинированием.
В ванну с раствором азотно-кислого серебра опускают серебряные электроды, которые соединяют с батареей (рис. 19.3). Катодом служит тонкая серебряная пластина, анодом — толстая пластина из серебра, содержащего примеси. При электролизе серебро переносится с анода на катод, а примеси оседают на дно ванны. Выясним, как это получается.
Молекулы азотнокислого серебра диссоциируют:
При электролизе ионы серебра направляются к катоду и получают от него электрон, а нейтральные атомы серебра оседают на катоде, т. е. масса катода возрастает. К аноду направляются ионы 
Количество вещества, выделяющегося при электролизе. Первый закон Фарадея. Явление электролиза было изучено М. Фарадеем
Измеряя протекший через раствор заряд и массу катода до и после электролиза, Фарадей установил, что масса вещества, выделяющегося при электролизе, прямо пропорциональна количеству электричества, протекшего через раствор:

Формула (19.1) является математическим выражением первого закона Фарадея.
Опыты Фарадея показали, что масса выделенного при электролизе вещества зависит не только от величины заряда q, но и от рода вещества. Коэффициент пропорциональности k, выражающий зависимость массы выделенного при электролизе вещества от его рода, называют электрохимическим эквивалентом вещества. Электрохимический эквивалент измеряется массой вещества, выделяющегося на электроде при прохождении через электролит единицы заряда:

(Покажите, что в СИ единицей электрохимического эквивалента k является 1 кг/Кл.)
Поскольку 

Выясним, как теория объясняет результаты опытов Фарадея. Ион, разряжающийся при электролизе на катоде, присоединяет к себе определенное число электронов, например, ион серебра — один электрон, а ион меди — два электрона. Следовательно, заряд, перенесенный через электролит при прохождении тока, должен быть прямо пропорционален числу разрядившихся ионов. Поскольку массы ионов определенного вида точно одинаковы, то общая масса всех ионов пропорциональна их числу. А это означает, что масса выделенного при электролизе вещества должна быть прямо пропорциональна заряду, прошедшему через раствор, что соответствует закону Фарадея.
Поскольку ионы различного вида имеют неодинаковую массу (например, масса иона серебра в 107,9 раза больше, чем масса иона водорода), масса выделенного при электролизе вещества должна зависеть от его рода.
Второй закон Фарадея. Определение заряда иона
Вспомним, что масса 
В результате своих опытов Фарадей нашел, что для выделения на электроде одного химического эквивалента ионов любого вида нужно пропустить через электролит одинаковое количество электричества F. Это количество электричества принято называть числом Фарадея или постоянной Фарадея: F = 9,65
Если при электролизе выделилось на электроде m килограммов вещества, а химический эквивалент составляет 



Сравнивая (19.3) и (19.1), получим

Формула (19.4) является математическим выражением второго закона Фарадея: электрохимические эквиваленты различных веществ прямо пропорциональны их химическим эквивалентам. Заметим, что формула (19.3) выражает объединенный закон Фарадея для электролиза.
Выясним теперь, как можно найти заряд одновалентного иона, т. е. заряд электрона е, с помощью законов Фарадея. Если валентность ионов равна единице (n=1), то химический эквивалент 


Подставляя в (19.5) числовые значения F и NA, находим заряд одновалентного иона или заряд электрона:
Это значение заряда электрона хорошо совпадает с результатами опытов Милликена, что подтверждает электронную теорию строения вещества и теорию электролитической диссоциации.
Использование электролиза в технике
Электролиз имеет очень много разнообразных применений в технике. Приведем несколько примеров.
Выше говорилось, что электролиз использую! для очистки металлов, полученных при выплавке из руды, от посторонних примесей. С помощью электролиза получают из расплавленной руды легкие металлы, которые реагируют с водой и из растворов в воде не выделяются. Таким способом получают алюминий, натрий, литий и т. д. Цинк и никель получают электроэкстракцией, т. е. извлекают металл из раствора с помощью электролиза. Атомарный кислород, выделяющийся при электролизе, является очень сильным окислителем. Он используется при изготовлении различных лекарств, например йодоформа.
С помощью электролиза производят покрытие металлических предметов тонким слоем другого металла, не окисляющегося на воздухе, что предохраняет предметы от коррозии. Такой способ покрытия называется гальваностегией. Примерами ее являются никелирование и хромирование. Гальваностегию применяют для изготовления украшений, например при серебрении и золочении.
Получение металлических рельефных копий изображений с помощью электролиза называют гальванопластикой. Она была изобретена в 1837 г. русским ученым Б. С. Якоби. Таким способом изготовляют клише для печатания денежных знаков, матрицы для печатания книг и газет при большом тираже и т. д.
Так как электрическое поле вблизи выступов и заострений сильнее, чем возле других мест металлической поверхности электрода, то при электролизе на поверхности активного анода в первую очередь исчезают выступы, т. е. поверхность анода полируется. Таким способом производится электрополировка поверхностей.
Этими примерами не исчерпывается применение электролиза в современной технике.
Гальванические элементы
Если в раствор, содержащий ионы, опустить металлическую пластину, то между металлом и раствором возникнет разность потенциалов, т. е. металл при этом электризуется. Рассмотрим подробнее, какие процессы произойдут, если в слабый раствор серной кислоты в воде опустить цинковую пластину.
Так как на поверхности пластины находятся положительно заряженные ионы цинка, составляющие его кристаллическую решетку (§ 11.3), то в растворе около пластины оказываются отрицательно заряженные ионы 

Пластина при этом заряжается отрицательно, а раствор — положительно, т. е. между раствором и металлом возникает разность потенциалов.
Поскольку ионы цинка, перешедшие в раствор, одновременно притягиваются и к ионам 
Опыт показал, что» разность потенциалов между раствором и металлом зависит от рода металла и раствора. Это означает, что если в один и тот же раствор опустить пластины из двух различных металлов, то между пластинами должна возникнуть разность потенциалов, которая может создавать электрический ток. В этом случае энергия тока будет получаться за счет химической энергии.
Источники электрической энергии, в которых эта энергия noлучается за счет химической энергии, называются гальваническими элементами. Изобретение первого гальванического элемента в конце XVIII в. итальянским ученым А. Вольта позволило получать в проводниках длительный ток и изучать его законы. Теперь мы знаем, что существенным для превращения химической энергии в электрическую является наличие двух разнородных проводников с электронной проводимостью, опущенных в раствор с ионной проводимостью.
Элемент Вольта (рис. 19.5) состоит из слабого раствора серной кислоты в воде, в который опущены медная и цинковая пластины. Между этими пластиками возникает разность потенциалов, т. е. э. д. с., равная приблизительно 1 В, причем медная пластина является положительным полюсом, а цинковая — отрицательным. Э. д. с. элемента Вольта, как и любого гальванического элемента, не зависит ни от размера пластин, ни от количества раствора и определяется только химическими процессами, происходящими внутри элемента при его работе.
Если присоединить к полюсам элемента внешнюю цепь, то электроны с цинковой пластины, являющейся отрицательным полюсом, устремляются к медной пластине, т. е. к положительному полюсу. Уход электронов с цинковой пластины нарушает равновесие между пластиной и раствором. Ионы цинка из двойного слоя отходят от пластины, а на их место с пластины идут в раствор новые ионы. В свою очередь уменьшение положительного заряда медной пластины позволяет подойти к ней новым ионам водорода. При соприкосновении с пластиной эти ионы получают электроны и превращаются в газообразный водород. Итак, при работе элемента Вольта на его положительном полюсе выделяется водород, а на отрицательном происходит растворение цинка. Газообразный водород покрывает медную пластину и не дает ионам водорода разряжаться. Поэтому у медного электрода скапливаются положительные ионы, которые отталкивают другие ионы водорода и этим ослабляют ток в элементе. Изменение качества поверхности электрода или концентрации ионов около него при прохождении тока через раствор называется поляризацией электрода. Поляризация электродов создает противо-э. д. с. в элементе, ослабляющую ток в нем. Эту противо-э. д. с. иначе называют э. д. с. поляризации.
В элементе Вольта причиной поляризации медного электрода является выделение на нем газообразного водорода. В других гальванических элементах основной причиной поляризации тоже является выделение газов, главным образом водорода. Заметим, что поляризация электродов возникает и при электролизе, кроме тех случаев, когда анод растворяется в электролите.
Чтобы устранить поляризацию гальванического элемента, в него вводят деполяризатор — вещество, которое вступает в соединение с выделяющимися газами. Такие элементы называют неполяризующимися. Они работают достаточно устойчиво и широко распространены на практике. Одним из них является элемент Лекланше (рис. 19.6).
Отрицательным полюсом элемента Лекланше является цинковая пластина, а положительным — графитовый стержень. Электролитом служит раствор нашатыря в воде, а деполяризатором — двуокись марганца МnO2, которая смешивается с графитовым порошком и спрессовывается вокруг графитового стержня. Выделяющийся на положительном полюсе элемента водород вступает в реакцию с МnO2 и окисляется, превращаясь в воду. На отрицательном полюсе должен выделяться хлор, но ионы хлора вступают в реакцию с цинком, образуя хлористый цинк. Э. д. с. элемента Лекланше равна 1,5 В. В сухих элементах в качестве электролита применяется паста из муки и нашатыря.
Аккумуляторы
Поляризация электродов элемента в некоторых случаях может сохраняться в течение длительного времени после прекращения тока в электролите. Это используется при устройстве аккумуляторов. Выясним, как они работают.
Если погрузить свинцовые электроды в ванну с раствором серной кислоты, то они покрываются сернокислым свинцом PbSO4. Так как химические процессы на обеих пластинах одинаковы, то разность потенциалов между ними равна нулю.
Включим ванну в цепь (рис. 19.7, а). В процессе прохождения тока на аноде образуется двуокись свинца РbO2, а на катоде — чистый свинец РЬ. Поскольку пластины стали разнородными, между ними создается разность потенциалов, которая при разомкнутой цепи равна а. д. с. поляризации. Если теперь убрать батарею и вместо нее присоединить лампу накаливания, то при замыкании цепи лампа загорается; следовательно, прибор сам стал источником электрической энергии и э. д. с. поляризации в нем сохранилась (рис. 19.7, б). Через некоторое время, когда обе пластины снова покроются сернокислым свинцом, ток прекратится.
Теперь снова можно присоединить источник электрической энергии и повторить все описанные процессы; это означает, что они обратимы. Итак, наш прибор накапливает энергию, когда через него проходит ток, создаваемый посторонним источником, и отдаёт эту энергию, когда сам создает ток в цепи. Приборы, которые становятся источниками электрической энергии после пропускания через них тока, называют аккумуляторами или вторичными элементами. Пропускание тока через аккумулятор называют его зарядкой, а использование его в качестве источника называют разрядкой.
Аккумуляторы характеризуются к. п. д., емкостью и э. д. с. Коэффициентом полезного действия аккумулятора называют число, показывающее, какую часть энергии, затраченной на его зарядку, он отдает при разрядке:

Емкостью аккумулятора называют максимальное количество электричества, которое может пройти по цепи за все время разрядки аккумулятора. За единицу емкости аккумулятора обычно принимают ампер-час:
Выше был описан кислотный (или свинцовый) аккумулятор. Его э. д. с. составляет около 2 В, а к. п. д.— около 80%.
Применение гальванических элементов и аккумуляторов в технике. Явление электрокоррозии
Ток, получаемый от гальванической батареи, имеет сравнительно небольшую мощность, поэтому в основном он применяется в электротехнике слабых токов, например в телефонии, в телеграфии и т. д. Гальванические элементы и аккумуляторы широко используются в малогабаритных радиоприемниках и телевизорах, в различного рода механических игрушках. Аккумуляторы широко распространены на транспорте. С их помощью приводятся в движение электрокары — тележки для перевоза грузов на вокзалах и в цехах. В автомобилях аккумуляторы используются для запуска двигателя и для освещения на стоянках. Аккумуляторы приводят в действие двигатели подводных лодок.
Широкое применение автотранспорта в современных городах сильно загрязняет воздух, что вредно отражается на здоровье людей. Поэтому ведутся работы по созданию электромобилей, которые в будущем, возможно, заменят автомобили. Современные электромобили работают на аккумуляторах.
Заметим, что большой вред приносят местные гальванические элементы (их называют гальваническими парами), которые самопроизвольно возникают в металлических конструкциях в местах соприкосновения разнородных металлов. Электролитом в местных элементах обычно является вода, в которой практически всегда достаточно много ионов. В сыром воздухе металлические предметы покрываются пленкой воды и местные элементы начинают давать ток, разъедающий металлы. Такие токи называются паразитными гальваническими токами, а производимые ими разрушения называют электрокоррозией.
Услуги по физике:
Лекции по физике:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.