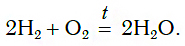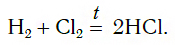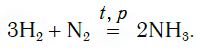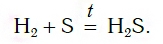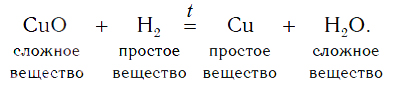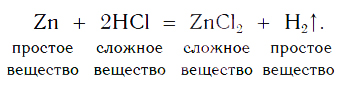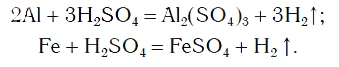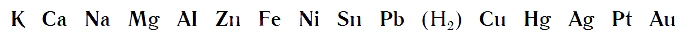Что произойдет если водород вступит в реакцию с растительным маслом
Что произойдет если водород вступит в реакцию с растительным маслом
Ответ:
Химические свойства водорода
1. Взаимодействие с простыми веществами-неметаллами (кроме фосфора, кремния, инертных газов):
А)Водород реагирует с кислородом. При этом образуется вода:
Б)При освещении или нагревании идёт реакция с хлором, и образуется хлороводород:
В)Если водород пропускать над нагретой серой, то образуется сероводород:
Г)В присутствии катализатора при повышенном давлении водород реагирует с азотом с образованием аммиака:
2. Взаимодействие с простыми веществами-металлами.
А)При нагревании водород реагирует со щелочными и щелочноземельными металлами с образованием гидридов
3. Взаимодействие со сложными веществами.
А)Водород способен реагировать с оксидами металлов:
Б)Водород реагирует с угарным газом с образованием метилового спирта:
В)Водород вступает в реакции со многими органическими веществами
А)В лаборатории водород получают действием кислот (соляной или разбавленной серной) на активные металлы (реакцию обычно проводят в аппарате Киппа):
Собирают выделяющийся водород вытеснением воздуха или вытеснением воды
1.Из водорода получают важнейшие химические соединения: аммиак, хлороводород.
2.Реакцию горения водорода применяют для резки и сварки металлов.
3.Водород используется в качестве топлива в ракетных двигателях.
4.Водородом можно восстанавливать металлы из их оксидов.
5.С помощью водорода жидкие жиры превращают в твёрдые (растительное масло — в маргарин).
6.Водород применяется для получения многих органических веществ.
Помогите с тестом 1?
Помогите с тестом 1.
При взаимодействии жира с водным раствором гидроксида натрия одним из продуктов будет : 1) высшая карбоновая кислота 2) глицерин 3) вода 4) водород 2.
Жидкие растительные масла не вступают в реакцию с : 1) водородом 2) раствором перманганата калия 3) глицерином 4) раствором гидроксида натрия 3.
Твердые жиры вступают в реакцию с : 1) бензолом 2) раствором сульфата меди 3) глицерином 4) раствором гидроксида натрия 4.
К реакциям этерификации относится : 1) нитрование бензола 2) омыление жиров 3) нитрование целлюлозы 4) получение диэтилового эфира из этанола 5.
При взаимодействии жира с водным раствором гидроксида натрия получают : 1) соли высших карбоновых кислот 2) высшие карбоновые кислоты 3) воду 4) водород 6.
Олеиновая кислота сочетает в себе свойства карбо¬новой кислоты и : 1) амина 2) спирта 3) альдегида 4) алкена 7.
Для превращения жидких жиров в твердые использу¬ют реакцию : 1) дегидрогенизации 2) гидратации 3) гидрогенизации 4) дегидроциклизации 8.
В результате гидролиза жидкого жира образуются : 1) твердые жиры и глицерин 2) глицерин и предельные кислоты 3) глицерин и непредельные кислоты 4) твердые жиры и смесь кислот 9.
В результате гидрирования жидких жиров образуются : 1) твердые жиры и непредельные кислоты 2) твердые жиры и предельные кислоты 3) твердые жиры и глицерин 4) твердые жиры 10.
В каком веществе жиры не растворяются?
1) в бензоле 2) в воде 3) в бензине 4) в хлороформе 11.
При гидролизе каких веществ в организме образуется глицерин?
1) белков 2) углеводов 3) жиров 4) аминокислот 12.
В состав многих растительных жиров входит линоленовая кислота С17Н29СООН.
Число двойных связей в молекуле этой кислоты равно : 1) одному 2) двум 3) трём 4) двойных связей С = С в данном веществе нет 13.
Для получения мыла используют реакцию : 1) гидрогенизации жиров 2) щелочного гидролиза жиров 3) этерификации карбоновых кислот 4) гидратации алкинов 14.
В организме процесс переваривания жиров начинается с реакции : 1) гидролиза 2) полимеризации 3) гидрирования 4) дегидрирования 15.
Жидкие жиры превращаются в твёрдые реакцией : 1) гидратации 2) гидролиза 3) полимеризации 4) гидрирования.
Урок 22. Химические свойства водорода
В уроке 22 «Химические свойства водорода» из курса «Химия для чайников» узнаем с какими веществами реагирует водород; выясним, какими химическими свойствами обладает водород.
Водород вступает в химические реакции с простыми и сложными веществами. Однако при обычных условиях водород малоактивен. Для его взаимодействия с другими веществами необходимо создать условия: повысить температуру, применить катализатор и др.
Реакции водорода с простыми веществами
При нагревании водород вступает в реакции соединения с простыми веществами — кислородом, хлором, азотом, серой.
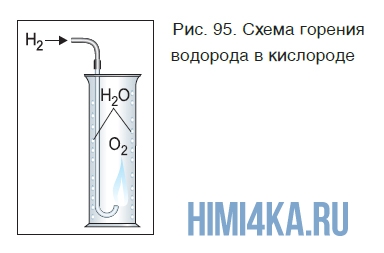
Если поджечь на воздухе чистый водород, выходящий из газоотводной трубки, он горит ровным, еле заметным пламенем. Теперь поместим трубку с горящим водородом в банку с кислородом (рис. 95).
Горение водорода продолжается, при этом на стенках банки видны капли воды, образующейся в результате реакции:
При горении водорода выделяется много теплоты. Температура кислородно-водородного пламени достигает больше 2000 °С.
Химическая реакция водорода с кислородом относится к реакциям соединения. В результате реакции образуется оксид водорода (вода). Это значит, что произошло окисление водорода кислородом, т. е. эту реакцию мы можем назвать и реакцией окисления.
Если же в пробирку, опрокинутую вверх дном, собрать немного водорода методом вытеснения воздуха, а затем поднести к ее отверстию горящую спичку, то раздастся громкий «лающий» звук небольшого взрыва смеси водорода с воздухом. Такую смесь называют «гремучей».
На заметку: Способность водорода в смеси с воздухом образовывать «гремучий газ» часто являлась причиной катастроф на воздушных шарах, заполненных водородом. Нарушение герметичности оболочки шара приводило к пожару и даже взрыву. В наше время воздушные шары заполняют гелием или постоянно нагнетаемым горячим воздухом.
В атмосфере хлора водород сгорает с образованием сложного вещества — хлороводорода. При этом протекает реакция:
Реакция водорода с азотом происходит при повышенной температуре и давлении в присутствии катализатора. В результате реакции образуется аммиак NH3:
Если струю водорода направить на расплавленную в пробирке серу, то у ее отверстия ощутится запах тухлых яиц. Так пахнет газ сероводород H2S — продукт реакции водорода с серой:
На заметку: Водород способен не только растворяться в некоторых металлах, но и реагировать с ними. При этом образуются химические соединения, называемые гидридами (NaH — гидрид натрия). Гидриды некоторых металлов используют как горючее в ракетных двигателях на твердом топливе, а также при получении термоядерной энергии.
Реакции водорода со сложными веществами
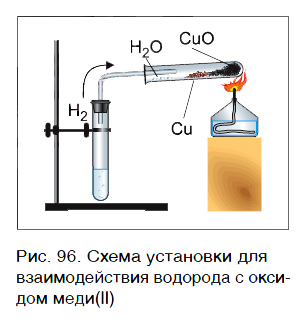
Водород реагирует при повышенной температуре не только с простыми, но и со сложными веществами. Рассмотрим в качестве примера его реакцию с оксидом меди(II) CuO (рис. 96).
Пропустим водород над нагретым порошком оксида меди(II) CuO. По мере протекания реакции цвет порошка изменяется с черного на коричнево красный. Это цвет простого вещества меди Cu. В ходе реакции на холодных частях пробирки появляются капельки жидкости. Это еще один продукт реакции — вода H2O. Отметим, что в отличие от простого вещества меди вода — сложное вещество.
Уравнение реакции оксида меди(II) с водородом:
Водород в реакции с оксидом меди(II) проявляет способность отнимать у оксида металла кислород, тем самым восстанавливать металл из этого оксида. В результате происходит восстановление меди из сложного вещества CuO до металлической меди (Cu).
Реакции восстановления — это реакции, в ходе которых сложные вещества отдают атомы кислорода другим веществам.
Вещество, отнимающее атомы кислорода, называют восстановителем. В реакции с оксидом меди(II) восстановитель — водород. Так же реагирует водород и с оксидами некоторых других металлов, например PbO, HgO, MoO3, WO3 и др. Окисление и восстановление всегда взаимосвязаны между собой. Если одно вещество (Н2) окисляется, то другое (CuO) — восстанавливается, и наоборот.
Краткие выводы урока:
Надеюсь урок 22 «Химические свойства водорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Водород
Степени окисления
Получение
Химические свойства
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых выше, чем у водорода:
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)
Na + H2 → NaH (гидрид натрия)
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
Кристаллогидраты
В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует вычесть кристаллизационную воду и найти массу безводного сульфата калия.
Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
В разбавленных растворах пероксид водорода легко разлагается:
Также перекись проявляет окислительные свойства:
Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки, предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Урок 24. Выделение водорода в реакциях кислот с металлами
В уроке 24 «Выделение водорода в реакциях кислот с металлами» из курса «Химия для чайников» познакомимся с рядом активности металлов, а также больше узнаем о кислотах в химических реакциях.
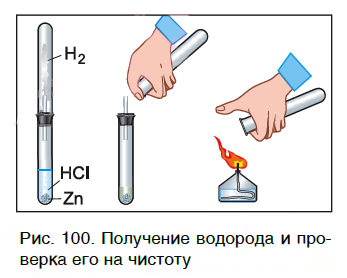
Характерное химическое свойство кислот — выделение из них водорода в реакциях с некоторыми металлами. Атомы металлов замещают атомы водорода в молекулах кислот, в результате чего водород выделяется в виде газа. В пробирку с хлороводородной кислотой опустим кусочек цинка. На поверхности металла образуются, а затем выделяются из раствора пузырьки газа. Соберем этот газ в пробирку и поднесем ее к пламени спиртовки (рис. 100). Мы услышим хлопок. Это свидетельствует о наличии в пробирке водорода.
Каплю образовавшегося раствора поместим на стеклянную пластинку и подогреем ее в пламени спиртовки. После испарения воды на пластинке остается вещество белого цвета. Опытным путем можно установить, что состав этого вещества выражается формулой ZnCl2.
Теперь мы можем записать уравнение реакции цинка с кислотой:
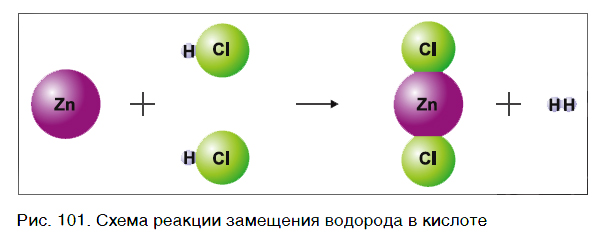
На рисунке 101 дана схема этой реакции. Из уравнения и поясняющей его схемы видим, что атомы цинка замещают атомы водорода в кислоте. В результате из простого вещества цинка и сложного вещества хлороводородной кислоты образуются два новых: сложное вещество ZnCl2 и простое вещество водород Н2.
Так же протекают реакции алюминия, железа, других металлов и с раствором серной кислоты:
Эти химические реакции подтверждают, что кислоты являются сложными веществами, состоящими из атомов водорода,
способных замещаться на атомы металла, и кислотных остатков.
Вытеснительный ряд металлов
При проведении опыта вы убедились, что алюминий энергично вытесняет водород из раствора хлороводородной кислоты. С железом реакция вытеснения водорода протекает менее энергично, а с медью вовсе не идет.
По интенсивности вытеснения водорода из кислот металлы можно разместить в ряд:
Его называют рядом активности или вытеснительным рядом металлов.
Чем левее расположен металл в вытеснительном ряду до водорода (Н2), тем активнее он вытесняет водород из кислот. Металлы, стоящие в ряду правее водорода, из кислот водород не вытесняют.
Зная расположение металлов в вытеснительном ряду, заранее можно предсказать:
Для получения водорода из кислот в лаборатории или школьном кабинете химии необходимо брать металлы, которые в вытеснительном ряду стоят до водорода. Но не каждый металл подходит для этих целей. Активные металлы натрий и калий реагируют с кислотами со взрывом, а реакции кислот с оловом и свинцом протекают медленно. Наиболее подходящими металлами для практического получения водорода являются цинк и алюминий. Как вы убедились, при проведении реакций этих металлов с раствором хлороводородной кислоты они протекают спокойно и достаточно быстро.
Краткие выводы урока:
Надеюсь урок 24 «Выделение водорода в реакциях кислот с металлами» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.