что такое синдром ошибки циклического кода
«Просто как овощ». Почему люди продолжают болеть и через год после ковида
МОСКВА, 29 сен — РИА Новости, Альфия Еникеева. По разным данным, от 20 до 75 процентов переболевших COVID-19 и полгода спустя страдают от его последствий. Среди основных симптомов — хроническая усталость, одышка, выпадение волос, панические атаки, проблемы со сном. Медики называют это постковидным синдромом. В России его диагностируют каждому пятому пациенту. Как эти люди живут и борются с осложнениями — в материале РИА Новости.
«Ничего делать не могла»
Плюс появились проблемы с сосудами на ногах и в глазах. Я даже думала, что у меня разрыв сетчатки на фоне кислородного голодания и повреждения сосудов. Но офтальмолог ничего не нашел, слава богу. Назначил капли, не помогли — глазные яблоки будто болели изнутри. Я консультировалась с разными врачами, никто ничего не мог толком сказать. Прописывали лекарства. От одних становилось только хуже, другие совсем не действовали.
Так как я индивидуальный предприниматель, смогла себе организовать очень лайтовый режим труда. Первые три месяца, до января, не работала вообще. Бизнес просто встал. Никаких доходов — проедала подушку безопасности.
«Пришлось уволиться с работы»
Александр Корчевный, 39 лет, Экибастуз, Казахстан. Сейчас лечится в Новосибирском центре профилактики тромбозов
Я заболел в начале июня 2020 года, заразился, предположительно, на работе. Сдал ПЦР-тест — положительный. Меня отправили на добровольную изоляцию в инфекционную больницу на 18 дней. Как оказалось, зря: родные один за другим заболели ковидом.
В стационаре особо ничем не лечили, только наблюдали, поскольку болезнь протекала не тяжело. Было легкое недомогание около трех дней, потом два дня плохо сбиваемая температура до 38. Пропали запахи, снизился аппетит, появились проблемы со сном. Первый «звонок» был дней через десять после постановки диагноза. Началась неожиданная тахикардия, паническая атака и подскочило давление. Сделали укол эуфиллина. Вроде немного полегчало.
Из больницы выписался не больной и не здоровый. Очень хотелось домой после изоляции. Но дальше было только хуже. Постепенно добавлялись новые симптомы, связанные с нервами и сосудами. Начались бесконечные походы по врачам. Никто из них до конца не понимал, в чем дело и как меня лечить. Все анализы более-менее спокойные. В течение года проходил курсы у пяти невропатологов в разных городах. Все ставили два диагноза: вегето-сосудистая дистония и синдром хронической усталости. Все намекали на психолога. У него я тоже побывал, он нарушений не выявил.
«Волосы лезли клочьями»
Наиля Вагизова, 38 лет, Казань
Когда я выписывалась из больницы, меня никто не предупреждал, что это может затянуться так надолго и восстановление будет столь тяжелым. От государственной медицины сейчас никакой помощи. Врачи в поликлинике ничего не говорят. Я сама сдаю все анализы платно, пью витамины, собираю информацию в интернете, от людей, которые тоже переболели. Я по профессии врач-лаборант, поэтому начала самостоятельно в теме разбираться и контролировать свое состояние.
«Мне легче думать, что это не ковид»
Заболела коронавирусом я в конце прошлой осени, но в декабре был уже хороший анализ. Про постковид меня врач сразу предупредила. Она сама перенесла COVID-19 и знает, что это такое. Сейчас время от времени у меня проявляются какие-то типичные симптомы, но я осознанно списываю их на основное заболевание. Мне так легче.
Я постоянно под медицинским наблюдением. Меня регулярно навещает врач. Мне бесплатно выдают антиагреганты, получаю в аптеке довольно дорогой антикоагулянт. На дом приезжают осматривать узкие специалисты и берут анализы. Но я редко беспокою поликлинику просьбами. Научилась с приступами справляться сама. В целом просто надеюсь, что рано или поздно тело приспособится к чужому вирусу. Если до сих пор выжила с таким списком болезней и даже перенесла ковид, значит, надо благодарить гены и ангела-хранителя.
«Главное — довериться врачам»
Валентина Нелюбова, 59 лет, Москва
Сейчас, слава богу, все позади. Восстанавливалась после ковида несколько месяцев, долго рассказывать. Но все закончилось хорошо. Я очень благодарна врачам филиала дневной больницы Алексеева при поликлинике 121-й, что в Южном Бутово. Они реально помогают справиться с постковидным синдромом, с депрессивным состоянием. Многие боятся психбольниц. Это какое-то неправильное толкование, непонимание. А ведь только квалифицированные психологи могут добраться до проблем постковида и помочь. По крайней мере, мне помогли.
«Это уже самостоятельное заболевание»
По данным исследователей Сеченовского университета, в России от постковидного синдрома страдают больше 20 процентов пациентов, перенесших коронавирусную инфекцию. Среди самых частых жалоб — слабость (точнее, быстрая утомляемость), одышка, тревога, депрессия, проблемы со сном и выпадение волос.
«Постковидный синдром (ПКС) — это симптомокомплекс, который возникает вследствие перенесенной коронавирусной инфекции. Это очень широкое понятие, которое может включать поражение нервной, сердечно-сосудистой систем, органов желудочно-кишечного тракта, мышечную атрофию. Могут быть даже какие-то психические проявления. Его продолжительность — дело сугубо индивидуальное. У кого-то основные симптомы в легкой форме разрешаются в течение двух-трех месяцев. У других сохраняются до года и даже больше. О максимальных сроках говорить рано. Мы пока только наблюдаем это заболевание, изучаем его. По моему опыту — дольше всего у пациентов держатся различные нарушения неврологического характера, поражения периферической нервной системы», — рассказал РИА Новости заведующий кафедрой спортивной медицины и медицинской реабилитации Сеченовского университета, эксперт Лиги здоровья нации профессор Евгений Ачкасов.
По его словам, симптомы ПКС, их выраженность и продолжительность часто зависят от тяжести течения COVID-19, но не всегда. Так, среди пациентов немало людей, которые относительно легко перенесли сам ковид, а от его осложнений мучаются уже более года.
«Основа реабилитационных программ при постковидном синдроме — дыхательная гимнастика, циклические физические упражнения, кардиопротекция. Мы стремимся защитить сердечную мышцу как медикаментозно, так и различными физиотерапевтическими вариантами. Используем массажи, барокамеры. Достаточно широкий спектр. Но надо понимать, что зачастую дома реабилитировать таких пациентов очень сложно. Лучше госпитализировать. Постковидный синдром — это уже самостоятельное заболевание, и к нему надо относиться очень серьезно», — подчеркнул профессор.
Однако если симптомы ПКС ярко выражены, а возможности обратиться к врачу нет, то специалисты советуют заниматься скандинавской ходьбой. Этот вид физической активности хорошо влияет на сердечно-сосудистую и дыхательные системы. А вот надувать шарики для восстановления объема легких ни в коем случае нельзя, чтобы не получить дополнительную легочную травму.
Синдром преждевременного возбуждения (I45.6)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Синдромы предвозбуждения (преждевременного возбуждения) желудочков представляют собой результат врожденных нарушений в проводящей системе сердца, связанных с наличием дополнительных аномальных проводящих путей между миокардом предсердий и желудочков, часто сопровождаются развитием пароксизмальных тахикардий.
В клинической практике наиболее часто встречаются 2 синдрома (феномена) предвозбуждения:
Клиническое значение синдромов предвозбуждения определяется тем, что при их наличии нарушения сердечного ритма (пароксизмальные тахикардии) развиваются часто, протекают тяжело, иногда с угрозой для жизни больных, требуя особых подходов к терапии.
Диагностика синдромов предвозбуждения желудочков основывается на выявлении характерных признаков ЭКГ.
Синдром CLC (Клерка — Леви — Кристеско) обусловлен наличием дополнительного аномального пути проведения электрического импульса (пучка Джеймса) между предсердиями и пучком Гиса.
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Существует два типа синдрома WPW:
Этиология и патогенез
Синдромы предвозбуждения желудочков обусловлены сохранением в результате незавершенной в эмбриогенезе перестройки сердца дополнительных путей проведения импульса.
Наличие дополнительных аномальных проводящих путей при синдроме WPW (пучки, или пути, Кента) является наследственным нарушением. Описана связь синдрома с генетическим дефектом в гене PRKAG2, расположенном на длинном плече 7 хромосомы в локусе q36. Среди кровных родственников больного распространенность аномалии повышена в 4-10 раз.
Синдром WPW нередко (до 30% случаев) сочетается с врожденными пороками сердца и другими сердечными аномалиями такими как аномалия Эбштейна (представляет смещение трикуспидального клапана в сторону правого желудочка с деформацией клапанов; генетический дефект при этом предположительно локализован на длинном плече 11 хромосомы), а также стигмами эмбриогенеза (синдром дисполазии соединительной ткани). Известны семейные случаи, при которых чаще встречаются множественные дополнительные пути и повышен риск внезапной смерти. Возможны сочетания синдрома WPW с генетически детерминированной гипертрофической кардиомиопатией.
Проявлению синдрома WPW способствуют нейроциркуляторная дистония и гипертиреоз. Синдром Вольффа—Паркинсона—Уайта может проявляться также на фоне ИБС, инфаркта миокарда, миокардитах различной этиологии, ревматизме и ревматических пороках сердца.
Синдром СLC также является врожденной аномалией. Изолированное укорочение интервала PQ без пароксизмальных наджелудочковых тахикардий может развиваться при ИБС, гипертиреозе, активном ревматизме и носит доброкачественный характер.
Суть синдрома (феномена) преждевременного возбуждения желудочков состоит в аномальном распространении возбуждения от предсердий к желудочкам по так называемым дополнительным путям проведения, которые в большинстве случаев частично или полностью «шунтируют» АВ-узел.
В результате аномального распространения возбуждения часть миокарда желудочков или весь миокард начинают возбуждаться раньше, чем это наблюдается при обычном распространении возбуждения по АВ-узлу, пучку Гиса и его ветвям.
В настоящее время известны несколько дополнительных (аномальных) путей АВ-проведения:
Наличие дополнительных (аномальных) путей приводит к нарушению последовательности деполяризации желудочков.
Образовавшись в синусовом узле и вызвав деполяризацию предсердий, импульсы возбуждения распространяются к желудочкам одновременно через предсердно-желудочковый узел и добавочный проводящий путь.
В связи с отсутствием физиологической задержки проведения, свойственной АВ-узлу, в волокнах добавочного пути распространившийся по ним импульс достигает желудочков раньше, чем тот, который проводится через АВ-узел. Это обусловливает укорочение интервала PQ и деформацию комплекса QRS.
Однако основное клиническое значение дополнительных путей проведения состоит в том, что они нередко включаются в петлю кругового движения волны возбуждения (re-entry) и способствуют, таким образом, возникновению наджелудочковых пароксизмальных тахикардий.
В настоящее время предлагается преждевременное возбуждение желудочков, не сопровождающееся возникновением пароксизмальной тахикардии, называть “феноменом предвозбуждения”, а случаи, когда имеются не только ЭКГ-признаки предвозбуждения, но и развиваются пароксизмы наджелудочковой тахикардии — “синдромом предвозбуждения”, однако ряд авторов не согласны с таким разделением.
Как уже упоминалось выше, при синдроме WPW аномальный импульс возбуждения распространяется по пучку Кента, который может быть расположен справа или слева от атриовентрикулярного узла и пучка Гиса. В более редких случаях аномальный импульс возбуждения может распространяться через пучок Джеймса (соединяет предсердие с конечной частью АВ узла или с началом пучка Гиса), или пучок Махайма (проходит от начала пучка Гиса к желудочкам). При этом ЭКГ имеет ряд характерных особенностей:
Эпидемиология
Признак распространенности: Крайне редко
Распространённость синдрома WPW составляет по разным данным от 0.15 до 2%, синдром СLC выявляется приблизительно у 0.5% взрослого населения.
Наличие дополнительных путей проведения обнаруживают у 30% пациентов с суправентрикулярной тахикардией.
Чаще синдромы предвозбуждения желудочков встречаются среди мужчин. Синдромы предвозбуждения желудочков могут проявляться в любом возрасте.
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
Клинически синдромы предвозбуждения желудочков не имеют специфических проявлений и сами по себе не оказывают влияния на гемодинамику.
Клинические проявления синдромов предвозбуждения могут наблюдаться в различном возрасте, спонтанно или после какого-либо заболевания; до этого момента пациент может быть асимптоматичен.
Синдром Вольффа-Паркинсона-Уайта часто сопровождается различными нарушениями сердечного ритма:
У больных с синдромом CLC также имеется повышенная склонность к возникновению пароксизмальных тахикардий.
Диагностика
Характерные особенности ЭКГ при синдроме WPW
ЭКГ при синдроме WPW (тип А):
ЭКГ при синдроме WPW (тип Б):
Синдромы CLC и WPW часто являются причиной ложноположительных результатов при проведении нагрузочных проб.
В связи с распространением в последние годы хирургических методов лечения больных с синдромом WPW (деструкция аномального пучка) постоянно совершенствуются способы точного определения его локализации. Наиболее эффективными являются методы внутрисердечного ЭФИ, в частности эндокардиальное (предопреационное) и эпикардиальное (интраоперационное) картирование.
При этом с помощью сложной методики определяют область наиболее ранней активации (предвозбуждения) миокарда желудочков, которая соответствует локализации дополнительного (аномального) пучка.
Электрофизиологическое исследование сердца (ЭФИ) используется у пациентов с синдромом WPW в следующих целях:
— С целью оценки электрофизиологических свойств (способности к проведению и рефрактерные периоды) дополнительных аномальных путей и нормальных проводящих путей.
— С целью определения количества и локализация добавочных путей, что необходимо для проведения дальнейшей высокочастотной аблации.
— С целью выяснения механизма развития сопутствующих аритмий.
— С целью оценки эффективности медикаментозной или аблационной терапии.
В последние годы с целью точного определения локализации аномального пучка применяют методику поверхностного многополюсного ЭКГ-картирования сердца, которая в 70–80% случаев также позволяет ориентировочно определить местоположение пучков Кента. Это существенно сокращает время интраоперационного выявления дополнительных (аномальных) пучков.
Дифференциальный диагноз
Осложнения
Осложнения синдромов предвозбуждения желудочков
К факторам риска внезапной смерти при WPW-синдроме относят:
— Длительность минимального интервала RR при мерцательной аритмии менее 250 мс.
— Длительность эффективного рефрактерного периода дополнительных путей менее 270 мс.
— Левосторонние дополнительные пути или несколько дополнительных путей.
— Наличие симптоматичной тахикардии в анамнезе.
— Наличие аномалии Эбштейна.
— Семейный характер синдрома.
— Рецидивирующее течение синдромов предвозбуждения желудочков.
Лечение
Синдромы предвозбуждения желудочков не требуют лечения при отсутствии пароксизмов. Однако необходимо наблюдение, так как нарушения ритма сердца могут проявиться в любом возрасте.
Купирование пароксизмов ортодромной (с узкими комплексами) реципрокной наджелудочковой тахикардии у больных с синдромом WPW проводят также, как и других наджелудочковах реципрокных тахикардий.
Антидромные (с широкими комплексами) тахикардии купируются аймалином 50 мг (1.0 мл 5% раствора); эффективность аймалина при пароксизмальных наджелудочковых тахикардиях неуточненной этиологии заставляет с большой вероятностью подозревать WPW. Может быть эффективно также введение амиодарона 300 мг, ритмилена 100 мг, новокаинамида 1000 мг.
В случаях, когда пароксизм протекает без выраженных расстройств гемодинамики и не требует экстренного купирования, вне зависимости от ширины комплексов при синдромах предвозбуждения особо показан амидарон.
Препараты IC класса, «чистые» антиаритмики III класса при WPW-тахикардиях не используются в связи с высокой опасностью свойственного им проаритмического эффекта. АТФ может успешно купировать тахикардию, но должен применяться с осторожностью, так как может спровоцировать мерцательную аритмию с высокой ЧСС. Верапамил также следует использовать с особой осторожностью (опасность нарастания ЧСС и трансформации аритмии в мерцание предсердий!) – только у пациентов с успешным опытом его применения в анамнезе.
Мерцание предсердий при участии дополнительных путей проведения представляет реальную опасность для жизни вследствие вероятности резкого учащения сокращений желудочков и развития внезапной смерти. Для купирования фибрилляции предсердий в данной экстремальной ситуации используют амиодарон (300 мг), прокаинамид (1000 мг), аймалин (50 мг) или ритмилен (150 мг). Нередко фибрилляции предсердий с высокой ЧСС сопровождается выраженными нарушениями гемодинамики, что обусловливает необходимость в неотложной электрической кардиоверсии.
Радиочастотная катетерная абляция добавочных путей является в настоящее время основным методом радикального лечения синдрома преждевременного возбуждения желудочков. Перед выполнением абляции проводятэлектрофизиологическое исследование (ЭФИ) для точного определения места нахождения добавочного пути. При этом следует иметь в виду, что таких путей может быть несколько.
Успех лечения, даже при наличии нескольких добавочных путей, достигается примерно в 95 % случаев, а частота осложнений и летальность составляют менее 1 %. Одним из наиболее тяжелых осложнений является возникновение предсердно-желудочковой блокады высокой степени при попытке абляции добавочного пути, расположенного вблизи предсердно-желудочкового узла и пучка Гиса. Риск рецидивов не превышает 5—8 %. Необходимо отметить большую экономичность катетерной абляции по сравнению с длительной медикаментозной профилактикой и операцией на открытом сердце.
Показания к проведению высокочастотной аблации:
Современные представления о периодической болезни и клинические рекомендации по диагностике и лечению
В статье представлены современные сведения о патогенезе, клинических проявлениях, диагностике и лечении периодической болезни. Обсуждаются клинические и лабораторные методы оценки активности заболевания и подходы к лечению больных, резистентных к колхицину, на основе подавления эффектов интерлейкина-1.
Периодическая болезнь (ПБ), более известная в англоязычной литературе под названием Средиземноморская лихорадка, является древнейшим заболеванием. Первые наблюдения ПБ были описаны еще на закате средневековья. Так, H. Reimann указывает, что в 1629 г. Aubrey сообщил о своем страдании, которое проявлялось ознобом, тошнотой, рвотой, болями в животе, длящимися до полусуток и возникающими сначала каждые 2 недели, позже ежемесячно, один раз в 3 месяца, один раз в полгода [1].
Как самостоятельная нозологическая единица ПБ была выделена только в середине ХХ столетия. В 1948 г. H. Reimann на основании 6 наблюдений объединил общим термином “периодическая болезнь” ряд синдромов, включающих периодическую лихорадку, доброкачественный пароксизмальный перитонит, циклическую нейтропению и перемежающуюся артралгию [2]. Основными критериями считали периодичность и доброкачественность течения. По этой причине понятие “периодическая болезнь” стало очень широким. Благодаря работам E. S):1–112. ohar и соавт. (1967) [3], а в нашей стране – О.М. Виноградовой (1964, 1973) [4], В.А. Аствацатрян и соавт. [5] клиническая картина ПБ была очерчена более отчетливо. После открытия гена MEFV, мутации которого приводят к развитию клинических проявлений ПБ, были сформулированы окончательные критерии ПБ.
Тем не менее, сохраняет актуальность выделение особого обобщающего термина для всех периодических синдромов, клинические проявления и принципы диагностики которых сходны. Учитывая их наследственный характер, широко применяется термин семейные периодические лихорадки, которые, помимо ПБ, включают в себя криопиринопатии (семейная холодовая крапивница, синдром Макла-Уэллса, NOMID-CINCA синдром), гипериммуноглобулинемию D (дефицит мевалонаткиназы), TRAPS):1–112. (синдром, обусловленный мутацией гена рецептора к фактору некроза опухоли [ФНО]-α) и некоторые другие. Все эти заболевания характеризуются беспричинно повторяющимися приступами лихорадки в сочетании с воспалением кожи, серозных оболочек и суставов [4]. В основе патогенеза ведущую роль играют генетически детерминированные нарушения врожденного иммунитета, а механизмы специфического иммунитета – гуморального, связанного с синтезом аутоантител, и Т-клеточного, не имеют значения [5].
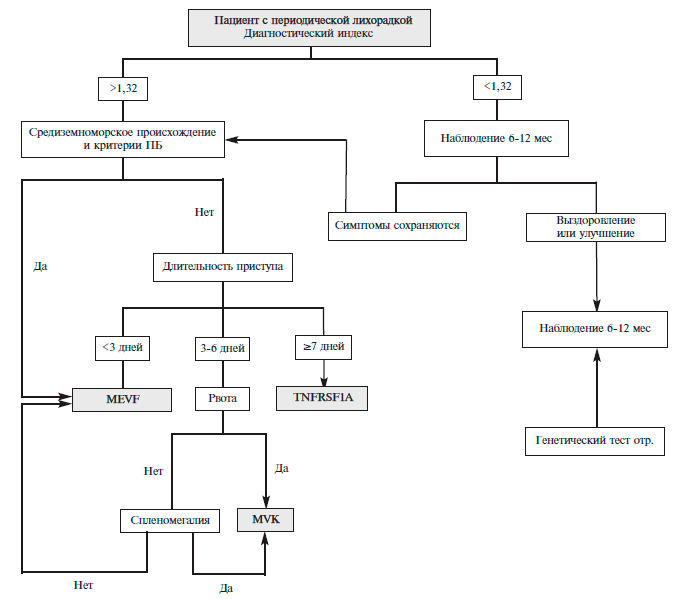
Клиническое предположение о наличии этих синдромов может возникать преимущественно у молодых пациентов с приступами болей в животе, грудной клетке в сочетании с афтозным стоматитом, диареей при наличии подобных признаков у родственников (табл. 1) [8]. Для оценки риска семейных периодических лихорадок предложен специальный индекс [9], автоматизированный расчет которого, предлагается на сайте Eurofever Project (https://www.printo.it/eurofever/index. asp). Паци ен там с высоким риском следует проводить генетическое тестирование для исключения семейных периодических лихорадок. У выходцев из Средиземно морья и Кавказа с непродолжительными приступами (менее 3 дней) в первую очередь следует исключать ПБ, у остальных пациентов с длительностью приступов до недели и эпизодами рвоты следует думать о дефиците мавалонаткиназы с развитием гипериммуноглобулинемии D, приступы длительностью более недели являются основанием для исключения TRAPS):1–112. (рис. 1). У пациентов с низким риском предлагается наблюдение за течением болезни с последующим повторным обсуждением показаний к генетическому исследованию на семейные периодические лихорадки.
Эпидемиология периодической болезни
Одним из признаков наследственной природы ПБ является этноассоциированный характер болезни – ее широкое распространение у народов, проживающих в бассейне Средиземного моря – армян, евреев-сефардов и, реже, арабов, турков, была показана разными авторами на больших группах больных. По данным О.М. Ви но градовой лица других национальностей среди больных ПБ встречались лишь в 2% случаев [4]. Среди 86 носителей гена ПБ, наблюдавшихся J. S):1–112. amuels и соавт. [10], необычно высоким было число итальянцев и евреев-ашкенази. Однако и в этой группе 96% пациентов оказались представителями средиземноморской популяции. В группе из 150 больных ПБ, обследованных О.М. Виноградовой [4], 88,6% составили армяне. В последние годы эту болезнь на территории России широко диагностируют у азербайджанцев, представителей разных народов Северного Кавказа, имеются также отдельные наблюдения ПБ среди русских и украинцев, преимущественно жителей южных регионов России. Болезнь наследуется по аутосомно-рецессивному пути. Это означает, что у родителей симптомы заболевания обычно отсутствуют, однако в больших семьях болезнь может проявиться у родных или двоюродных братьев/ сестер, дяди или дальнего родственника.
Ген, ответственный за ПБ, был клонирован в 1997 году и обозначен аббревиатурой MEFV (MEditerranean FEver) [11,12], в том же году были идентифицированы 8 основных мутаций гена. Ген MEFV располагается на коротком плече 16 хромосомы центромерно к гену гемоглобина- α, рядом с генами, ответственными за аутосомно-доминантный поликистоз почек и туберозный склероз 13. Показано, что среди евреев-сефардов, выходцев из Испании, частота носительства MEFV составляет от 1:16 до 1:8 (при распространенности ПБ в этой популяции от 1:250 до 1:1000) [15]. Частота носительства среди евреев-ашкенази Южной Европы почти на 2 порядка ниже – 1:135 (при распространенности ПБ 1:73000). Частота носительства среди американских армян составляет 1:7 [16].
Причина сохранения в современной средиземноморской популяции высокой частоты носительства MEFV остается неясной, однако сочетание ее с многочисленностью аллелей MEFV может свидетельствовать в пользу благоприятных условий для естественного отбора гетерозигот-носителей этих аллелей, по аналогии с распространенностью гена серповидноклеточной анемии в эндемичных очагах малярии.
Клиническая картина и диагноз
Продуктом MEFV является белок пирин, или маренострин (от латинского Mare Nostrum – Средиземное море) [11,12]. Одним из отличительных свойств пирина является наличие В30.2-домена. Кроме того, в молекуле пирина обнаружены 2 локуса потенциального связывания с ядром, а α-спиральный и В-box-домены могут обеспечивать взаимодействие с другими белками. Все выявленные в настоящее время мутации, ассоциирующиеся с ПБ, касаются изменений в В30.2-зоне пирина.
Экспрессия MEFV происходит почти исключительно в гранулоцитах и не наблюдается в лимфоцитах и моноцитах [11]. Не обнаруживают экспрессию гена и в других тканях. Согласно основной в настоящее время рабочей гипотезе пирин является базовым регулятором воспалительного ответа нейтрофилов. Соответ ственно, структурные изменения в молекуле пирина могут изменить функцию контроля и способствовать постоянному провоспалительному потенциалу нейтрофилов.
Немутантный пирин ингибирует адапторный белок AS):1–112. C, который кроме участия в апоптозе формирует ядро инфламмасомного комплекса путем гомотипического взаимодействия с белком NLRP и каспазой, что ведет к активации интерлейкина (ИЛ)-1 β. Инфламма сома – макромолекулярная платформа в цитоплазме, устойчивая к внутриклеточным механизмам деградации белков и, в силу этого, способная обеспечить реализацию провоспалительной активности клетки. Суще ствует несколько разновидностей инфламмасом. При ПБ и других семейных периодических лихорадках основное значение придают инфламмасоме на основе белка NLRP3 – криопирина. В качестве основной причины развития ПБ рассматривают утрату ингибиторного эффекта мутантного пирина на AS):1–112. C и, как следствие, активацию каспазы-1 [17], либо формирование пирином собственной инфламмасомы [18]. Однако роль мутаций домена B30.2 в развитии ПБ остается спорной; возможно, пирин может проявлять как про-,так и противовоспалительные свойства в зависимости от конкретных условий. Значение мутантного пирина в усилении секреции ИЛ-1 β при ПБ подтверждается купированием приступа ПБ при парентеральном введении ингибиторов ИЛ-1 [19].
Таким образом, в настоящее время несомненным диагностическим критерием ПБ является выявление гомозиготного носительства мутаций пирина. Однако у 20% больных клинические признаки ПБ развиваются при наличии только одной мутации. У таких пациентов сохраняют диагностическое значение клинические критерии болезни, в частности эффективность колхицина. Окончательный диагноз в этом случае может быть установлен только через 6-12 месяцев наблюдения за эффектом колхицина.
Важное значение имеет осмотр пациента во время периодических приступов заболевания, которые проявляются лихорадкой в сочетании с абдоминалгиями, торакалгиями, артралгиями и другими, более редкими, проявлениями. Указанные проявления могут возникать в различных сочетаниях или с разной периодичностью, обычно выделяют абдоминальный, торакальный, лихорадочный, реже суставной варианты ПБ.
Болезнь возникает преимущественно в детском или юношеском возрасте, чаще у мужчин, и характеризуется хроническим течением с обострениями и ремиссиями, возникающими от разнообразных причин и через различные сроки. Между приступами болезненные проявления отсутствуют, а во время приступа болезни многие пациенты сохраняют работоспособность. Приступы продолжаются от 12 ч до 3 суток, а затем самостоятельно разрешаются. Продолжительность межприступного периода у одного и того же пациента составляет от нескольких дней до нескольких месяцев, иногда приступы следуют один за другим с промежутками в 1-3 дня, но возможны и длительные ремиссии до нескольких лет. Характерный признак болезни, имеющий диагностическое значение, – стереотипность приступов. Пациенту, как правило, без труда удается отличить боль и лихорадку, вызванные приступом болезни, от подобных симптомов другого генеза.
Лихорадка, которая у нелеченных больных, как правило, достигает высоких значений и сопровождается потрясающими ознобами, является практически постоянным симптомом приступа. Выделение особой лихорадочной формы болезни обосновывается тем, что другие симптомы, включая абдоминалгии, встречаются реже. Однако В.М. Арутюнян и соавт. полагают, что острый асептический серозит, хотя бы и кратковременный, является облигатным проявлением болезни, в связи с чем нецелесообразно расширять классификацию болезни за счет лихорадочной и суставной форм, а достаточно ограничиться тремя формами – абдоминальной, торакальной и смешанной [20].
Абдоминальный вариант наблюдается у 91% больных [11,12]. В основе абдоминального варианта ПБ лежит рецидивирующее доброкачественное воспаление серозной оболочки брюшной полости с преобладанием экссудативной реакции над пролиферативной, что подтверждается малым количеством спаек, несмотря на частоту приступов. В воспалительный процесс вовлекаются брыжейка, серозная оболочка кишки, печени, селезенки, диафрагмы. Абдоминалгии обычно сопровождаются симптомами раздражения брюшины и вялой перистальтикой, что наряду с лихорадкой и лейкоцитозом периферической крови создает существенные дифференциально-диагностические сложности и ведет к необоснованной лапаротомии.
Торакальный вариант, в основе которого лежит асептический плеврит, наблюдается у 57% пациентов [11, 12]. При рентгеноскопии грудной клетки во время приступа отмечают ограничение подвижности купола диафрагмы, небольшой выпот в синусе над диафрагмой, реже дисковидные ателектазы, все эти явления затем полностью исчезают, но у трети больных возникают спайки.
Артрит и артралгии развиваются у 45% больных [11,12], очень редко как единственное проявление болезни. Суставные проявления имеют характер летучих артралгий, моноартрита, реже полиартрита, чаще вовлекаются коленные и голеностопные суставы. По окончании приступа эти явления полностью исчезают, не оставляя пролиферативных изменений. Ревматоид ный фактор, антистрептококковые антитела не определяются.
Редко (13%) встречается рожеподобная эритема в виде болезненных плотноватых пятен диаметром 10-15 см обычно в области голеностопных суставов [11,12].
Самым тяжелым осложнением является АА-амилоидоз, строящийся из циркулирующего белка-предшественника S):1–112. AA, близкого С-реактивному белку. Частота амилоидоза значительно отличается по данным разных авторов. О.М. Виноградова на примере популяции бывшего СССР указывает частоту амилоидоза 41,3%. Аме риканские авторы, обследовавшие популяцию армян, проживающих в США, сообщают о низкой частоте амилоидоза – 2% [8,21]. В любом случае, прогноз болезни определяется наличием и тяжестью амилоидоза. Клинические проявления амилоидоза характерны для АА-типа, при котором основным органом-мишенью являются почки. В течении амилоидной нефропатии обычно удается выделить три стадии – протеинурическую, нефротическую и стадию почечной недостаточности. Особенностью амилоидоза является сохранение высокой протеинурии на стадии хронической почечной недостаточности [22]. Нелеченный ААамилоидоз в рамках ПБ обычно прогрессирует быстрее, чем при других воспалительных заболеваниях: 5- и 10летняя выживаемость составляет соответственно 48% и 24%, соответственно, а при вторичном АА-амилоидозе другой этиологии – 77% и 44% [23].
Широко распространено мнение о наследственном характере амилоидоза при ПБ. Так, у больных ПБ с отягощенным по амилоидозу семейным анамнезом риск амилоидоза увеличивается в 6 раз [24]. Описан так называемый фенотип II ПБ (некоторые исследователи ставят под сомнение наличие фенотипа II, учитывая его исключительную редкость [25]), при котором клинически выраженных приступов не бывает, однако развивается АА-амилоидоз. При этом у родственников нередко регистрируется клиника несомненной ПБ.
Благодаря обнаружению в последние годы гена ПБ и его продукта – белка пирина показаны различные механизмы наследования ПБ и АА-амилоидоза. Пирин непосредственно не участвует в метаболизме S):1–112. AA, а гены обоих белков располагаются в разных хромосомах (гены S):1–112. AA обнаружены в 11 хромосоме). Таким образом, ПБ в настоящее время, подобно другим хроническим воспалительным процессам, рассматривают в качестве пускового фактора вторичного АА-амилоидоза.
У больных ПБ описаны единичные наблюдения асептического менингита, перикардита, миалгий, узелкового полиартериита, гломерулонефрита, пурпуры Шенлейн-Геноха, клиническое значение которых не вполне ясно [4]. Спленомегалия, как правило, сопутствует амилоидозу [4].
Оценка активности аутовоспалительных заболеваний
Первая попытка создания критериев активности аутовоспалительных заболеваний была предпринята группой ученых из Клиники Шиба (Израиль) в отношении ПБ [26]. В разработанной ими шкале учитываются возраст на момент начала заболевания, частота приступов, наличие артритов, рожеподобной эритемы и доза колхицина, необходимая для достижения ремиссии болезни. В 2005 г. ученые из той же клиники провели дополнительное исследование, в котором показали недостаточность этой шкалы для корректной оценки активности болезни [27]. С использованием статистических методов были разработаны новые критерии тяжести ПБ (модифицированные критерии Тель Хашомер), которые отличаются для больных, принимающих и не принимающих колхицин [27].
Эксперты рабочих групп EUROFEVER и EUROTRAPS):1–112. попытались разработать единые критерии активности семейных периодических лихорадок с использованием дельфийского метода и метода номинальных групп [28]. Для каждого заболевания были выделены симптомы, которые, по мнению экспертов и опрошенных больных, свидетельствуют о его высокой активности. В опроснике для больных содержатся ежедневные сведения о наличии и выраженности симптомов в баллах. По завершении месяца сумма баллов делится на количество дней в месяце (30 или 31): максимальной активности соответствует 13 баллов для криопиринопатий и 16 баллов для ПБ, HIDS):1–112. и TRAPS):1–112.
Традиционными методами подтверждения воспалительной природы заболевания и оценки его активности являются подсчет лейкоцитов крови и измерение показателей острофазового воспаления – СОЭ, уровня С-реактивного белка (СРБ), фибриногена и других.
Нередко при аутовоспалительных заболеваниях развивается анемия, как правило, нормохромная нормоцитарная, которая является следствием хронического воспаления (анемия хронических заболеваний). Веду щую роль в ее патогенезе играют провоспалительные цитокины – ФНО-α, ИЛ-1β, ИЛ-6 и интерферон-g [30,31]. Так, ФНО-α снижает эритропоэз за счет непосредственного блокирующего действия на рост эритроидных клеток-предшественниц и активации их апоптоза в костном мозге [32–34]. ИЛ-6 также подавляет костномозговую пролиферацию эритроидных клеток-предшественниц, снижает синтез эритропоэтина, через стимуляцию печеночной продукции гепсидина блокирует макрофагальное депо железа и его абсорбцию энтероцитами [35].
В последнее время исследователи стали уделять внимание новому показателю активности воспаления – отношению нейтрофилы/лимфоциты – ОНЛ (в норме оно равно 0,78-3,53 с медианой 1,65) [36]. Это надежный маркер, который может быть легко определен по результату клинического анализа крови. В настоящее время показана способность этого показателя отражать активность воспаления при ПБ. А. Ahsen и соавт. определяли ОНЛ и концентрацию СРБ у 62 больных ПБ в стадии ремиссии и 41 здорового человека [37]. Как ОНЛ, так и концентрация СРБ у больных с ремиссией ПБ были выше, чем у здоровых людей. Отмечена умеренная корреляция между этими параметрами (r=0,449, p
Лечение периодической болезни
Несмотря на наследственный характер ПБ в настоящее время существуют эффективные методы ее лечения. С 1970 г. в практику вошел колхицин, который позволил не только предупреждать приступы болезни, но также проводить лечение и профилактику амилоидоза, что существенно улучшило прогноз больных. Механизм противовоспалительного действия колхицина может быть связан с торможением дегрануляции полиморфноядерных лейкоцитов, способностью уменьшать продукцию ИЛ-1, снижать проницаемость сосудистой стенки. Известный цитостатический эффект колхицина в применяемых дозах, по-видимому, незначителен. Ежедневный прием 1-2 мг колхицина позволяет прово дить надежную профилактику приступов ПБ и амилоидоза. Терапевтическая доза при уже развившемся амилоидозе составляет 2 мг/сут. По данным клиники им. Е.М. Тареева колхицин эффективен даже у большинства больных с нефротическим синдромом, однако эффект наступает не сразу, спустя 2-4 года постоянного приема колхицина. Эффективность препарата при амилоидозе почек резко снижается на стадии почечной недостаточности, свидетельствующей о тяжести склеротических изменений.
Указанные дозы обычно хорошо переносятся, в том числе при многолетнем приеме. Нередко развивающаяся в начале лечения диарея носит преходящий характер и, как правило, не требует полной отмены препарата.
Приблизительно у 15-20% больных колхицин оказывается изначально неэффективным. Представление о ПБ как о внешней инфламмасомопатии позволило рекомендовать назначение ингибиторов ИЛ-1 пациентам, резистентным к лечению колхицином. В Рос сийской Федерации зарегистрирован канакинумаб (Иларис®) – человеческие моноклональные IgG1 антитела к ИЛ-1, которые связываются с цитокином и блокируют его взаимодействие с рецепторами. Канакинумаб обладает длительным периодом полувыведения (21-28 дней), что позволяет вводить его подкожно каждые 8 недель. Рекомендуемая стартовая доза у взрослых составляет 150 мг один раз в 4 недели, при необходимости ее можно увеличить до 300 мг.
Эффективность и безопасность канакинумаба изучались у больных с различными аутовоспалитель ными заболеваниями. В двойном слепом, плацебоконтролируемом, рандомизированном исследовании, состоявшем из 3 час тей, 35 пациентов с криопиринассоциированным периодическим синдромом (КАПС; синдром Макла-Уэллса у 33 и синдром NOMID/CINCA у 2) получали канакинумаб в течение 48 недель [52]. Во время части 1 всем пациентам вводили канакинумаб в дозе 150 мг подкожно. Если в течение 15 дней после введения препарата наблюдался полный ответ (отсутствие активности или минимальная активность по оценке исследователя и концентрации СРБ и S):1–112. AA ТАБЛИЦА 1. Эффективность канакинумаба в исследовании CLUSTER
Заключени
Представленная нами проблема ПБ демонстрирует достижения молекулярно-биологических исследований в современной практической медицине, показывает возможности диагностики и лечения на основе знаний о молекулярных механизмах ПБ. Последнее особенно важно с практических позиций, поскольку возможность выделения аутовоспалительных реакций с центральной ролью нейтрофила среди патофизиологических механизмов позволяет определить критерии индивидуального подхода к лечению с выбором патогенетически обоснованного средства подавления активности ПБ. Главным препятствием в диагностике и лечении больных ПБ остается низкая информированность врачей об этом заболевании, хотя в этнических группах высокого риска заболевание встречается с частотой 1-3 на 1000.

