Как восстанавливается печень после операций
Лечение метастазов в печени
Егиев Валерий Николаевич
Метастазы в печени — это вторичное онкологическое поражение, которое возникает при опухолях в других органах. Чаще всего к ним приводит рак органов брюшной полости, в первую очередь кишечника и желудка, но также нередко их провоцируют злокачественные образования в другой локализации. Дело в том, что печень служит внутренним фильтром. Вместе с кровью и лимфой опухолевые клетки попадают в орган и разрастаются. По статистике метастазы в печени обнаруживаются у каждого третьего больного раком.
Виды метастазов в печени
В зависимости от количества поражений метастазы подразделяют на:
В зависимости от локализации очаги поражения могут быть:
Все эти факторы обязательно учитываются, когда принимается решение об операции.
Чем опасны метастазы в печени?
Метастазы нарушают нормальное функционирование органа. Многие витамины и минералы перестают усваиваться из-за недостатка ферментов, хуже переваривается пища. Печень не справляется с задачей по фильтрации крови. Кроме того, при крупных поражениях могут пережиматься воротная вена и желчные протоки. В результате возникают симптомы механической желтухи, которые являются противопоказанием для большинства методов лечения рака. Такое состояние может вызвать сильное отравление, опасное для головного мозга. Поэтому метастазы в печени необходимо лечить сразу, как только они были диагностированы.
Хирургическое лечение метастазов в печени
Хирургический метод лечения в комбинации с современной химио-, таргетной и иммунотерапии применяется у 50-80% пациентов, особенно при метастазах рака кишки. В комплексе с химиотерапией это позволяет значительно увеличить продолжительность жизни. Ткань печени имеет высокую способностью к восстановлению, поэтому допускается удаление даже 60-70% пораженного органа.
Резекция лапароскопическим методом
Выполняется при небольших единичных метастазах. Через небольшие проколы в брюшной стенке удаляется пораженная ткань печени. Данную операцию я провожу с использованием самого современного эндоскопического оборудования. При такой низкотравматичной методике здоровые ткани практически не повреждаются, а пациенты быстрее восстанавливаются. Однако данная операция проводится редко. Метастазы часто диагностируются, когда уже достигли крупных размеров.
Резекция печени открытым путем
Данная методика используется, когда из-за больших размеров метастазов удалить их через лапароскопический доступ не представляется возможным. Операция проводится через разрез на передней брюшной стенке. Крупные сосуды и желчные протоки перевязываются, затем удаляется пораженная часть тканей печени. Такая резекция требует от хирурга высокой квалификации, чтобы максимально сохранить объем здоровой ткани, а также не повредить желчные пути.
Виды операций по частичной резекции печени
Резекции можно разделить на две группы: анатомические и атипичные. К первым относятся хирургические вмешательства с учетом долевого и сегментарного строения печени. А именно:
Атипичные же резекции проводятся, ориентируясь на расположение кровеносных, венозных сосудов, и желчных протоков.
Я провожу все виды операций и владею современными лапароскопическими методиками. Основываясь на 40-летнем практическом опыте, принимаю решение о целесообразности операции и выбираю наиболее эффективную методику в зависимости от тяжести каждого конкретного клинического случая.
Для меня не существует безнадежных пациентов. Моя многолетняя практика доказывает, что даже в самых сложных случаях необходимо продолжать бороться. Облегчение течения болезни и улучшение качества жизни пациентов — реальные достижимые цели, которые я ставлю в своей работе.
«Резервный» механизм восстановления печени
«Резервный» механизм восстановления печени
Слева — ладонь здорового человека; справа — ладонь человека, больного желтухой.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Быстрая утомляемость, потеря аппетита, тошнота, пожелтение кожных покровов и даже частые головные боли — все эти симптомы могут быть косвенными свидетельствами патологий печени. Несмотря на высокую способность клеток печени к восстановлению, в некоторых тяжелых случаях они просто не справляются с болезнью. Новое исследование команды ученых из Центра регенеративной медицины в Эдинбурге, Массачусетского технологического института и Сколковского института науки и технологий показывает, как с помощью блокирования основного пути восстановления клеток печени удалось открыть резервных «ремонтников».
Конкурс «био/мол/текст»-2017

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Открытие, предсказанное мифами: регенерация у рептилий
Способность организмов к регенерации, то есть восстановлению структуры и функций органов, является одной из важных загадок медицины, которую человек давно пытается разгадать. Наблюдения за животным миром позволили сформулировать следующую закономерность: чем проще устроено животное, тем легче ему восстановить утраченные органы. И если дождевой червь способен «достроить» половину собственного тела, а ящерица — отрастить новый хвост, то у человека способности к регенерации представлены в более узком диапазоне [1], [2].
Сказочных существ, способных отрастить себе новую голову или хвост, довольно много. Но и Лернейская гидра (рис. 1), и горгона Медуза, и даже Змей Горыныч имеют вполне реального «родственника» — тритона. Этот представитель хвостатых амфибий считается одним из древнейших видов фауны на Земле. Тритоны успешно восстанавливают не только хвост и лапы, но даже поврежденные сердце и спинной мозг. Однако амфибии — далеко не единственные существа, которым доступна функция «саморемонта». Например, рыбок данио рерио используют не только в аквариумистике, но и для изучения регенерации тканей сердца. А первым животным, благодаря которому появился термин «регенерация», стал речной рак. Изучением восстановления утраченных ног у раков занимался французский ученый Рене Реомюр, предложивший новый термин еще в 1712 году.
Рисунок 1. «Сражение Геракла с Лернейской гидрой» Антонио дель Поллайоло (1475 г.).
Неудивительно, что ученым хочется понять, почему ящерица, например, может восстановить утерянный хвост, а человек отрастить новую руку не может. Изучение структуры и состава тканей сразу после потери ящерицей хвоста позволило обнаружить модель регенерации у рептилий. В период заживления базальные клетки эпидермиса активно делятся, постепенно «закрывая» собой рану. Дополнительная агрегация делящихся клеток на дистальном конце позвоночника способствует разрастанию бластемы — скоплению неспециализированных клеток. В этот момент запускаются процессы образования новых кровеносных сосудов, а следом — и новых периферических аксонов. Наиболее поздно в дело вступают новообразования костной ткани и мышц. Однако точный механизм регенерации хвоста у ящериц не изучен до конца. Недавнее исследование Университета штата Аризона и Института геномных исследований позволило обнаружить молекулы микро-РНК, способствующие регенерации мышц, хрящей и позвоночника [3]. Возможно, эта работа позволит разработать методы лечения, основанные на управлении экспрессией генов с помощью микро-РНК.
Открытие, сделанное случайно: регенерация у мышей
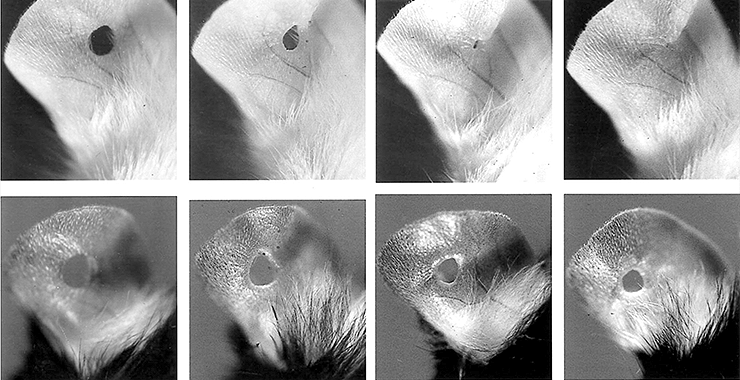
Но как обстоят дела с возможностями регенерации на уровне целых органов у более высокоорганизованных, чем ящерицы, организмов? Еще недавно ученые были уверены, что млекопитающие не способны восстанавливать утраченные органы. Но это убеждение пошатнуло открытие, сделанное в лаборатории иммунолога Эллен Хебер-Кац из исследовательского центра в Филадельфии. Там проводили различные эксперименты на особых «пациентах» — генетически модифицированных мышах линии Murphy Roth Large (MRL). Такие особи отличались от обычных тем, что у них не работали Т-клетки иммунной системы. Однажды доктор Хебер-Кац дала своему лаборанту несложное задание: пометить выбранных для очередного эксперимента мышей, сделав у них небольшие двухмиллиметровые отверстия в ушах. Через несколько недель выяснилось, что дырочек в ушах подопытных нет. Структура кровеносных сосудов, хрящей, тканей выглядела неповрежденной. Однако лаборант заверил доктора, что задача по «мечению» мышей была своевременно выполнена. После повторения эксперимента с ушной раковиной эффект был таким же: уже через четыре недели на «проколотых» участках ушей образовалась бластема (рис. 2) [4]. Следующим «опытным» объектом стал хвост — и вновь удалось продемонстрировать частичную регенерацию тканей. Однако восстановительные способности MRL мышей не безграничны: например, вырастить новую лапку такая мышь, увы, не смогла. Причина заключается в различном расположении и количестве кровеносных сосудов в органах и тканях животного. Без прижигания мышь просто погибнет от большой потери крови — задолго до запуска регенерационных процессов. А прижигание на месте ампутированной конечности исключает появление бластемы.
Рисунок 2. Этапы восстановления ткани уха у обычной лабораторной мыши (снизу) и трансформированной линии MRL (сверху).
В результате серии наблюдений за трансгенными мышами удалось показать, что секрет их успеха — в определенном белке. Так, у мышей линии MRL заблокирована экспрессия гена, кодирующего белок р21 (ингибитор циклинзависимой киназы 1А), который регулирует процесс нормального деления клеток. Подавление активности этого гена у нормальных мышей показывает аналогичную способность к регенерации повреждений [5]. Но проводить подобные манипуляции следует с большой аккуратностью: «отключение» гена р21 может привести к нарушению нормального размножения клеток, что способно привести к катастрофическому делению всех клеток тела.
Повседневная реальность: возможности регенерации у человека
А как обстоят дела с регенерацией у людей? Даже без «выключения» гена, кодирующего белок р21, организм человека может восстанавливать некоторые органы. Например, кожу, чья регенерирующая способность привычна для нас так же, как и воздух. Самый большой по площади орган нашего тела постоянно обновляет собственную структуру за счет омертвения и отторжения клеток эпидермиса с последующей заменой их новыми клетками. Сходным образом происходит процесс восстановления других эпителиальных тканей — например, слизистых оболочек дыхательных путей, а также желудка и кишечника. На втором месте в иерархии регенерирующих способностей находится костная ткань. Известно, что переломы довольно успешно заживляются в течение определенного периода неподвижности.
А среди внутренних органов заслуженным лидером по регенерации является печень. Легенда о титане Прометее, у которого всего за одну ночь выклеванная печень вырастала вновь (рис. 3), имеет в себе рациональное зерно.
Рисунок 3. «Прикованный Прометей». Скульптура Никола-Себастьяна Адама, 1762 г. (Лувр).
Действительно, печень обладает уникальным свойством восстанавливаться до своего первоначального объема, даже если разрушено более 70% печеночной ткани. Подобный процесс происходит за счет работы клеток печени — гепатоцитов. Эти клетки играют ключевую роль в модификации и выводе из организма токсичных веществ. В здоровом органе, не тронутом патологическими процессами, эти клетки обычно находятся в состоянии покоя. Но при необходимости восстановления целостности органа, например, после частичной резекции (удаления части органа), почти все гепатоциты активируются и приступают к делению. Причем делятся они 1–2 раза, а затем снова возвращаются в покоящееся состояние. Это свойство лежит в основе лечения некоторых заболеваний, например, цирроза печени или гепатита, когда пациенту пересаживают часть здоровой печени от донора. Однако такие манипуляции могут привести к ряду проблем со здоровьем, в том числе расширению вен пищевода и желудка, почечной недостаточности и желтухе. Более того, появление в печени пациента быстро делящихся клеток донора может привести к возникновению ракового заболевания. Справиться же своими силами при прогрессирующей болезни гепатоциты уже не могут, ведь к делению способны лишь здоровые клетки, которых в организме больного остается все меньше и меньше.
Получается, что, несмотря на мощный регенеративный потенциал, восстановительные способности печени имеют предел. В случаях, когда патологический процесс заходит слишком далеко, эффект от работы гепатоцитов оказывается недостаточным. Например, когда здоровая печень поражается в результате токсических или вирусных воздействий, что провоцирует разрастание соединительной ткани (фиброз). Существуют ли другие способы восстановления структуры этого жизненно важного органа без участия гепатоцитов? На этот вопрос позволяет ответить совместное исследование команды ученых из Эдинбургского университета, Массачусетского технологического института и Сколковского института науки и технологий [6].
Перспективная реальность: ускоренная регенерация печени
Для изучения процессов регенерации печени использовали трансгенных мышей линии tdTomato (tdTom). Эта линия модифицирована красными флуоресцентными белками, что позволяет визуализировать клетки печени [7]. Однако поиск других «спасательных» клеток осложняет то, что гепатоциты в пораженном организме продолжают работать. Для идентификации «не-гепатоцитов» исследователи использовали технологию нокдауна генов у мышей. Эффект нокдауна заключается в том, что позволяет временно снижать активность конкретных генов, не внося изменения в структуру хромосом и последовательность ДНК. Для «выключения» генов, ответственных за деление и миграцию гепатоцитов, создали особые липидные наночастицы с короткими интерферирующими РНК (siRNA) [8], [9]. С их помощью удалось заблокировать экспрессию необходимых генов.
Снижение пролиферации гепатоцитов за счет «выключения» интересующих ученых генов проводили на двух моделях. В первом случае временно блокировали ген ITGB1, который кодирует β1-интегрин. Вторая модель — одновременное блокирование β1-интегрина и стимуляция избыточной экспрессии белка р21. Обе модели обладали сходным эффектом, однако их механизмы отличались: β1-интегрин вызывает некроз гепатоцитов, а избыточная экспрессия р21 подавляет их пролиферацию.
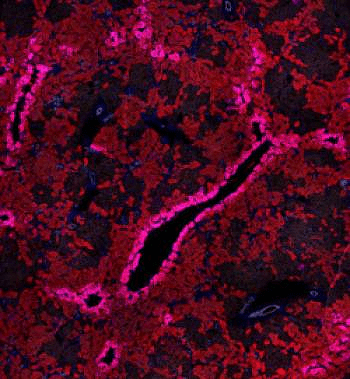
Рисунок 4. Регенерация печени с помощью клеток желчных протоков (выделены белым цветом).
Подобная «блокада» основных функциональных клеток печени привела к необычному эффекту: при выключении главного механизма регенерации запускался резервный способ с участием клеток желчных протоков. Так, потеря β1-интегрина и повышение уровня белка р21 привели к значительному увеличению численности гепатоцитов, полученных из холангиоцитов. Эти эпителиальные клетки внутрипеченочных желчных протоков составляют всего 2–3% от общей популяции, однако дальнейшие наблюдения показали, что именно они способны «перепрограммироваться» и превращаться в гепатоциты, тем самым восстанавливая печень (рис. 4). Более того, холангиоциты показали лучшую, чем гепатоциты, способность к делению. Ранее обнаружили, что они близки к овальным клеткам печени — своеобразным «стволовым» агентам данного органа [10].
Для того чтобы отследить регенеративные способности холангиоцитов, использовали три независимых пути:
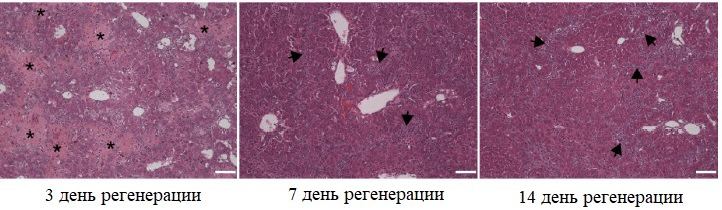
Для изучения регенерации печени за счет не-гепатоцитов по всем трем путям визуализировали отдельные участки печени. Оказалось, что за счет холангиоцитов восстанавливается примерно 20–30% гепатоцитов, причем малые пролиферативные гепатоциты идентифицировали уже с 7 дня, а к 14 дню регенерации их количество значительно увеличивалось (рис. 4–6).
Рисунок 5. Динамика восстановления печеночной ткани с помощью холангиоцитов (на примере модели холестатической болезни печени). Звездочками показаны некротические области; стрелками обозначены области с клеточным инфильтратом.
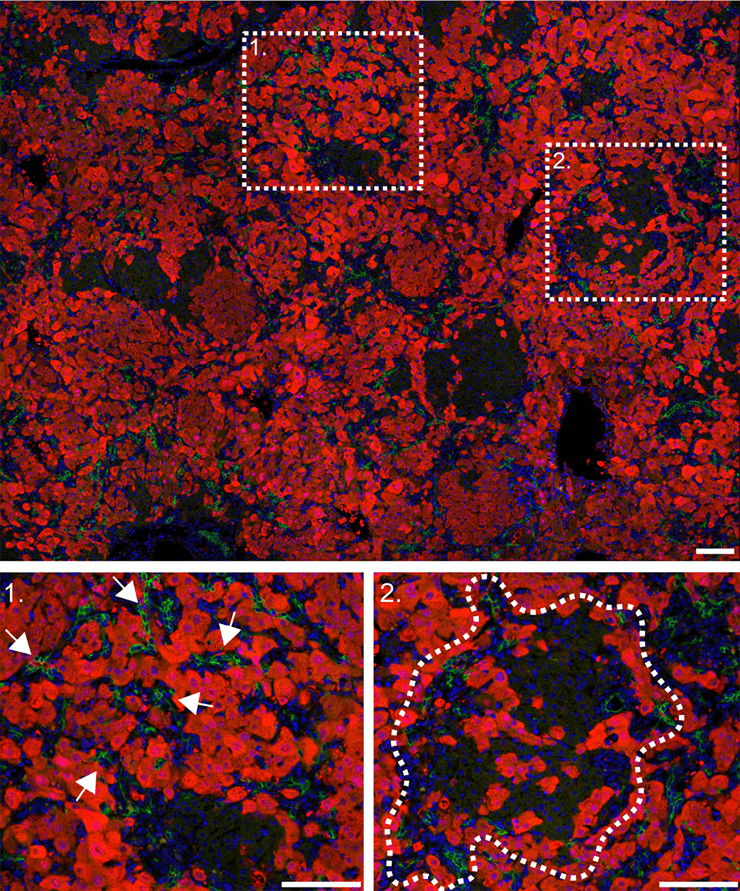
Рисунок 6. Клетки печени мыши, трансформированной по гену ITGB1 (14 день регенерации). Визуализация с помощью красных флуоресцентных белков. 1 — стрелками показаны инвазивные клетки; 2 — пунктиром обведена область регенеративного узла.
Получается, что в печени существует резервный механизм регенерации: трансформация клеток желчных протоков в функциональные гепатоциты при блокировании β1-интегрина. Возможно, в организме существуют и другие гены-мишени, «выключение» которых стабилизирует процессы, связанные с развитием фиброза и дальнейшего цирроза печени. Ученым еще предстоит раскрыть механизмы сигналов, побуждающих желчные клетки запускать процессы «перепрограммирования». Однако результаты исследования уже сегодня открывают новое направление клеточной регенеративной медицины: разработку препаратов, стимулирующих холангиоциты. Возможно, в будущем медицина избавится от необходимости проводить сложные и дорогостоящие операции по пересадке печени. Взамен этого распространится более доступная технология: «включение» сигналов о необходимости регенерации, когда с помощью наиболее активных холангиоцитов будут запускаться процессы активного деления клеток печени.
Как восстанавливается печень после операций
НИИ клинической и экспериментальной лимфологии СО РАМН, Новосибирск
Центр новых медицинских технологий Института химической биологии и фундаментальной медицины СО РАН, Новосибирск, Россия
Лаборатория ультраструктурных основ патологии, Институт молекулярной патологии и патоморфологии Федерального исследовательского центра фундаментальной и трансляционной медицины Министерства науки и высшего образования Российской Федерации», Новосибирск, Россия
Кафедра акушерства и гинекологии Новосибирского государственного медицинского университета Росздрава
Некоторые аспекты регенерации печени после резекции в клинике и эксперименте
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2020;(4): 47-52
Майбородин И. В., Фигуренко Н. Ф., Майбородина В. И., Оноприенко Н. В. Некоторые аспекты регенерации печени после резекции в клинике и эксперименте. Хирургия. Журнал им. Н.И. Пирогова. 2020;(4):47-52.
Maĭborodin I V, Figurenko N F, Maiborodina V I, Onoprienko N V. Liver regeneration after resection in clinical and experimental conditions. Khirurgiya. 2020;(4):47-52.
https://doi.org/10.17116/hirurgia202004147
НИИ клинической и экспериментальной лимфологии СО РАМН, Новосибирск
Цель работы — на основании анализа данных литературы изучить особенности регенерации печени после резекции в клинике и эксперименте. Подробно рассмотрены результаты исследований, содержащиеся в научных публикациях о восстановлении печени после резекции, и возможности влияния на этот процесс. На повреждение печень отвечает гипертрофией оставшейся паренхимы. Для активации, ускорения восстановления печени и замедления этого процесса перспективно использование различных цитокинов. Применение клеточных технологий в терапии заболеваний печени может не только воздействовать на ее репарацию, но и в некоторых случаях сделать ненужными резекцию и трансплантацию. Общепринято мнение, согласно которому основной эффект применения мультипотентных стромальных клеток (МСК) при печеночной недостаточности связан с их дифференцированием в клеточные элементы этого органа. В то же время появились работы, свидетельствующие, что МСК после введения в печень быстро погибают, или диссеминируются по другим органам и тканям, или вообще элиминируются из организма. После резекции печени пристальное внимание следует обращать не только на восстановление функционально активной паренхимы, но и на регенерацию непаренхиматозных структур — сосудистой сети и желчных протоков. Дальнейшие исследования необходимы также для уточнения показаний и определения противопоказаний к применению МСК, профилактических мер с целью исключения возможных осложнений при использовании клеточных технологий.
НИИ клинической и экспериментальной лимфологии СО РАМН, Новосибирск
Центр новых медицинских технологий Института химической биологии и фундаментальной медицины СО РАН, Новосибирск, Россия
Лаборатория ультраструктурных основ патологии, Институт молекулярной патологии и патоморфологии Федерального исследовательского центра фундаментальной и трансляционной медицины Министерства науки и высшего образования Российской Федерации», Новосибирск, Россия
Кафедра акушерства и гинекологии Новосибирского государственного медицинского университета Росздрава
Введение
Терминальные стадии заболеваний печени — одна из основных причин смерти во всем мире. Единственной альтернативой является трансплантация донорской печени. Хирургические вмешательства на печени выполняют по все более широким показаниям, в связи с этим необходимо еще лучше понимать анатомию и физиологию этого органа [1].
Печень млекопитающих обладает исключительной способностью к компенсационному росту в ответ на физические, инфекционные или токсические воздействия, которые вызывают потерю клеток. Восстановление печени — жестко регулируемый процесс, гипертрофия и гиперплазия проходит с участием различных пулов клеток органа и с тонко настроенным взаимодействием факторов роста, цитокинов, компонентов экстрацеллюлярного матрикса и других регуляторов [2].
Цель исследования — на основании анализа данных литературы изучить особенности регенерации печени после резекции в клинике и эксперименте.
Регенерация печени после резекции
Скорость регенерации печени субъективно, по словам доноров, значительно различалась в зависимости от их возраста, типа и размера трансплантата [3]. На скорость регенерации не влияет формирование послеоперационного желчного свища, но установлена зависимость от размеров остающегося фрагмента органа [4]. По мнению T. Aoki и соавт. [5], резекция печени у людей сопровождается быстрой регенерацией в первые 3 мес, после чего следует более умеренное восстановление. Однако объем печени полностью не восстанавливается до предоперационного даже спустя 4 года после резекции.
В ответ на повреждение печеночные клетки, особенно гепатоциты, могут быстро пролиферировать для восстановления объема органа. При определенных обстоятельствах резидентные клетки печени с возможностями предшественников участвуют в пролиферации и дифференцировке других клеточных элементов органа. Эти клетки-предшественники, известные как овальные клетки, у грызунов содержатся в каналах Геринга, расположенных в перипортальной области [6].
Регенеративный ответ возникает независимо от объема резекции, но ход регенерации и экспрессия факторов роста различаются в зависимости от объема удаленной паренхимы [9]. При большем объеме резекции число гепатоцитов, входящих в митогенный клеточный цикл, который поддерживает быструю регенерацию печени, значительно выше [10]. Субтотальная (90%) резекция неизменно приводит к смерти крыс без включения регенерации. У крыс с низкой (10%) остаточной массой печени после резекции обнаружено сохраняющееся повышение уровня интерлейкина-6, фактора роста гепатоцитов (HGF) и трансформирующего фактора роста (TGF)-b1 в крови, что связано с отсутствием пролиферации [2].
Методом световой микроскопии изучали особенности регенерации печени после резекции части ее доли у крыс. Даже спустя 5 нед после удаления 10% органа у некоторых крыс вследствие сосудистых расстройств и нарушений оттока желчи продолжаются активные процессы повреждения и склероза оперированной доли, которые могут завершиться ее атрофией или фиброзом [12].
Регенерация печени после резекции коррелирует с развитием фиброза. Переход покоящихся печеночных звездчатых клеток в фиброгенные миофибробласты сопровождается не только фиброзированием. Некоторые из этих клеточных элементов становятся предшественниками, обеспечивающими регенерацию эпителиальных структур печени после удаления ее части. Следовательно, формирование соединительнотканных и фиброзных рубцов является необходимым компонентом успешной регенерации печени [13].
Таким образом, на повреждение печень отвечает не восстановлением утерянных участков, а гипертрофией оставшейся паренхимы. Существует предел в объеме резекции печени. У млекопитающих он составляет около 70% от массы органа, при превышении этого предела развивается печеночная недостаточность, часто приводящая к гибели оперированного. Регенерация печени после удаления фрагмента протекает с различной скоростью, на что главным образом влияет объем резецированного участка. Пролиферативная активность гепатоцитов после повреждения паренхимы возрастает во всем органе независимо от расположения относительно места хирургического вмешательства. После резекции печени пристальное внимание следует обращать не только на восстановление функционально активной паренхимы, но и на регенерацию непаренхиматозных структур — сосудистой сети и желчных протоков.
Влияние на регенерацию резецированной печени различных факторов
Регенерация печени после резекции проходит значительно медленнее у пациентов с предварительным ее поражением (22 пациента с хроническим вирусным гепатитом и гепатоцеллюлярной карциномой), чем у больных с нормальной печенью (18 пациентов с метастазами в печень колоректального рака) [14].
Аналогичные результаты получены другими исследователями. У пациентов с хроническим гепатитом и циррозом восстановление печени после операций по поводу первичного и вторичного рака идет медленнее, чем у больных при таком же опухолевом процессе, но без сопутствующих заболеваний. Обширная резекция печени с цирротическими изменениями часто приводит к печеночной дисфункции и угрожающей жизни полиорганной недостаточности. В печени во время индуцированного CCl4 цирроза активирован апоптоз, который может участвовать в нарушениях регенеративных процессов, наблюдаемых при этом заболевании [15—17].
Экспериментаторы [18] оценивали последствия ежедневного незначительного (1 г/кг), умеренного (2 г/кг) и тяжелого (4 г/кг) воздействия этанола на регенеративную активность печени у крыс. Взрослым самцам ежедневно вводили этанол и водопроводную воду (контроль) через зонд в течение 30 дней до удаления 70% объема печени. Результаты показали, что незначительное потребление этанола усиливает регенеративную активность печени после обширной резекции.
Для успешной регенерации печени требуется адекватное функционирование печеночных макрофагов. Численность и миграция макрофагов регулируются макрофагальным колониестимулирующим фактором. Уровень этого фактора в плазме крови возрастает у пациентов пропорционально объему резекции печени, низкое содержание данного цитокина связано с повышенной смертностью [19].
HGF (фактор роста гепатоцитов), впервые идентифицированный как наиболее сильный стимулятор синтеза ДНК в гепатоцитах, не только стимулирует регенерацию печени, но и улучшает ее функции, облегчает течение фиброза и защищает клетки от повреждения. Кроме того, HGF в значительной мере подавлял пострезекционные дисфункции печени у крыс. И самое главное, лечение HGF заметно улучшило выживаемость животных в течение 48 ч после 70% резекции [16].
На регенерацию печени оказывают влияние различные внешние и внутренние факторы. В связи с этим появляется возможность активного управления репарационными процессами. Сопутствующие патологические процессы, такие как онкологические заболевания, вирусные поражения, цирроз различной этиологии, замедляют восстановление печени после резекции. Является перспективным использование различных цитокинов не только для активации, ускорения восстановления печени, но и при необходимости для замедления этого процесса.
Клеточные технологии в регенерации поврежденной печени
Поскольку проблемы пересадки органов решены не полностью, клеточная терапия появилась в качестве нового эффективного способа лечения, который основан на способности мультипотентных стромальных клеток (МСК) к мультилинейной дифференцировке и хомингу (процесс перемещения свободных клеток к тканям-мишеням) в поврежденные ткани. Исследования МСК показывают, что клеточные технологии являются потенциальной альтернативой трансплантации печени [20, 21].
Традиционно признано, что МСК при печеночной недостаточности оказывают терапевтическое действие в основном благодаря трансдифференцировке в различные клеточные элементы. Вместе с этим широко используют возможность МСК секретировать различные трофические и иммуномодуляторные факторы, а также экстрацеллюлярные везикулы (экзосомы), которые обладают сходным лечебным действием с самими МСК [20].
В настоящее время существует 2 направления в биоинженерии и регенерации печени. Первое состоит в создании поддерживающего каркаса, либо синтетического, либо из децеллюляризованных органов человека или животных. Далее на этом каркасе размещают клетки, которые созревают в биореакторах или in vivo. Эта стратегия, по-видимому, предлагает самый быстрый путь к клиническому применению. Второе направление связано с индуцированием регенерации оставшейся после резекции ткани через манипулирование клеточным циклом [21].
МСК трансфицировали (вводили невирусным методом) фактор роста эндотелия сосудов (VEGF) и использовали их, вводя через портальный тракт, для регенерации печени крыс после резекции 70% объема органа. Уровень экспрессии VEGF, фактора роста фибробластов, фактора роста тромбоцитов, эпидермального фактора роста, трансформирующего фактора роста TGF, HGF, ангиопоэтинов 1 и 2 в оставшейся ткани печени был значительно выше после инъекции МСК или МСК с трансфицированным VEGF. Обнаружены значительные различия массы и объема печени на 14-й день у крыс без клеточной терапии и у крыс после применения МСК с VEGF. За исключением перипортальной воспалительной реакции, все гистологические параметры были лучше после использования МСК или МСК с VEGF. Сделано заключение, что МСК, трансфицированные VEGF, после инъекции в портальную вену на фоне резекции печени встраиваются в орган и усиливают пролиферацию клеточных элементов желчных протоков и гепатоцитов. При этом секретируются указанные ростовые факторы, которые посредством паракринного действия поддерживают функцию печени, ее регенерацию, восстановление объема и массы [22].
На модели резекции печени у мышей изучали эффективность использования для влияния на регенерацию МСК, выделенных из печени мышиных эмбрионов. Этими клетками в виде мембраны закрывали резецированную поверхность, при этом быстро восстанавливались масса и функция печени с экспрессией трансмембранных сиаломуцинов, активацией фибринолитической системы и синтезом факторов роста гепатоцитов. Применение аллогенных МСК было столь же эффективным, как и сингенных [23].
МСК адипогенного и костномозгового происхождения культивировали на матрицах из фиброина шелка с последующим размещением на поверхности печени мышей после моделирования острого повреждения тетрахлорметаном. Использование МСК показало хорошие результаты биосовместимости с фиброином, они активно дифференцировались в гепатоцитоподобные клетки in vitro. Кроме того, на таких матрицах в модели острой печеночной недостаточности обнаружены и ангиогенез, и гепатоцитоподобные клетки, а функции печени значительно улучшились [3].
МСК костномозгового происхождения вводили в портальную вену крысам с резецированной печенью [24]. Эта процедура уменьшила фиброз печени. Отмечено более выраженное относительно интактных крыс накопление МСК в печени животных после интоксикации CCl4, также снизилась выраженность фиброза. При остром и хроническом повреждении печени количество альбуминсинтезирующих клеток возросло, увеличился их размер. Адипогенные МСК, введенные крысам после резекции печени после ишемии и реперфузии таким же способом, ингибировали апоптоз гепатоцитов и способствовали регенерации печени.
Исследование функций печени и морфологическое изучение показало одинаковый эффект МСК адипогенного и костномозгового происхождения в условиях острого повреждения печени CCl4 в эксперименте. Такие МСК имеют одинаковые способности к дифференцированию в направлении клеточных элементов печени и одинаковую эффективность при лечении острой печеночной недостаточности [25].
После трансплантации МСК обнаружили в перипортальных и поврежденных областях печени мышей с хроническим повреждением органа, индуцированного введением CCl4. Дифференцирование МСК в гепатоциты подтверждено значительным возрастанием в печени уровня мРНК и экспрессией маркеров печеночных альбуминов и α-фетопротеина. После введения МСК установлены снижение уровня аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) в сыворотке крови и нормализация гистопатологических изменений [26].
В эксперименте на крысах острое повреждение печени моделировали внутрибрюшинной инъекцией D-галактозамина и липополисахарида. Внутривенное применение костномозговых МСК значительно снизило уровни АЛТ и АСТ, уменьшило объем некроза гепатоцитов и выраженность воспалительной инфильтрации. Кроме того, введение МСК ингибировало апоптоз гепатоцитов и улучшило регенерацию печени [27].
МСК костномозгового происхождения снижали выраженность фиброза печени. Помимо паракринного механизма, МСК напрямую через межклеточные контакты в значительной степени ингибируют функции и пролиферацию активированных звездчатых клеток печени [28]. Вместе с тем короткое время выживаемости МСК после внутрипеченочной трансплантации ограничивает их применение. Активированные натуральные киллерные клетки ускоряют удаление трансплантированных МСК. Количество натуральных киллерных клеток и экспрессия маркеров их активации в печени значительно увеличиваются после внутрипеченочного введения МСК — натуральные киллерные клетки активируются именно трансплантацией МСК. Анализ цитотоксичности показал, что активированные натуральные киллеры могут ингибировать пролиферацию МСК и индуцировать их деструкцию [29]. По другим данным[30], спустя 4 ч после внутривенного введения МСК мышам с CCl4-индуцированным воспалительным повреждением печени, большинство МСК задержаны в легких.
И.В. Майбородин и соавт. [31] обнаружили, что после введения взвеси МСК непосредственно в печень крыс в некоторых случаях в органе развивается асептическое воспаление, основной причиной которого является присутствие самих МСК и их детрита. На протяжении 4 нед эксперимента ни в одном случае не произошло дифференцирования введенных МСК в клетки печени.
Следовательно, использование клеточных технологий в терапии заболеваний печени может не только воздействовать на ее репарацию, но и в некоторых случаях сделать ненужными и резекцию, и трансплантацию. Общепринято мнение, согласно которому основной эффект применения МСК при печеночной недостаточности связан с их дифференцированием в клеточные элементы этого органа. Необходимо учитывать и иммуномодуляторное действие МСК при болезнях печени. В то же время появились работы, в которых установлено, что МСК после введения в печень быстро погибают, диссеминируются по другим органам и тканям или вообще элиминируются из организма. В любом случае эффективность клеточной терапии требует дальнейших исследований. Это особенно важно для определения возможных противопоказаний к этому методу лечения и профилактики возможных осложнений.
Заключение
На повреждение печень отвечает гипертрофией оставшейся паренхимы. На регенерацию печени оказывают влияние различные внешние и внутренние факторы. Использование клеточных технологий в терапии заболеваний печени может не только воздействовать на ее репарацию, но и в некоторых случаях сделать ненужными и резекцию, и трансплантацию. Общепринято мнение, согласно которому основной эффект применения МСК при печеночной недостаточности связан с их дифференцированием в клеточные элементы этого органа. Однако появились работы, установившие факт гибели МСК после введения в печень, диссеминацию по другим органам и тканям или элиминацию из организма. После резекции печени следует обращать пристальное внимание не только на восстановление функционально активной паренхимы, но и на регенерацию непаренхиматозных структур — сосудистой сети и желчных протоков. Необходимы дальнейшие исследования для уточнения показаний и противопоказаний к применению МСК, а также для определения профилактических мер с целью исключения возможных осложнений при использовании клеточных технологий.
Работа выполнена при финансовой поддержке ПФНИ ГАН на 2017—2020 гг. (VI.62.2.1, 0309-2016-0006) «Разработка технологий получения материалов для регенеративной медицины и развитие методов восстановления репродуктивного здоровья».
Исследование одобрено локальным этическим комитетом Центра новых медицинских технологий Института химической биологии и фундаментальной медицины СО РАН.
Авторы заявляют об отсутствии конфликта интересов.