Как восстановить нейтрофилы после химиотерапии
Повышение лейкоцитов в крови после химиотерапии
В Юсуповской больнице работают опытные онкологи, которые знают, как поднять уровень лейкоцитов в крови до и после химиотерапии. Мы применяем современные препараты для повышения лейкоцитов в крови до и после химиотерапии.
При необходимости, возможно лечение в стационаре, где созданы комфортные условия для пребывания пациентов. Наши специалисты проведут необходимое исследование, используя современную аппаратуру лучших мировых производителей.
Причины и признаки снижения уровня лейкоцитов
Снижение уровня лейкоцитов, или «лейкопения», возникает по разным причинам:
В результате лейкопении пациенты отмечают выраженную слабость, беспокоит лихорадка и озноб, повышается температура тела, присоединяются инфекционные заболевания.
Если лейкопения развилась после химиотерапии, то она может проявлятся такими признаками:
На какой день падают лейкоциты после химиотерапии? Обычно признаки заболевания появляются спустя 1-2 недели от начала лечения и на 4-й неделе проходят самостоятельно. Низкий уровень лейкоцитов в крови у женщин после химиотерапии может быть спровоцирован гормональной дисфункцией или приёмом контрацептивов.
Как быстро повысить лейкоциты в крови после химиотерапии?
Лучшее лекарство для поднятия лейкоцитов после химиотерапии – это колониестимулирующие факторы (нейпоген, метилурацил, лейкоген). К ним также относится филграстим, петоксил, лейкостим.
Как повысить уровень лейкоцитов в крови после химиотерапии методами народной терапии? Онкологи Юсуповской больницы советуют не предпринимать никаких самостоятельных шагов, направленных на лечение лейкопении. Обратитесь к онкологам Юсуповской больницы – они проведут диагностику и назначат эффективное лечение.
Чем можно поднять лейкоциты в крови после химиотерапии?
Известны продукты повышающие лейкоциты в крови после химиотерапии:
Питание при пониженных лейкоцитах в крови после химиотерапии должно быть пятикратным, полноценным. Пациенту обязательно необходимо отказаться от курения и употребления алкоголя.
Не повышают лейкоциты в крови после химиотерапии следующие продукты: животные жиры, сыры с повышенным содержанием жира, сахар, соль, сладости, крепкий чай и кофе.
Что делать если у Вас низкие лейкоциты в крови после химиотерапии?
Если после химиотерапии у вас понижены лейкоциты, звоните по телефону в Юсуповскую больницу и врач-координатор центра ответит на ваши вопросы. Также вы можете записаться на прием через форму обратной связи на сайте.
Врачи Юсуповской больницы основываются на последние достижения в лечении онкологических заболеваний. Мы заботимся о пациентах, нуждающихся в лечении осложнений после химиотерапии.
Клинический анализ крови: лейкопения и нейтропения после химиотерапии
Чем опасна лейкопения?
Побочные действия свойственны всем видам противоопухолевого лечения, даже если оно проводится по современным стандартам. Большая часть осложнений, в том числе и связанных с подавлением кроветворения, таких как лейко- и нейтропения, развивается отсрочено, когда пациент уже не находится в условиях стационара, а выписан под амбулаторное наблюдение.
Лейкопенией называется такое состояние, которое характеризуется снижением уровня лейкоцитов в крови.
Лейкоциты – это белые кровяные тельца. Одна из разновидностей форменных элементов крови наряду с эритроцитами и тромбоцитами.
Главная функция лейкоцитов — это защита организма от инфекций, чужеродных белков и инородных тел, способных нанести ему вред и нарушить баланс биохимических реакций.
Содержание лейкоцитов в крови не является постоянным, оно динамически изменяется в течение дня в зависимости от времени суток и функционального состояния организма. Например, уровень лейкоцитов повышается не только во время наличия какого-либо воспаления в организме, но и обычно несколько повышается к вечеру, после приёма пищи, а также после физического и эмоционального напряжения.
Но мы говорим о тех случаях, когда количество лейкоцитов снижается.
Этому всегда имеется какая-то причина, в том числе это закономерное осложнение противоопухолевого лечения.
Почему это состояние имеет для нас значение?
Лейкоциты отвечают за иммунитет и сопротивление различным неблагоприятным факторам, поэтому при снижении их уровня в крови в первую очередь страдает «оборона» организма.
В этом случае человек становится более уязвим для любой инфекции: бактериальной, вирусной или грибковой.
В большинстве случаев при развитии инфекционных осложнений специализированное противоопухолевое лечение должно быть отложено. Следовательно, помимо главной опасности для человека, которая заключается именно в инфекционном процессе, мы еще сталкиваемся и с тем, что приходится откладывать лечение онкологического заболевания на неопределенный срок до тех пор, пока мы не разберемся с инфекцией.
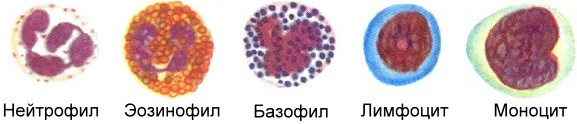
Почему важно знать о лейкоцитарной формуле?
Существует так называемая лейкоцитарная формула, которая формируется из подвидов лейкоцитов: моноцитов, эозинофилов, базофилов, лимфоцитов и нейтрофилов.
Каждый из видов выполняет собственную специфическую для него функцию, хотя в основе лежат именно иммунные процессы.
Когда мы получаем результаты клинического анализа крови, уровень лейкоцитов в нем может быть нормальным, но какую часть от этого общего показателя составляет тот или иной подвид, сказать навскидку невозможно. При этом для планирования системного лечения это очень важно. Именно поэтому онкологи требуют, чтобы в анализах крови было указано абсолютное число всех подвидов лейкоцитов. Обращать на это внимание должен и пациент, когда получает результаты анализов.
Наибольший интерес для химиотерапевтов представляют нейтрофилы. Этот подвид лейкоцитов играет очень важную роль в защите организма от бактериальных и грибковых инфекций и сравнительно меньшую — в защите от вирусных инфекций. В противоопухолевой или антигельминтной защите нейтрофилы практически не играют роли, в этих процессах участвуют другие клетки.
При проведении химиотерапии уровень нейтрофилов критично важный показатель. Если количество нейтрофилов падает ниже 0,5х10*9/л, то нормальная микрофлора, которая присутствует, например, во рту или кишечнике, может вызывать инфекции. Если количество снижается до Можно ли поднять уровень лейкоцитов и нейтрофилов?
Химиопрепараты – это токсичные вещества. К их применению существуют показания и противопоказания, потому что они могут как помочь пациенту, так и очень сильно навредить, если использовать их бездумно. Единственным подходящим и разумным методом повышения уровня лейкоцитов и нейтрофилов является ожидание.
Да, это действительно так.
Во-первых, потому что каждый организм имеет свои особенности и не всегда способен восстановиться к тому времени, которое предусмотрено рекомендациями.
Интервалы между циклами являются оптимальными, но при этом отклонение от сроков на 1-2 недели (иногда и больше, если потребуется) является допустимым, если имеются противопоказания к проведению химиотерапии.
Во-вторых, любые препараты, которые стимулируют повышение уровня лейкоцитов и нейтрофилов опасны тем, что после нескольких таких стимуляций резерв костного мозга может быть истощен, и после этого восстановление будет проходить намного дольше и будет сопряжено с возможными осложнениями.
Если лейко- и нейтропения постоянная, и организм не восстанавливается должным образом даже при увеличении интервалов между циклами, то назначаются специализированные препараты, которые должны применяться только под наблюдением врача в строго показанных ситуациях.
Любые так называемые иммуномодуляторы, стимуляторы иммунитета никакой пользы не принесут, эффекта от них не будет, потому что лейкоциты все равно будут снижаться на фоне химиотерапии, так и должно быть, но при этом такие препараты могут спровоцировать развитие нежелательных реакций.
Фебрильная нейтропения
Сочетание повышения температуры тела со снижением количества нейтрофилов носит термин фебрильной нейтропении. Это угрожающее жизни пациента состояние, внезапно и остро развивающееся у больных на фоне снижения числа циркулирующих в крови нейтрофилов ниже 0,5х10*9/л.
Основная проблема состоит в том, что врачам-онкологам очень трудно контролировать это осложнение и своевременно принимать необходимые меры, поскольку у большинства пациентов фебрильная нейтропения развивается в период, когда они уже не находятся в условиях стационара.
Поэтому пациент также должен быть внимателен к своему состоянию и своевременно принимать меры: связаться с врачом, как можно скорее сдать кровь и неукоснительно следовать тому, что рекомендует лечащий врач.
При повышении температуры тела выше 38.0 0 С необходимо как можно скорее сдать клинический анализ крови. Это важно! Без его результата невозможно сказать наверняка есть ли фебрильная нейтропения у пациента, нужны ли какие-либо срочные мероприятия.
Помните, что это осложнение может обернуться большой бедой, если его не распознать и не начать вовремя лечить.
В отсутствие своевременного лечения в течение 48 часов после развития фебрильной нейтропении летальный исход имеет место в 50% случаев! Даже при проведении антибактериальной терапии риск смертельного исхода сохраняется в 10% случаев.
Это говорит о том, что это очень опасное осложнение, нельзя относиться к нему легкомысленно.
Около 80 % фебрильных эпизодов на фоне сниженного уровня нейтрофилов в крови связаны с развитием инфекции, которая протекает с отсутствием классических симптомов (боль, гиперемия, отёк, жар), а основным критерием инфекционного процесса является высокая температура тела.
До последнего времени лихорадка, возникающая у больного с нейтропенией, являлась основанием для обязательной госпитализации и проведения лечения в стационаре. Однако в результате проведения клинических исследований была создана система оценки осложнений у больных с фебрильной нейтропенией. Врач согласно этой шкале считает баллы и может оценить существуют ли риски при проведении лечения амбулаторно.
Что рекомендуется делать пациентам, у которых развилось данное осложнение
1) При повышении температуры тела срочно сдать анализ крови. Сообщить лечащему врачу о результатах анализа.
При наличии критично низкого уровня лейкоцитов и нейтрофилов очередное введение химиопрепаратов будет отложено до момента полного восстановления.
2) Старайтесь придерживаться полноценного рациона, исключите сырые продукты (то есть мясо, рыбу, яйца, фрукты и овощи) – все продукты без исключения должны быть термически обработаны.
3) Соблюдайте режим работы и отдыха, не нагружайте себя, дайте возможность организму восполнить силы и энергию для скорейшего восстановления.
4) Тщательно соблюдайте личную гигиену, потому как любая инфекция может стать причиной ухудшения состояния.
5) Не посещайте места большого скопления людей без необходимости. Соблюдайте самоизоляцию. Это актуально не только во время нынешней пандемии, ведь риски присоединения инфекций во время фебрильной нейтропении колоссальные – даже ваши домочадцы могут представлять опасность, что уж говорить о большом количестве незнакомцев, например, в магазинах.
6) Если вы вынуждены посетить место с большим количеством людей, например, чтобы сдать анализ крови, то обязательно носите защитную маску. Старайтесь соблюдать дистанцию с окружающими.
К основным препаратам, которые используют при лечении фебрильной нетропении, относятся антибиотики, также используются специализированные препараты для стимуляции повышения уровня лейкоцитов и нейтрофилов – это колониестимулирующие факторы (Г-КСФ).
Эти препараты применяются для ускорения образования, созревания и выброса нейтрофилов из костного мозга в периферическую кровь, где они начинают выполнять свои функции и защищать организм.
Что следует знать пациентам о применении колониестимулирующих факторов
1) Применение Г-КСФ сразу после ХТ (в первые сутки) или на фоне ХТ строго запрещено, это может привести к развитию тяжелой лейко- и нейтропении. К сожалению, иногда такое происходит, поэтому пациенты тоже должны быть осведомлены, что так делать нельзя.
2) Применение этих препаратов должно быть прекращено как минимум за 48 часов до начала цикла химиотерапии.
3) Г-КСФ не применяются для лечения афебрильной нейтропении (то есть если уровень нейтрофилов низкий, но повышения температуры тела нет).
4) Не применяют их также при осложнениях и инфекциях, которые не связаны с нейтропенией (например, если развилась пневмония, но при этом уровень лейкоцитов и нейтрофилов в норме или повышен).
5) В некоторых случаях разрешается введение колониестимулирующих факторов с целью профилактики развития фебрильной нейтропении, если у пациента имеются факторы высокого риска развития этого осложнения. Наличие этих факторов должен перед каждым циклом химиотерапии оценивать лечащий врач.
Участие самого пациента в процессе лечения – это неоценимая помощь врачу в борьбе с онкологическим заболеванием. Когда пациент внимателен к себе, интересуется происходящим и стремится к командной работе с врачом, выполняя его рекомендации, то лечение проходит легче. И с осложнениями, которые, к сожалению, нередки, справляться тоже становится проще.
Источники литературы:
Осложнения после химиотерапии
Цитостатики и цитотоксины – два вида химиопрепаратов, используемых в наши дни для лечения онкологических заболеваний. Хотя их действие не патологические клетки сильно отличается, оба вида оказывают огромный вред здоровым тканям.
Серьезные осложнения препятствующие проведению химиотерапии
• тромбоцитопения,
• анемия,
• нейтропения.
Чем же опасна химиотерапия?
Химиопрепараты не могут воздействовать исключительно на пораженные клетки, вместе с ними они задевают и здоровые, вызывая отрицательные для всего организма последствия, разные по степени тяжести.
Тромбоцитопения
Тромбоцитопения – одно из осложнений химиотерапии, характеризующееся снижением уровня тромбоцитов (клетки неправильной формы, вырабатываемые красным костным мозгом) в крови. Функция этих клеток заключается в обеспечении свертываемости крови. Форменные пластинки закрывают просвет сосуда в месте его повреждения и препятствуют прохождению крови по нему, тем самым останавливая кровотечение. Тромбоциты останавливают даже значительные по силе кровотечения и предотвращают большую потерю крови, без них даже слегка порезавшийся человек может умереть. Больные тромбоцитопенией должны быть особо внимательны к своей безопасности, ведь малейшая царапина может иметь неприятные для них последствия.
Геморрагическая пурпура
После химиотерапии иммунная система может начать продуцировать антитела, уничтожающие тромбоциты. Такое состояние характерно для геморрагической пурпуры. Аутоантитела – антитела, уничтожающие в крови тромбоциты. Воспроизводятся они селезенкой. При этом заболевании организм фактически убивает себя сам. Содержание тромбоцитов в миллилитре крови здорового взрослого человека – 150-400 тыс, если организм заболевает содержание клеток может снижаться практически до нуля. Пропорционально снижению количества клеток повышается вероятность инсульта.
Острая тромбоцитопения
Тромбоцитопения – заболевание, характеризующееся возникновением мелких гематом на коже и внутренних органах. Чаще всего она возникает после кори, краснухи и других вирусных заболеваний. Часто у этих пациентов случаются носовые кровотечения, кровоизлияния во внутренние органы. Кровоизлияние в мозг может привести к серьезному осложнению – инсульту, восстановление после которого обычно требует много времени и средств.
Мелкие кровоизлияния возникают самопроизвольно, связано это с тем, что при тромбоцитопении нарушается целостность стенки кровеносных сосудов и эритроциты получают возможность просачиваться в ткани. Это может вести к нарушению зрению (из-за кровоизлияний в глаз) и обильным кровотечениях из маленьких царапин (чаще наблюдаются в первые дни проявления заболевания).
Лечение может быть довольно продолжительным и дорогостоящим. Пациент с тромбоцитопенией должен проходить курс терапии в стационаре. Для лечения используют глюкокортикостероиды курсом от трех до шести недель. Последнее время начали применять иммуноглобулины. Используют их в тех случаях, когда необходимо за короткое время сильно увеличить количество тромбоцитов в крови, например перед операциями или родами. Эффект от их использования непродолжительный.
При носовых кровотечениях используется гемостатическая губка с пропиткой тромбином. Порой при анемии может потребоваться переливание эритроцитарный массы или тромбоцитов. У большинства пациентов лечение приводит к полному выздоровления, однако к 10-15% заболевание может перейти в хроническую форму или иметь множество рецидивов.
Анемия
Основной вред химиопрепараты наносят костному мозгу, который отвечает за образование кровяных телец. Вследствие этого нарушаются процессы кроветворения, что ведет к уменьшению количества эритроцитов в крови (анемии). Главная функция эритроцитов – доставка кислорода из легких ко всем органам и тканям, осуществляется она благодаря содержащемуся в них гемоглобину. Под воздействием химиотерапии нарушается образование кровяных клеток, а значит снижается уровень эритроцитов, что в свою очередь может вести к снижению уровня гемоглобина. Эти процессы ведут к снижению доставки кислорода к тканям и ухудшению работы всех органов. Это и есть главная опасность анемии для организма.
Проявлениями анемии могут быть головокружения, сердцебиение, одышка, озноб. Немедленно сообщите врачу о появлении хотя бы одного из этих симптомов. Также нельзя забывать о следующих рекомендациях:
• обязательные долгий ночной сон и дневной один-два часа;
• необходимо снижение активности насколько это возможно;
• обратитесь за помощью в домашних делах к родственникам (например, помыть пол или присмотреть за детьми);
• обратитесь к диетологу за назначением сбалансированного питания;
• избегайте резких движений, чтобы избежать головокружения.
Влияние химиотерапии на свертываемость крови
Химиотерапия оказывает на организм весьма серьезное отрицательное воздействие, ведущее, например, к снижению эритроцитов или тромбоцитов. При прохождении курса химиотерапии могут нарушаться функции костного мозга, в итоге снижается содержание тромбоцитов и следовательно нарушается функция свертывания крови. Клетки крови живут непродолжительный промежуток времени, поэтому костный мозг должен постоянно производить новые, но если он поврежден химиотерапией этот процесс значительно нарушается.
Тромбоциты обеспечивают свертываемость крови и останавливают кровотечение при повреждении любых тканей и сосудов, как крупных, так и совсем мелких, которые можно повредить случайно. Если целостность стенки сосуда нарушилась, тромбоциты распадаются и из них освобождаются активные биологические вещества, которые запускают цепь последовательных реакций в образовании кровяного сгустка. Сгусток закрывает поврежденное место сосуда и кровотечение прекращается.
При лечении химиотерапией, в связи с резким снижением уровня тромбоцитов, даже незначительные царапины могут вызвать сильное кровотечение, поэтому пациентам стоит уделять особое внимание своей безопасности. Так же симптомами снижения уровня тромбоцитов являются появление мелких синяков и кровоизлияний на теле, кровоточивость десен, частные носовые кровотечения, изредка появляется примесь крови в моче (она приобретает красноватый оттенок) и кале (приобретает дегтеобразный вид). О появлении хотя бы одного симптома сообщите врачу.
Для того, чтобы осложнения вас не коснулись, доктор должен постоянно контролировать уровень тромбоцитов и при его критическом снижении назначить переливание крови.
Нейтропения и нейтрофилы
Костный мозг постоянно вырабатывает белые кровяные тельца – лейкоциты. Они делятся на три вида: нейтрофилы, моноциты и лимфоциты. Нейтропения – резкое снижение количества гранулоцитов в крови. Агранулоцитоз – самый опасный вид нейтропении, при котором уровень гранулоцитов снижается практически до нуля.
Главная функция нейтрофилов – защита организма от инфекций. При их снижении больной подвергается риску заражения опасными инфекционными заболеваниями, которые могут требовать госпитализации и применения массивной антибиотикотерапии. Ткань, которая и определяет состав крови, включат в себя незрелые клетки, которые называются стволовыми кроветворными клетками, или клетками предшественниками. Они могут делиться на совершенно любые клетки крови.
Самое опасное осложнен после прохождения курса химиотерапии – анемия. Опасность химиотерапии заключается в:
1. Уменьшении количества эритроцитов переносящих кислород;
2. Ухудшении свертываемости крови;
3. Уменьшении численности нейтрофилов.
Нейтропения считается самым распространенным осложнением химиотерапии.
Риск нейтропении
Нейтропении делиться на 4 степени тяжести в зависимости от уровня содержания нейтрофилов в крови. К сожалению, при лечении химиотерапией невозможно избежать этого осложнения, и пропорционально дозе химиопрепаратов меняется и степень нейтропении, но вот и положительный эффект тоже растет.
Нейтрофилы – главная защита организма от инфекций, поэтому при их снижении организм становится уязвимым для микроорганизмов попадающих из внешней среды и в нем свободно размножаются различные инфекции. Именно с этим фактом связывают большое количество инфекционных осложнений во время и после химиотерапии. Так же из-за нейтропении часто приходится делать длительные перерывы между курсами лечения для того, чтобы организм восстановил уровень защитных клеток. В перерывах между курсами химиотерапии необходимо постоянно сдавать анализ крови, контролируя уровень нейтрофилов, чтобы, при необходимости, вовремя оказать медицинскую помощь.
После химиотерапии могут появиться следующие симптомы:
• жар,
• озноб,
• боль в горле,
• диарея,
• сыпь,
• покраснение кожи возле глаз.
Если вы заметили у себя хоть одно из них, немедленно сообщите своему врачу.
Временами продолжение химиотерапии становится невозможным и перерыв между курсами приходится увеличивать. Это может иметь весьма неприятные последствия: опухолевые клетки за длительный промежуток времени могут выработать иммунитет к химиопрепаратам и шансы на хороший результат резко снизятся.
В норме в организме человека нейтрофилов содержится от четырех до семи миллионов на миллилитр крови. При таком уровне организм надежно защищен от микроорганизмов попадающих из внешней среды. Риск значительно возрастает при снижении уровня лейкоцитов до 500 тысяч на миллилитр. Таким пациентки могут назначить курс антибиотиков для профилактики, однако они довольно дорогостоящие и не всегда эффективны. Второй вариант – использование гранулоцитарного колониестимулирующего фактора (Г-КСФ).
Для подбора эффективного метода лечения вы можете обратиться за
— методы инновационной терапии;
— возможности участия в экспериментальной терапии;
— как получить квоту на бесплатное лечение в онкоцентр;
— организационные вопросы.
После консультации пациенту назначается день и время прибытия на лечение, отделение терапии, по возможности назначается лечащий доктор.
Как восстановить нейтрофилы после химиотерапии
ФГБУ “Онкологический научный центр им. Н.Н. Блохина” РАМН, Москва
Одним из наиболее частых и опасных побочных эффектов цитостатической терапии
является нейтропения. Цитостатики, действуя на быстроделящиеся клетки, затрагивают и систему кроветворения. Циркулирующие нейтрофилы живут в среднем 6–9 часов, и система гемопоэза постоянно вырабатывает около 50 млн этих клеток в 1 минуту для замещения выбывших. Снижение
продукции нейтрофилов после воздействия химиопрепаратов приводит к быстрому уменьшению содержания этих клеток в периферической крови, что повышает риск развития инфекционных осложнений.
Длительная нейтропения зачастую не позволяет проводить химиотерапию (ХТ) в запланированные сроки, заставляет редуцировать дозы цитостатиков, что в свою очередь снижает эффективность противоопухолевого лечения. Кроме того, инфекционные осложнения на фоне нейтропении в
отсутствие адекватной терапии характеризуются стремительным течением и высокой летальностью. В связи с этим существует необходимость тщательной оценки миелотоксического потенциала современных режимов химиотерапии и выявления групп больных с высоким риском развития нейтропении, которым требуется профилактическое назначение колониестимулирующих факторов (КСФ).
Повышенный риск развития инфекции на фоне нейтропении обусловил выделение симптомокомплекса
“фебрильная нейтропения” (ФН). Согласно руководству NCCN (National Comprehensive Cancer Network) [1], ФН характеризуется повышением температуры в ротовой полости выше 38,5 °С при однократном измерении или выше 38,0 °С при двух последовательных измерениях в течение 2 часов при абсолютном числе нейтрофилов (АЧН) в крови менее 0,5 × 109/л или ожидаемом снижении 10 дней или ФН
после ХТ; вовлечение в опухолевый процесс костного мозга; лучевая терапия в анамнезе; недавно перенесенное оперативное вмешательство; наличие раневого процесса; плохой соматический статус пациента; нарушение функции печени и почек; пневмония; присоединившаяся грибковая инфекция.
Риск развития инфекционных осложнений у больных нейтропенией обусловлен не только уменьшением АЧН, но и нарушением функциональных свойств нейтрофилов (ослабление хемотаксиса и фагоцитоза; нарушение экзогенной продукции ростовых факторов, таких как интерлейкин-1,
интерлейкин-3, гранулоцитарно-макрофагального КСФ, Г-КСФ; изменение активности ферментов; снижение образования активных форм кислорода).
Оценка риска развития ФН должна проводиться перед каждым курсом ХТ. Если пациент в течение предыдущего цикла ХТ перенес эпизод ФН или дозолимитирующей нейтропенической инфекции и проводимая ХТ направлена на выздоровление, проведение последующих курсов ХТ в прежних дозах влечет за собой “высокий риск” развития ФН. В таких случаях необходимо рассмотреть вопрос об использовании КСФ. Если пациент перенес эпизод ФН, несмотря на использование КСФ, NCCN рекомендует провести редукцию доз химиопрепаратов во время последующих циклов или изменить
режим ХТ.
Эти рекомендации основаны на результатах крупных рандомизированных исследований, показавших, что риск развития ФН может быть значи-тельно снижен благодаря проведению первичной профилактики с использованием КСФ.
Vogel и соавт. [4] в двойном слепом рандомизированном плацебо-контролируемом многоцентровом
исследовании установили, что при первом и всех последующих циклах ХТ профилактическое назначение КСФ (пегилированный филграстим) значительно снижает риск развития ФН при режимах ХТ, которые прежде ассоциировались с “высоким риском” этого осложнения. В исследование
были включены больные РМЖ, получавшие доцетаксел 100 мг/м2 каждые 3 недели. Пациентки были распределены в 2 группы: 1-я группа (465 жен-щин) получала инъекции плацебо; 2-я группа (463 женщины) – пегфилграстим подкожно (вводился через 24 часа после завершения цикла ХТ). В группе
плацебо частота развития ФН составила 17 %, в группе пегфилграстима – 1 %. Потребность в госпитализации уменьшилась с 14 до 1%, а в использовании внутривенной антибактериальной терапии (АБТ) – с 10 до 2 % (p 50·× 109/л Граноген следует немедленно отменять.
Успех лечения ФН во многом зависит от раннего распознавания возможной инфекции и раннего начала терапии. Нейтропения значительно ослабляет иммунный ответ организма, что не позволяет развиваться характерным клиническим проявлениям инфекции, затрудняя ее клиническую диагностику у онкологических больных. Гипертермия у пациентов с нейтропенией часто бывает единственным
признаком инфекционного процесса.
Согласно клиническим рекомендациям ESMO, необходимо проводить тщательные первичный осмотр и
обследование на выявление возможных очагов инфекции [8]:
1. Наличие длительно стоящего центрального венозного катетера.
2. Симптомы и признаки наличия инфекции дыхательной системы, сердечно-сосудистой системы,
желудочно-кишечного тракта, кожных покровов, мочеполовой системы, центральной нервной системы.
3. Данные о предшествующих положительных результатах микробиологического анализа.
4. Рутинные лабораторные и инструментальные исследования:
• общий и биохимический анализы крови, коагулограмма, С-реактивный белок;
• посев крови (минимум 2 раза), включая посев из центрального венозного катетера; микроскопическое исследование и посев мочи;
• микроскопическое исследование мокроты и ее посев;
• микроскопическое исследование кала и его посев (при диарее);
• исследование очагов инфекции на коже (аспират, биопсия, мазок);
• рентгенография органов грудной клетки.
5. Дальнейшие исследования (при длительной и глубокой нейтропении): компьютерная томография органов грудной клетки (если лихорадка сохраняется, несмотря на адекватную АБТ, более 72 часов).
Немедленный подсчет формулы крови для установления числа нейтрофилов параллельно с другими исследованиями, представленными выше, имеют ключевое значение для определения необходимости начала ранней терапии ФН.
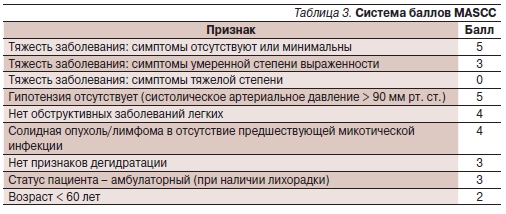
Международной ассоциацией поддерживающей терапии при раке (MASCC) разработан прогностический индекс [9, 10]. Он позволяет быстро оценивать риск осложнений – до того, как станет известно содержание нейтрофилов в крови пациента. Эффективность данного метода подтверждена во многих проспективных исследованиях.
Критерии индекса MASCC представлены в табл. 3.
Показателем “низкого риска” осложнений является сумма баллов > 21. Частота серьезных осложнений при этом не превышает 6 %, а смертность – 1 %. При сумме баллов
1. Crawford J, Althaus D, et al. National Comprehensive Cancer Network. Myeloid growth factors clinical practice guidelines in oncology. J Nat Compreh Cancer Network 2005;3:540–55.
2. ASCO Recommendations for the use of hematopoietic colony-stimulating factors: evidencebased,
clinical practice guidelines. J Clin Oncol 1994;12:2471–250.
3. Zielinski CC, Awada A, Cameron DA, et al. The impact of new European Organisation for Research and Treatment of Cancer guidelines on the use of granulocyte colony-stimulating factor on the management of breast cancer patients. Eur J Cancer 2008;44: 353–65.
4. Vogel CL, Wojtukiewicz MZ, Carroll RR, et al. First and subsequent cycle use of pegfilgrastim prevents febrile neutropenia in patients with breast cancer: a multicenter, double-blind, placebo-controlled phase III study. J Clin Oncol2005;23:1178–84.
5. Timmer-Bonte JN, de Boo TM, Smith HJ, et al. Prevention of chemotherapyinduced febrile neutropenia by prophylactic antibiotics plus or minus granulocyte colony-stimulating factor in small cell lung cancer: a Dutch randomized phase III study. J Clin Oncol 2005;23:7974–84.
6. Yoshida M, Ohno R. Antimicrobial prophylaxis in febrile neutropenia. Clin Infect Dis 2004;39 (1):65–7.
7. Cullen M, Steven N, Billingham L, et al. Antibacterial prophylaxis after chemotherapy for solid tumours and lymphomas. N Engl J Med 2005;353:988–98.
8. Минимальные клинические рекомендации Европейского общества медицинской онкологии (ESMO). М., 2010. C. 375–91.
9. Klastersky J, Paesmans M, Rubenstein E B et al. The Multinational Association for Supportive Care in Cancer risk index: a multinational scoring system for identifying low-risk febrile neutropenic cancer patients. J Clin Oncol 2000; 18:3038–51.
10. Innes H, Lim SL, Hall A, et al. Management of febrile neutropenia in solid tumours and lymphomas
using the Multinational Association for Supportive Care in Cancer (MASCC) risk index: feasibility and safety in routine clinical practice. Supp Care Cancer 2008;16:485–491.
11. Vidal L, Paul M, Ben Dor I, et al. Oral versus intravenous antibiotic treatment for febrile neutropenia
in cancer patients: a systematic review and meta-analysis of randomized trials. J Antimicrob Chemother 2004;54:29–37.
12. Kovacs J, Masour H. Evolving health effects of Pneumocystis: one hundred years of progress of diagnosis and treatment. JAMA 2009;301:2578–85.
13. 13 Wolf H-H, Leithauser M, Maschmeyer G, et al. Central venous catheter-related infections in hematology and oncology. Guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO). Ann Hematol 2008;87:863–76.
14. Raad I, Kassar R, Dany G, et al. Management of the catheter in documented catheterrelated coagulase-negative staphylococcal bacteremia: remove or retain? Clin Infect Dis 2009;49:1187–194.
15. Kim SH, Kang CI, Kim HB, et al. Outcomes of hickman catheter salvage in febrile neutropenic cancer patients with Staphylococcus aureus bacteremia. Infect Control Hosp Epidemiol 2003;24:897–904.
16. Walsh TJ, Teppler H, Donowitz GR, et al. Caspofungin versus liposomal amphotericin B for empirical antifungal therapy in patients with persistent fever and neutropenia. N Engl J Med 2004;351:1391–402.
17. Herbrecht R, Denning DW, Patterson TF, et al. Voriconazole versus amphotericin B for primary therapy of invasive aspergillosis. N Engl J Med 2002;347:408–15.
18. Dockrell DH. Salvage therapy for invasive aspergillosis. J Antimicrob Chemother 2008;61:41–4.
19. Schmutzhard E, Williams KJ, Vukmirovits G, et al. A randomised comparison of meropenem with cefotaxime or ceftriaxone for the treatment of bacterial meningitis in adults. Meropenem Meningitis Study Group. J Antimicrob Chemother 1995;36:85–97.