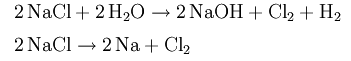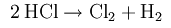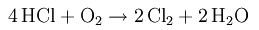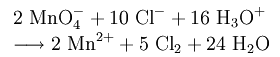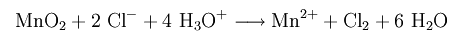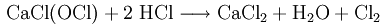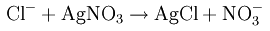Как встречается хлор в природе
Хлор (Cl, Chlorine)
История хлора
В 1774 году Карл Шееле, химик из Швеции, впервые получил хлор, но считалось, что это не отдельный элемент, а разновидность соляной кислоты (calorizator). Элементарный хлор был получен в начале XIX века Г. Дэви, который разложил поваренную соль на хлор и натрий путём электролиза.
Общая характеристика хлора
Хлор (от греческого χλωρός – зелёный) является элементом XVII группы периодической таблицы химических элементов Д.И. Менделеева, имеет атомный номер 17 и атомную массу 35,452. Принятое обозначение Cl ( от латинского Chlorum).
Нахождение в природе
Хлор является самым распространённым в земной коре галогеном, чаще всего в виде двух изотопов. В силу химической активности встречается лишь в виде соединений многих минералов.
Физические и химические свойства
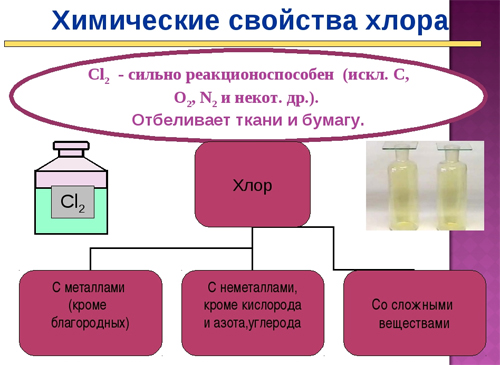
Хлор является ядовитым жёлто-зелёным газом, имеет резкий неприятный запах и сладковатый вкус. Именно хлор после его открытия предложили называть галогеном, в одноимённую группу он входит как один из самых химически активных неметаллов.
Суточная потребность в хлоре
В норме взрослый здоровый человек должен получать в сутки 4-6 г хлора, потребность в нём возрастает при активных физических нагрузках или жаркой погоде (при повышенном потоотделении). Обычно суточную норму организм получает из продуктов питания при сбалансированном рационе.
Продукты питания богатые хлором
Основным поставщиком хлора в организм является поваренная соль – особенно, если она не подвергается термической обработке, поэтому лучше солить уже готовые блюда. Также хлор содержат яйца, морепродукты, мясо, горох, фасоль и чечевица, гречка и рис, оливки.
Взаимодействие с другими
Кислотно-щелочной и водный баланс организма регулируется калием, натрием и хлором.
Признаки нехватки хлора
Нехватка хлора вызвана процессами, приводящими к обезвоживанию организма – сильное потоотделение в жару или при физических нагрузках, рвота, диарея и некоторые заболевания моче-выделительной системы. Признаками недостатка хлора являются вялость и сонливость, слабость в мышцах, явная сухость во рту, потеря вкусовых ощущений, отсутствие аппетита.
Признаки избытка хлора
Признаками избытка хлора в организме являются: повышение кровяного давления, сухой кашель, боль в голове и в груди, резь в глазах, слезотечение, расстройства деятельности желудочно-кишечного тракта. Как правило, переизбыток хлора может быть вызван употреблением обычной воды из-под крана, которая проходит процесс дезинфекции хлором и случается у работников тех отраслей промышленности, которые напрямую связаны с использованием хлора.
Полезные свойства хлора и его влияние на организм
Хлор в организме человека:
Применение хлора в жизни
Основное применение хлора – химическая промышленность, где с его помощью изготавливают поливинилхлорид, пенопласт, материалы для упаковки, также боевые отравляющие вещества и удобрения для растений. Обеззараживание питьевой воды хлором – практически единственный доступный способ очистки воды.
Хлор. Таблица Менделееева Д.И.
Хлор (от греч. χλωρός — «зелёный») — элемент 17-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы VII группы), третьего периода, с атомным номером 17. Обозначается символом Cl (лат. Chlorum). Химически активный неметалл. Входит в группу галогенов (первоначально название «галоген» использовал немецкий химик Швейгер для хлора [дословно «галоген» переводится как солерод], но оно не прижилось, и впоследствии стало общим для VII группы элементов, в которую входит и хлор).
Простое вещество хлор (CAS-номер: 7782-50-5) при нормальных условиях — ядовитый газ желтовато-зелёного цвета, с резким запахом. Молекула хлора двухатомная (формула Cl2).
Соединение с хлором — газообразный хлороводород — было впервые получено Джозефом Пристли в 1772 г. Хлор был получен в 1774 г. шведским химиком Карлом Вильгельмом Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
4HCl + MnO2 = Cl2 + MnCl2 + 2H2O
Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства. Однако Шееле, в соответствии с господствовавшей в химии того времени теории флогистона, предположил, что хлор представляет собой дефлогистированную соляную кислоту, то есть оксид соляной кислоты. Бертолле и Лавуазье предположили, что хлор является оксидом элемента мурия, однако попытки его выделения оставались безуспешными вплоть до работ Дэви, которому электролизом удалось разложить поваренную соль на натрий и хлор.
Распространение в природе
В природе встречаются два изотопа хлора 35Cl и 37Cl. В земной коре хлор самый распространённый галоген. Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов: галита NaCI, сильвина KCl, сильвинита KCl · NaCl, бишофита MgCl2 · 6H2O, карналлита KCl · MgCl2 · 6Н2O, каинита KCl · MgSO4 · 3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов (содержание в морской воде 19 г/л). На долю хлора приходится 0,025 % от общего числа атомов земной коры, кларковое число хлора — 0,017 %, а человеческий организм содержит 0,25 % ионов хлора по массе. В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
При нормальных условиях хлор — жёлто-зелёный газ с удушающим запахом. Газообразный хлор относительно легко сжижается. Начиная с давления в 0,8 МПа (8 атмосфер), хлор будет жидким уже при комнатной температуре. При охлаждении до температуры в −34 °C хлор тоже становится жидким при нормальном атмосферном давлении. Жидкий хлор — жёлто-зелёная жидкость, обладающая очень высоким коррозионным действием (за счёт высокой концентрации молекул). Повышая давление, можно добиться существования жидкого хлора вплоть до температуры в +144 °C (критической температуры) при критическом давлении в 7,6 МПа.
При температуре ниже −101 °C жидкий хлор кристаллизуется в орторомбическую решётку с пространственной группой Cmca и параметрами a=6,29 Å b=4,50 Å, c=8,21 Å. Ниже 100 К орторомбическая модификация кристаллического хлора переходит в тетрагональную, имеющую пространственную группу P42/ncm и параметры решётки a=8,56 Å и c=6,12 Å.
По электропроводности жидкий хлор занимает место среди самых сильных изоляторов: он проводит ток почти в миллиард раз хуже, чем дистиллированная вода, и в 1022 раз хуже серебра. Скорость звука в хлоре примерно в полтора раза меньше, чем в воздухе.
Интересные факты о хлоре
Приветствуем вас на сайте Interessno.ru, наши уважаемые читатели. Хлор (Cl) – это химический элемент с атомным номером 17. Он принадлежит к 17-й группе периодической таблицы химических элементов. Это токсичный, едкий, зеленовато-желтый газ, который раздражает глаза и органы дыхания. Но что мы знаем об этом элементе еще? На самом деле, не так уж и много.
Поэтому сегодня мы это исправим. Именно для вас, наши уважаемые читатели, мы подобрали самые интересные факты о хлоре. Надеемся, информация из статьи будет полезна и детям и школьникам, которые изучают элемент на уроках химии, и их родителям.
Содержание
В земных океанах содержится большое количество хлора. Если бы он выделялся в виде газа, то его вес был бы в 5 раз больше, чем вес современной атмосферы нашей планеты. В океанах содержится около 2.6х1016 метрических тонн хлора, в основном в виде хлорида натрия (NaCl).
Это очень токсичный газ. Воздействие небольшого количества Cl, даже в течение короткого времени, может быть смертельным. При концентрации хлора в воздухе 3000 мг/м3 гибель человека наступает всего после нескольких вдохов.
Он также растворяется в воде, поэтому солдаты во время химических атак могли защитить себя от отравления дыша через влажные тряпки.
Он относится к группе галогенных элементов. Это второй самый легкий галоген после фтора. Как и другие галогены, он является чрезвычайно реактивным элементом, который легко образует анион. Из-за его высокой реакционной способности, он содержится в соединениях. Более того, встретить свободный газообразный хлор в природе невозможно.
Он необходим человеческому организму. В организме человека он находится в виде хлорид-иона, где он регулирует осмотическое давление и pH, и способствует нормальной работе пищеварительной системы. Этот элемент попадает в человеческий организм преимущественно с солью (NaCl).
Чистый хлор получают в основном электролизом соленой воды. Он используется для очистки воды, для отбеливания, дезинфекции, обработки текстиля, а также для создания множества соединений. Что касается соединений, то к ним относятся хлораты, хлороформ, синтетический каучук и т. д.
Соединения хлора используют в медицине, пластмассах, антисептиках, инсектицидах, красках, продуктах питания и т. д.
Природный хлор состоит их двух стабильных изотопов: хлора-35 и хлора-37. Что касается хлор-35, то на его долю приходится 76% от естественного содержания элемента. Хлор-37, соответственно, занимает долю в 24%.
РЕКЛАМА
Каменная соль (она же поваренная соль) известна человечеству уже несколько тысяч лет. С древних времен соль была настоящей ценностью для людей.
В 1774 году шведский химик Карл Вильгельм Шееле смог создать зеленовато-желтоватый газ, который он не смог распознать как отдельный элемент. Он полагал, что в нем присутствует кислород. Истинная природа хлора как элемента была признана в 1810 году английским химиком Гемфри Дэви, который дал ему название хлор от греческого «chloros», которое дословно переводится как «желтовато-зеленый».
Сам по себе хлор не является легковоспламеняющимся газом. Однако он может вступать во взрывоопасные реакции или образовывать взрывоопасные соединения с другими химическими веществами, такими как хлорид аммония и т.д.
Это очень активный элемент. Он сочетается со всеми элементами, кроме благородных газов. Благородные газы входят в 18-ю группу периодической таблицы. Реакция между Cl и другими элементами может быть энергичной. Например, он вступает во взрывоопасную реакцию с водородом, с образованием хлороводорода (HCl). Сам по себе он не горит, однако как и кислород, он является хорошим окислителем.
Земную кору составляет сравнительно небольшое число элементов. Приблизительно 50% приходится на кислород, а 25% на кремний. Остальные элементы занимают оставшиеся 25%. Среди эти элементов встречается и хлор. Он является 21-м самым распространенным элементом в земной коре. На его долю приходится 0.2%.
Признаками нехватки хлора в организме человека являются следующие симптомы: сильное потоотделение в жару или во время физических нагрузок, рвота, расстройство пищеварительной системы, проблемы с моче-выделительной системой. Также, при нехватке этого элемента в организме, человек чувствует себя вялым, сонным, слабым и т. д. Стоит отметить, что он является девятым самым распространенным элементом в человеческом организме.
Стоит отметить, что противоядия от отравления хлором нет. Если произошел контакт с жидким хлором, то нужно сразу же дезактивировать кожу и глаза обильным количеством воды.
Отравление газообразным хлором лечат с помощью увлажненного кислорода, бронходилататорами и т. д.
Рекомендуем также прочитать: Интересные факты о сере
Он играет важную роль в строительной сфере. Посмотрите на ваши дома. Этот элемент был использован в производстве бетона, краски для дома, стекловолоконной изоляции и нейлонового коврового покрытия, а также пластиковых окон, водопроводных труб и напольной плитки. Практически все материалы, которые используются для строительства зданий были созданы с помощью хлора.
На этом наша статья подошла к концу, уважаемые посетители. Надеемся информация из публикации была для вас полезной и интересной. До скорых встреч.
Хлор (Cl)
Хлор является элементом основной группы VII и получил свое название от цвета газообразного хлора “хлорос” (зеленый). Это зелено-желтый, очень ядовитый газ с резким запахом. Хлор плохо растворяется в воде, 0,5% раствор называется хлорированной водой. Хлор тяжелее воздуха (примерно в 2,5 раза).
Хлор является очень реактивным газом и образует большое количество органических и неорганических соединений. Наиболее важными неорганическими соединениями являются хлористый водород, соляная кислота и встречающиеся в природе хлориды металлов, которые служат сырьем для производства многих химикатов и продуктов, например, каустическая сода, ПВХ, силиконов, моющих средств, пестицидов и средств от сорняков (гербицидов).
История
Хлор был открыт Карлом Вильгельмом Шееле в 1774 году.
Свойства
Желто-зеленый, негорючий, едкий газ, в 2,5 раза тяжелее воздуха. Хлор очень реактивен и вытесняет бром и йод из их водородных и металлических связей. Вступает в реакцию со многими другими элементами с образованием хлоридов. Умеренно растворим в воде, используется для хлорирования воды.
Смеси хлора и водорода (газообразный хлор-кислород) взрываются при воздействии тепла или света.
Нахождение в природе
Хлор не существует в природе в элементарной форме, но главным образом как анион Cl — (хлорид), который является очень реакционноспособным элементом. Но есть и природные органические соединения хлора (соли) с ковалентной связью. Например, хлорид натрия и хлорид калия можно найти во многих крупных солевых отложения. Хлориды составляют примерно 0,05% объема земной коры.
Производство
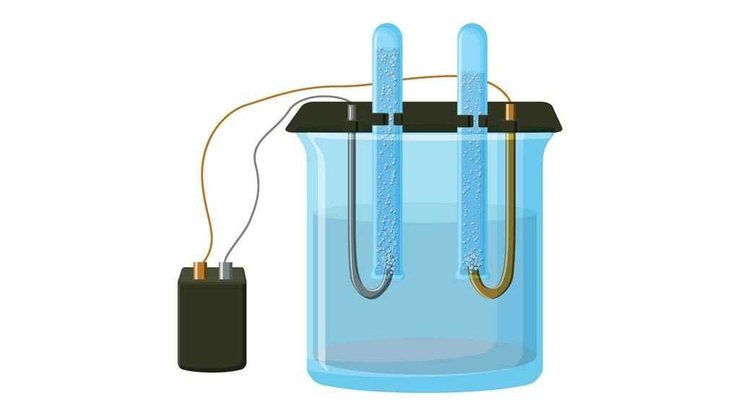
В промышленном масштабе, хлор получают с помощью так называемого хлорно-щелочного электролиза в виде хлорида натрия — раствора или расплава:
Соляная кислота, которая образуется в ходе реакции хлора с органическими углеводородами, также может быть использована в качестве исходного сырья. Которая может быть преобразована обратно в хлор с помощью электрического тока в водном растворе:
До появления электролитического процесса применялось прямое окисление хлористого водорода с кислородом или воздухом:
Эту равновесную реакцию проводили на катализаторах на основе хлорида меди (II) (CuCl2). Из-за крайне агрессивной реакционной смеси, этот технологический процесс был связан с большими трудностями.
В лабораторных условиях хлор можно получить реакцией перманганата калия с концентрированной соляной кислотой
Реакцией диоксида марганца с концентрированной соляной кислотой
Реакцией хлорной извести с концентрированной соляной кислотой
Физические свойства
При нормальных условиях хлор является газообразным веществом. Обладает едким, резким запахом и классифицируется как токсичный. Хлор относительно растворим в воде: 0,0921 моль растворяется в одном литре при 25 С при нормальном атмосферном давлении.
Этот водный раствор хлора называют хлористый водород и содержит небольшие количества соляной кислоты.
Химические свойства
Хлор не горит в воздухе, но он является одним из наиболее реактивных элементов в периодической таблице. Даже при нормальной температуре он реагирует с многочисленными элементами, многими органическими и неорганическими соединениями.
Реакции хлора
Наряду с фтором хлор является одним из самых реактивных элементов. Это мощный окислитель. Даже при комнатной температуре хлор реагирует со многими элементами, выделяя большое количество тепла (экзотермические реакции). С щелочными, щелочноземельными и другими металлами образует ионные соединения, соли металлов.
Неметаллы, такие как водород и фосфор, полуметаллы, такие как бор и кремний, реагируют с хлором с образованием молекулярных соединений. Поскольку хлор является очень реактивным элементом, он часто встречается в природе. Огромные солевые месторождения в основном содержат минералы каменную соль (NaCl), сильвин (KCl) или сильвинит. Количество хлоридов, растворенных в Мировом океане, почти неизмеримо, если учесть, что морская вода состоит в основном из хлоридных солей.
Изотопы
Природный хлор представляет собой смесь двух стабильных изотопов: 35 Cl и 37 Cl.
Соединения хлора
Хлороводород
Важными неорганическими соединениями хлора являются хлористый водород и хлориды. Хлороводород состоит из одного атома хлора и одного атома водорода, которые связаны полярной атомной связью. Бесцветен, имеет резкий запах, негорюч и хорошо растворяется в воде.
Газообразный хлористый водород менее реактивен, чем его водный раствор соляной кислоты.
Соляная кислота
Соляная кислота является сильной кислотой, потому что молекула HCl полностью диссоциирует на ионы водорода и ионы хлора в водном растворе. Соляная кислота реагирует с основными металлами в окислительно-восстановительной реакции с образованием водорода и хлоридов металлов. Она легко растворяет ряд оксидов и карбонатов металлов и поэтому может использоваться для очистки металлов (травление) и удаления накипи.
Обычными коммерческими формами являются разбавленная соляная кислота (около 7%), концентрированная соляная кислота (около 30%) и дымящая соляная кислота (около 37%). Как сильная неорганическая кислота, соляная кислота используется во многих отраслях промышленности. Помимо обработки металлов, она служит сырьем для производства различных соединений хлора, нейтрализации щелочных сточных вод и для кислотной обработки источников нефти и газа.
Хлориды
Хлориды — это соединения соляной кислоты. Хлориды образуются в результате окислительно-восстановительной реакции соляной кислоты с основными металлами, с оксидами металлов или в результате реакции нейтрализации гидроксидами металлов. Хлориды обычно хорошо растворяются в воде и диссоциируют на положительно заряженные катионы и хлорид-анионы.
Важными ионными хлоридами являются хлорид натрия и хлорид калия. Хлорид натрия из солевых отложений известен как каменная соль. Лишь небольшая часть полученной каменной соли используется как поваренная соль для наших блюд и как консервант для рыбных и мясных продуктов. В химической промышленности хлорид натрия используется в качестве сырья, например производства соляной кислоты, каустической соды, хлора.
Хлорид калия и другие соли калия, полученные из него, такие как сульфат калия, являются важными минеральными удобрениями, содержащими ионы калия. Который является основным сельхозудобрением.
Органические соединения
Помимо неорганических, существует огромное количество органических соединений хлора, например хлорированные углеводороды, хлорангидриды, хлорированные ароматические соединения, такие как хлорбензол. Однако это почти исключительно антропогенные соединения, созданные человеком. В природе же существует лишь несколько органических соединений хлора.
Применение
Крупнейшими потребителями хлора являются компании, производящие этилендихлорид и другие хлорированные растворители, поливинилхлорид (ПВХ), хлорфторуглероды и оксиды пропилена. На бумажных фабриках хлор используется для отбеливания бумаги. Компании водоснабжения и водоотведения используют хлор для дезинфекции воды.
Около 30% хлора используется в химической промышленности, около 25% требуется для производства ПВХ, 20% для очистки воды, 15% используется в растворителях и около 10% в отбеливателях.
Этот элемент также необходим для производства лекарств, силиконов и полимеров. Хлор также входит в состав бытовых отбеливателей, средств для удаления краски, антипиренов и пестицидов.
Другие применения соединений хлора:
Высокая реакционная способность (является активным окислителем) привела к использованию хлора в качестве отбеливателя (например, в бумажной промышленности). Сейчас в этой роли все чаще используют перекись водорода, из-за вредного воздействия хлора на окружающую среду.
Хлор используется в качестве недорогого дезинфицирующего средства для питьевой воды. Получающаяся в результате хлорноватистая кислота убивает практически все вирусы и бактерии. Так называемый хлорный эффект (депо) имеет преимущество перед другими агентами. То есть после добавления хлора в водопровод, он оказывает дезинфицирующее действие на трубопроводную сеть еще в течение длительного времени. Большинство общественных бассейнов используют хлор в качестве дезинфицирующего средства.
Строительство
В прошлом в кирпичную кладку иногда добавляли хлорсодержащий антифриз. Выцветание хлоридов на необработанных кирпичных поверхностях может быть результатом неправильного подкисления. Кладка должна быть тщательно влажной перед подкислением, а после обработки ее следует быстро и обильно промыть.
Цель состоит в том, чтобы преобразовать CaCO3 (нерастворимый в воде раствор), который уже застыл с разбавленной соляной кислотой, в растворимый и моющийся хлорид кальция.
Хлорсодержащие материалы, применяемые в строительстве и быту:
Биологическое значение
Физиологически, хлор имеет большое значение в ионной форме хлорида как минерала. Употребляется в пищу в основном в форме поваренной соли (хлорид натрия). Ежедневно человек потребляет от 3 до 12г соли, которая выводится через почки и пот.
Хлорид натрия необходим для выработки желудочной кислоты, поддержания осмоса в организме, а также для проводимости нервных импульсов.
Обнаружение
Хлор и вода
Среднее содержание хлора в морской воде составляет около 20 000 частей на миллион (2%). Концентрация в речной воде обычно составляет около 8 частей на миллион. Хлор — один из самых реактивных элементов, поэтому он легко вступает в реакцию с водой, образуя соляную кислоту и гипохлорит.
Растворимость газообразного хлора в воде составляет около 6,3 г / л при стандартных условиях. Считается, что соли хлора также легко растворяются в воде.
Как хлор может попасть в воду?
Хлор естественным образом содержится в некоторых минералах, таких как галит, сильвин и карналлит. Он не встречается в природе в свободной форме, а только в соединениях, в основном в виде хлорида натрия (поваренная соль). Поваренную соль получают в основном из галита, но ее также можно извлечь из морской воды.
Использование противообледенительных солей на дорогах и человеческих экскрементов в городских сточных водах быстро приводит к увеличению количества хлоридов в воде и почве.
Какие экологические проблемы может вызвать загрязнение воды хлором?
Концентрация хлоридов в нормальных почвах колеблется в пределах 50-2000 ppm. Самые высокие концентрации соли можно найти в засушливых и полузасушливых районах, а также в районах, расположенных недалеко от моря.
Растения поглощают хлорид через свои корни, а газообразный хлор через надземные части растения. У растения часто наблюдается скопление хлоридов в цитоплазме. Содержание хлора в растениях обычно составляет около 2000-20 000 частей на миллион. Некоторые деревья, такие как чинары или дубы, могут спокойно переносить относительно высокие концентрации солей хлора в почве.
В водных процессах часто происходят взаимодействия между хлоридом и железом, что имеет место, например, в фотохимических процессах. Также интересно, что хлорид натрия в частицах морской соли может реагировать с оксидами азота, образуя атомы хлора, которые могут разрушать озон.
Опасность для здоровья
При попадании на слизистые оболочки, образуются хлорноватистая и соляная кислоты. В зависимости от концентрации, вдыхание приводит к раздражению слизистых оболочек, кашлю и одышке, а также к удушью.
Попадание жидкого хлора может вызвать ожоги как слизистых оболочек, так и кожи.
Газообразный хлор крайне токсичен при вдыхании, раздражает дыхательные пути, глаза, кожу и пищеварительный тракт. Вызывает повреждение легких с тяжелыми хроническими последствиями, различные сердечно-сосудистые заболевания. Концентрация хлора около 0,5% в воздухе смертельна для человека. Концентрация около 0,001% уже может вызывать симптомы отравления.
Одно из научных исследований установило, что хлорированная вода увеличивает риск рака мочевого пузыря на 35 процентов. Плавание в хлорированной воде увеличивает опасность уже на 57 процента. Негативные эффекты зависят от концентрации хлора, продолжительности и частоты приема, а также от состояния здоровья человека.
Техника безопасности
Хранить контейнеры, содержащие хлор, плотно закрытыми в хорошо проветриваемом месте, вдали от открытого огня, тепла и солнечного света, а также влаги. При входе в помещение с газообразным хлором всегда надевать защитные респираторы.
Замена баллона с газообразным хлором возможна только при защите рук (защитные перчатки) и органов дыхания (полнолицевая маска с кислородным фильтром или автономный дыхательный аппарат). После каждой замены баллона необходимо проверять герметичность фитингов и предохранять баллоны от опрокидывания (фиксация на кронштейне).
Первая помощь при отравлении хлором
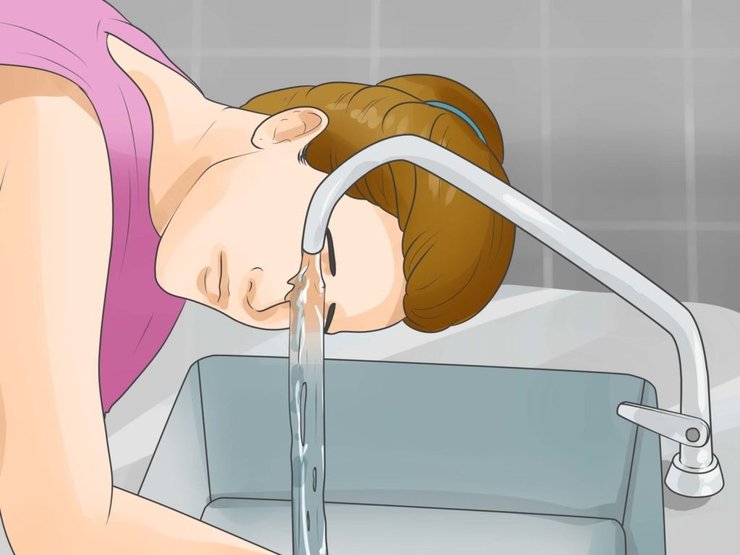
При попадании в глаза: промыть под проточной водой в течение 10–15 минут с широко открытым веком. Затем немедленно обратиться к офтальмологу.
Экология
Использование многих продуктов, содержащих хлор, экологически сомнительно. С одной стороны, электролитическое производство хлора требует больших затрат энергии. Однако гораздо важнее то, что многие продукты, содержащие хлор, могут нанести вред окружающей среде и здоровью человека.
Причина заключается в том, что из-за недостатка природных органических соединений хлора очень немногие микроорганизмы специализируются на разложении этих соединений в ходе эволюции. Следствием этого является то, что эти неприродные соединения часто остаются в окружающей среде в течение очень долгого времени, поскольку они химически очень стабильны. Если соединения хлора затем попадают в пищевую цепь, то накапливаются в организме в конечных звеньях цепи (биоаккумуляция).
При утилизации хлорорганических соединений и пластиковых отходов из ПВХ образуются очень ядовитые диоксины и другие ядовитые соединения хлора, загрязняющие окружающую среду.