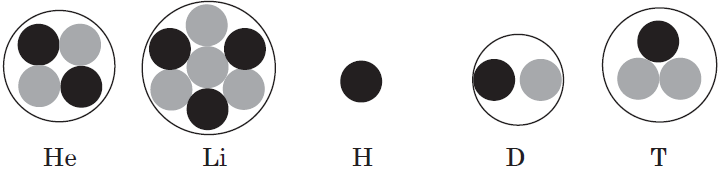
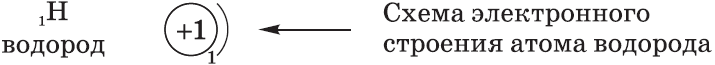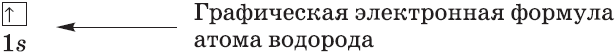Как выглядит электронная формула в химии
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
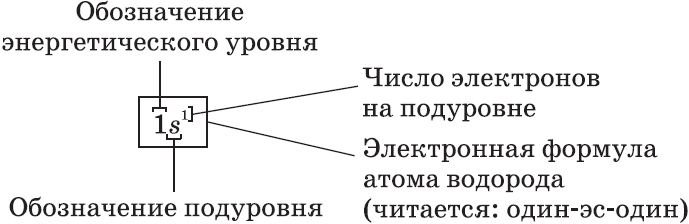
Электронная конфигурация атома
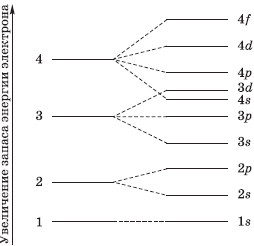
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
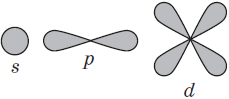
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Электронная конфигурация атома
Теория к заданию 1 из ЕГЭ по химии
Понятие атом возникло еще в античном мире для обо значения частиц вещества. В переводе с греческого атом означает «неделимый».
Электроны
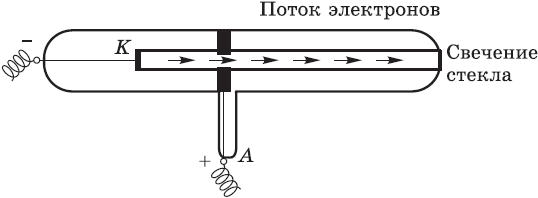
Томсон и Перрен соединяли полюса источника тока с двумя металлическими пластинами — катодом и анодом, впаянными в стеклянную трубку, из которой был откачан воздух. При подаче на пластины-электроды напряжения около 10 тысяч вольт в трубке вспыхивал светящийся разряд, а от катода (отрицательного полюса) к аноду (положительному полюсу) летели частицы, которые ученые сначала назвали катодными лучами, а затем выяснили, что это был поток электронов. Электроны, ударяясь об особые вещества, нанесенные, например, на экран телевизора, вызывают свечение.
Был сделан вывод: электроны вырываются из атомов материала, из которого сделан катод.
Свободные электроны или поток их можно получить и другими способами, например, при накаливании металлической проволоки или при падении света на металлы, образованные элементами главной подгруппы I группы таблицы Менделеева (например, цезий).
Состояние электронов в атоме
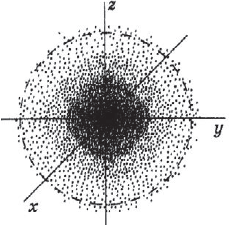
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона в пространстве, в котором он находится. Мы уже знаем, что электрон в атоме не имеет траектории движения, т.е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра. Он может находиться в любой части этого пространства, окружающего ядро, и совокупность различных положений его рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точки. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек больше всего.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня электроны последующих уровней характеризуются большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внеш него уровня.
Число энергетических уровней (электронных слоев) в атоме равно номеру периода в системе Д. И. Менделеева, к которому принадлежит химический элемент: у атомов элементов первого периода один энергетический уровень; второго периода — два; седьмого периода — семь.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один под уровень; второй — два; третий — три; четвертый — четыре. Подуровни, в свою очередь, образованы орбиталями.
Главное квантовое число, типы и число орбиталей, максимальное число электронов на подуровнях и уровнях.
Ядро атома
Но не только электроны входят в состав атомов. Физик Анри Беккерель обнаружил, что природный минерал, содержащий соль урана, тоже испускает неведомое излучение, засвечивая фотопленки, закрытые от света. Это явление было названо радиоактивностью.
Различают три вида радиоактивных лучей:
Следовательно, атом имеет сложное строение — состоит из положительно заряженного ядра и электронов.
Как же устроен атом?
Расчеты показали, что наблюдаемые явления могли произойти, если бы вся масса атома и весь его положительный заряд были сосредоточены в крохотном центральном ядре. Радиус ядра, как выяснилось, в 100 000 раз меньше радиуса всего атома, той его области, в которой находятся электроны, имеющие отрицательный заряд. Если применить образное сравнение, то весь объем атома можно уподобить стадиону в Лужниках, а ядро — футбольному мячу, расположенному в центре поля.
Атом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Резерфордом, называют планетарной.
Протоны и нейтроны
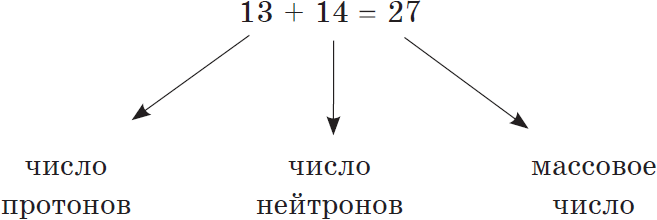
Оказывается, и крошечное атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов.
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus — ядро).
Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое число атома алюминия:
Например, число нейтронов в атоме железа равно:
В таблице представлены основные характеристики элементарных частиц.
Основные характеристики элементарных частиц.
Изотопы
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами.
Слово изотоп состоит из двух греческих слов: isos — одинаковый и topos — место, обозначает «занимающий одно место» (клетку) в Периодической системе элементов.
Химические свойства изотопов хлора совершенно одинаковы, как и изотопов большинства химических элементов, например калия, аргона:
Теперь можно дать современное, более строгое и научное определение химическому элементу.
Химический элемент — это совокупность атомов с одинаковым зарядом ядра.
Строение электронных оболочек атомов элементов первых четырех периодов
Рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И. Менделеева.
Элементы первого периода.
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
Электронные формулы атомов показывают распределение электронов по энергетическим уровням и под уровням.
Графические электронные формулы атомов показывают распределение электронов не только по уровням и под уровням, но и по орбиталям.
Элементы второго периода.
Элементы третьего периода.
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d-под уровни.
Строение электронных оболочек атомов элементов третьего периода.
| Символ элемента, порядковый номер, название | Схема электронного строения | Электронная формула | Графическая электронная формула |
| $↙<11> | 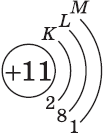 | $1s^2<2>s^2<2>p^6<3>s^1$ | 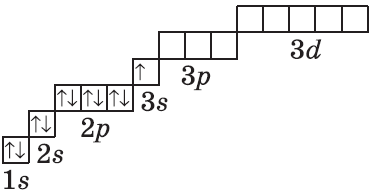 |
| $↙<13> | 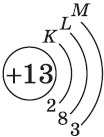 | $1s^2<2>s^2<2>p^6<3>s^2<3>p^1$ | 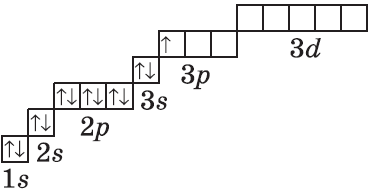 |
| $↙<18> | 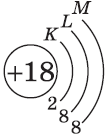 | $1s^2<2>s^2<2>p^6<3>s^2<3>p^6$ | 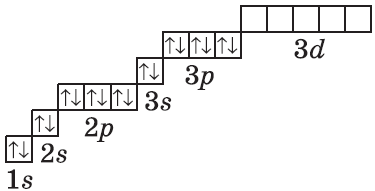 |
Элементы четвертого периода.
$4f$-элементы называют лантаноидами.
$5f$-элементы называют актиноидами.
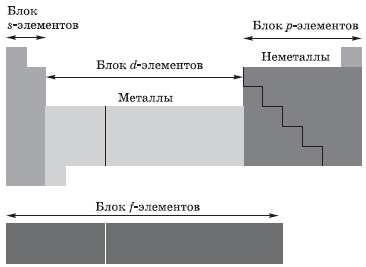
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства, или блока:
Электронная конфигурация атома. Основное и возбужденное состояние атомов
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т.е. электроны с противоположными спинами.
На рисунке показана схема деления энергетических уровней на подуровни.
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, т.е. записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул, например:
Очень часто строение электронных оболочек атомов изображают с помощью энергетических, или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, и лишь затем спариваются, но спины при этом, по принципу Паули, будут уже противоположно направленными.
Электронная и электронно-графическая формула
Что такое электронная и электронно-графическая формула
Наиболее часто электронные формулы записывают для атомов в основном или возбужденном состоянии и для ионов.
Существует несколько правил, которые необходимо учитывать при составлении электронной формулы атома химического элемента. Это принцип Паули, правила Клечковского или правило Хунда.
Составление электронной и электронно-графической формулы
При составление электронной формулы следует учитывать, что номер периода химического элемента определяет число энергетических уровней (оболочек) в атоме, а его порядковый номер количество электронов.
Согласно правилу Клечковского, заполнение энергетических уровней происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равных значениях этой суммы – в порядке возрастания n:
При заполнение электронами энергетических подуровней также необходимо соблюдать правило Хунда: в данном подуровне электроны стремятся занять энергетические состояния таким образом, чтобы суммарный спин был максимальным, что наиболее наглядно отражается при составлении электронно-графических формул.
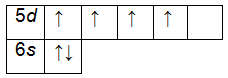
Электронно-графические формулы обычно изображают для валентных электронов. В такой формуле все электроны помечаются стрелочками, а ячейками (квадратиками) – орбитали. В одной ячейке не может находиться более двух электронов. Рассмотрим на примере ванадия. Сначала записываем электронную формулу и определяем валентные электроны:
Внешний энергетический уровень атома вольфрама содержит 6 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Примеры решения задач
| Задание | Изобразите электронную и электронно-графическую формулу химического элемента алюминия. |
| Ответ | Алюминий имеет порядковый номер 13 и расположен в третьем периоде Периодической системы Д.И. Менделеева, следовательно, атом этого химического элемента состоит из положительно заряженного ядра, внутри которого находится 13 протонов, а вокруг ядра имеется три оболочки, по которым движутся 13 электронов. |
Электронная формула алюминия выглядит следующим образом:
На внешнем энергетическом уровне алюминия находится три электрона, все электроны 3-го подуровня. Электронно-графическая формула имеет следующий вид:
| Задание | Изобразите электронную и электронно-графическую формулу химического элемента хлора. |
| Ответ | Хлор имеет порядковый номер 18 и расположен в третьем периоде Периодической системы Д.И. Менделеева, следовательно, атом этого химического элемента состоит из положительно заряженного ядра, внутри которого находится 17 протонов, а вокруг ядра имеется три оболочки, по которым движутся 17 электронов. |
Электронная формула хлора выглядит следующим образом:
На внешнем энергетическом уровне атома хлора находится семь электронов, все они считаются валентными. Электронно-графическая формула имеет следующий вид:
Электронная формула элемента.
Алгоритм составления электронной формулы элемента:
2. По номеру периода, в котором расположен элемент, определите число энергетических уровней; число электронов на последнем электронном уровне соответствует номеру группы.
3. Уровни разбить на подуровни и орбитали и заполнить их электронами в соответствии с правилами заполнения орбиталей:
1. Составим электронную формулу азота. В периодической таблице азот находится под №7.
Энергетическая диаграмма азота.
2. Составим электронную формулу аргона. В периодической таблице аргон находится под №18.
1s 2 2s 2 2p 6 3s 2 3p 6 .
Энергетическая диаграмма аргона.
3. Составим электронную формулу хрома. В периодической таблице хром находится под №24.
Энергетическая диаграмма цинка.
4. Составим электронную формулу цинка. В периодической таблице цинк находится под №30.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10
Обратим внимание, что часть электронной формулы, а именно 1s 2 2s 2 2p 6 3s 2 3p 6 – это электронная формула аргона.
Электронную формулу цинка можно представить в виде:
Электронная формула химических элементов
Что такое электронная формула
Наиболее часто электронные формулы записывают для атомов в основном или возбужденном состоянии и для ионов.
Существует несколько правил, которые необходимо учитывать при составлении электронной формулы атома химического элемента. Это принцип Паули, правила Клечковского или правило Хунда.
При составление электронной формулы следует учитывать, что номер периода химического элемента определяет число энергетических уровней (оболочек) в атоме, а его порядковый номер количество электронов.
Согласно правилу Клечковского, заполнение энергетических уровней происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равных значениях этой суммы – в порядке возрастания n:
При заполнение электронами энергетических подуровней также необходимо соблюдать правило Хунда: в данном подуровне электроны стремятся занять энергетические состояния таким образом, чтобы суммарный спин был максимальным (это наиболее наглядно отражается при составлении электронно-графических формул).
Примеры решения задач
| Задание | Запишите электронные формулы атомов элементов с атомными номерами 7, 16, 21. |
| Ответ | Химический элемент с атомным номером 7 – это азот. Он находится во втором периоде, следовательно, имеет две орбитали. Расположение азота в V группе Периодической таблицы свидетельствует о наличии на внешнем энергетическом уровне 5-ти валентных электронов: |
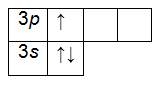
Химический элемент с атомным номером 16 – это сера. Она находится в третьем периоде, следовательно, имеет три орбитали. Расположение серы в VI группе Периодической таблицы свидетельствует о наличии на внешнем энергетическом уровне 6-ти валентных электронов:
Химический элемент с атомным номером 21 – это скандий. Он находится в четвертом периоде, следовательно, имеет четыре орбитали. Расположение скандия в III группе Периодической таблицы свидетельствует о наличии на внешнем энергетическом уровне 3-х валентных электронов: