Как выглядит хлора в химии
Хлор как химический элемент таблицы Менделеева
Как был открыт Хлор
История такого химичнского элемента как хлор начинается очень давно. Известно, что о каменной соли, которая является соединением натрия и хлора было известно еще в 3 тысячелетии до нашей эры. В тоже время рассол из каменной соли использовался около 8000 лет назад. В какой то период времени каменная соль использовалась в качестве валюты. Есть подтверждения того, что во времена Римской Империи с генералами за услучи расчитывались именно каменной солью. Элементарный хлор впервые был выделен в районе 1200 года с открытием царской водки. Это умозаключение сделано из соображений того, что в это время было открыто расщепление золота царской водкой. Как известно одним из продуктов этой химической реакции является именно газообразный хлор. В то время никто не установил, что образовавшийся желто-зеленый газ является новым химическим веществом.
Сегодня большая часть ученого мира приписывает открытие именно Карлу Шееле. Это обосновывается тем, что он назвал этот газ «дефлорированным воздухом» или воздухом из соляной кислоты. В те времена общепринятая химическая теория гласила, что кислота подразумевает собой соединение с кислородом. Поэтому в будующем такие ученые как Клод Бертолле, Джозеф Луи Гей-Люссак и Луи Жак Тенар пытались отделить из этого газа новый химический элемент. Успехом эти эксперименты не закончились. В 1810 году сэр Хэмфри Дэви попробовал сам провести этот эксперимент и сделал заключение что желтовато-зеленый газ является не соединением, а новым химическим элементом.
Где и как добывают Хлор
Хлор является одним из важнейших коммерческих химических элементов на нашей планете. Его годовое производство составляет около 90 млн тонн. Способов получения хлора большое множество, но почти все они основываются на электрохимических реакциях. В небольших количествах его можно получить и химическими способами, но для масштабного производства ни один из них не применяется. Хлор является побочным продуктом при производстве таких металлов как натрий и магний.
Исходным материалом для производства хлора электрохимическими методами являются водные растворы хлорида натрия. Различаются только конструктивное исполнение установок для производства. Самым важным моментом является то, чтобы анод на котором образуется хлор был отделен от катода, на котором образуются ионы водорода и гидроксида. Если они будут объединены в сосуде, то при химической реакции будет образовываться взрывоопасная смесь оксигидрохлорид хлора.
На сегодняшний день самым распространенным методом получения хлора является «диафрагменный метод». На установке между электродами находится асбестовая диафрагма, которая пропускает через себя ионы натрия, но оставляет ионы хлора и гидроксида. Этот метод составляет около 49% рынка производства хлора.
Следующим по популярности идет «мембранный процесс». Отличием является то, что вместо асбестовой диафрагмы используется пластиковая мембрана. Доля этого процесса на мировом рынке составляет около 28%.
Ну и заключительным процессом является «процесс амальгамы». Этот процесс используется значительно реже, чем остальные. Доля его рынка составляет около 18% от общего, но отличия тут более существенные. В этом процессе электроды полностью разделены. Для этого используется ртутный катод, который из-за высокого перенапряжения позволяет образовывать натрий вместо водорода, который присутствует в виде амальгамы натрия. Этот метод позволяет получить продукт хорошей чистоты, но он требует больших затрат защитные меры из-за опасности ртути.
Существует еще очень много методов получения хлора, но эти три на сегодняшний день делят большие доли рынка.
Распространенность Хлора
Хлор является довольно распространенным химическим веществом. Во Вселенной масса его молекул ориентировочно составляет 0,0001% от общей массы. Если рассматривать Землю, то тут его процент содержания еще выше. Из-за его высокой реакционной способности в свободном виде он почти не встречается. В свободном виде его можно встретить только в вулканическом газе и в озоновом слое. Его концентрация даже там очень невелика.
На Земле хлор встречается в основном в виде хлоридов. В пример можно поставить те же хлорид натрия и хлорид магния. По распространенности среди химических элементов он занимает 19 позицию. Многие хлориды хорошо растворяются в воде и поэтому хлор является очень распостраненным элементом в Мировом океане. По предварительным оценкам масса атомов хлора составляет около 2% от общей массы Мирового океана. Самая высокая концентрация хлора среди морей и океанов наблюдается в «Мертвом море». Что же касается хлоросодержащих минералов, то тут самыми популярными являются галит, сильвин, карналлит, бишофит и каинит. Хлоросодержащих минералов известно более 2200 вариаций, но самыми ценными являются галит и сильвин.
Применение Хлора
Не смотря на широкую распространенность хлора, его применение не очень однозначное. С одной стороны, большая часть добываемого хлора (около 85%) поступает в химическую промышленность. В которой его используют для производства других хлоросодержащих соединений. С другой стороны из хлора создаются более 15000 соединений, которые применяются почти повсеместно. Они затрагивают такие отрасли как медицина, пищевая промышленность, военная промышленность, строительная деятельность и многие другие. Около 63% хлора уходит на производство органических соединений, 18% на производство неорганических соединений, а оставшиеся 19% на отбеливание и дезинфекцию. Если не углубляться, то самыми популярными веществами производимыми из хлора являются винилхлорид, поливинилхлорид(ПВХ), метилхлорид, хлороформ, хлорбензол, гипохлорит натрия и кальция. Последние два (гипохлорит натрия и кальция) используются для дезинфекции помещений. В пример можно поставить бассейны, места общего пользования, а также все помещения больниц и тюрем.
Интересные факты
Интересных фактов связанных с таким химическим элементом как хлор достаточно много. Стоит начать с того, что хлор является важным элементом для организма человека. Если быть конкретнее, то он играет важную роль в обмене веществ. Хлор необходим для образования и воспроизведения соляной кислоты в желудке человека, а так же для насосных функций в клетках организма. С другой стороны хлор является токсичным газом, который может нанести значительный вред организму человека. Хлор атакует в первую очередь слизистые оболочки организма, такие как дыхательные пути, глаза и кожу.
Хлор элемент. Свойства хлора. Применение хлора
19 граммов на литр. Таково содержание хлора в морской воде. Норма для водопроводной – не более 1,5 грамма на литр. Для обеззараживания этого достаточно. Почему такая разница? Причина в соли, растворенной в океанах.
По химическому составу она является хлоридом натрия. В одном литре морской воды на него приходятся 35 граммов.
Не удивительно, что 19 из них – хлор. В мире его, как видно, немало. Велика и роль. Кто-то элемент боится, а кто-то понимает, что без него никак. Чтобы утвердиться в принятой позиции, или поменять ее, ознакомимся с фактами.
Свойства хлора
Хлор – элемент газообразный. Цвет у него желто-зеленый. Название 17-го элемента с греческого так и переводиться. Однако, ткани и бумагу вещество отбеливает. Правда, для этого нужна хлорноватистая кислота – итог взаимодействия хлора с водой.
В 18-ом веке, когда 17-е вещество только открыли, говорили «хлорная вода», не зная о том, что имеют дело с кислотой.
В начале 19-го века ей начали ополаскивать свои руки медики. Такая практика была введена, к примеру, в одном из госпиталей Вены. Врачи, конечно, не хотели отбелить руки. Хлорная вода служила обеззараживающим средством.
Способность 17-го элемента убивать болезнетворные бактерии заметили в конце 18-го столетия.
Раствор хлора – одно из примерно 200-от его соединений. В чистом виде элемент не встречается. Причина – высокая химическая активность. Вещество обязательно вступает во взаимодействие с «соседями». Однако, чистый хлор, все же, получен.
Первый удачный опыт проведен в 1774-ом году Карлом Шеелем. Это шведский химик. Он соединил соляную кислоту с пиролюзитом оксида марганца.
Понадобились предосторожности в работе с газом, ведь он токсичен. Если хлор попадает в легкие, то вызывает удушье и ожоги. Поэтому, в дыхательной системе, точнее в ее кровотоках, находят лишь соединения хлора. Общее содержание 17-го вещества в организме человека – 0,25% от массы.
Интересно! Хлор – хим. элемент, обнаруженный в большем количестве в телах профессиональных пловцов. Они, как говорится, не вылезают из бассейнов. Вода в них хлорирована и, видимо, ионы вещества просачиваются в кровоток.
Жидкий хлор – часть соляной кислоты, находящейся в желудке человека. 17-ый элемент в реагенте играет не только обеззараживающую роль, но и расщепляет пищу.
Получается, хлор, опасный в газообразном состоянии, приносит пользу в виде соединений, к примеру, той же поваренной соли.
Как видно, роль хлора весьма относительна. Он может быть благом, а может и ядом. В последнем амплуа элемент использовали немецкие войска.
Применение хлора
Хлор – химический элемент, используемый для производства соляной кислоты, не только в желудке.
Соляную кислоту с помощью 17-го вещества получают и вне организма. Соединение пригождается при дублении и окрашивании кож, на производстве активированного угля, синтетических красителей и органических полупродуктов.
Без хлора не обойтись и в гальванопластике. В составе соляной кислоты элемент нужен при изготовлении различных клеев и гидролизного спирта.
Обеззараживающая характеристика элемента пригождается теперь не в госпиталях, а в обработке водопроводной воды.
Ее хлорирование применяется больше века. Появилась альтернатива – озонирование. Хлор воду обеззараживает, но может негативно влиять на организм. Ресурсоснабжающие организации волнует еще и то, что 17-е вещество разъедает трубы.
Следовательно, сети чаще требуют ремонта и замены. Это убытки. Однако, пока, озонирование – лишь перспектива, а не реалии сегодняшнего дня.
Метод затратнее хлорирования, а результаты обработки воды не столь впечатляющие. В металлургии активный хлор участвует в процессах получения ниобия, титана, тантала. Это редкие и ценные металлы, так что у 17-го элемента важная роль. Уважают вещество и аграрии. Они закупают хлорорганические соединения.
С их помощью борются с сорняками. Чтобы отравление хлором «не заработали» и культурные растения, они должны быть двудольными. Реагент пагубно действует лишь на однодольные побеги. Содержат хлор и инсектициды. Эти соединения направлены уже на вредителей-насекомых.
Инсектициды убивают их избирательно, оставляя нетронутыми растения и полезные микроорганизмы. Потребность человеческого организма – 800 миллиграммов в сутки. Получают их не только из соли.
Продукты содержащие хлор
Помогут морская рыба, а так же, яйца, стручковый горох, гречка и рис. Рыбу заменяют устрицами и морскими огурцами.
Ионы хлора из них поддерживают осмотическое равновесие систем организма и регулируют водно-соляной обмен. Орган, в котором сосредоточенна основная масса 17-го элемента – кожа. Хлор в ней должен постоянно обновляться, поскольку выводится с потом и мочой.
В них переходит почти столько же вещества, сколько потребляется. Поэтому, хлор должен присутствовать в рационе всегда.
Добыча хлора
Методы 18-го века в 21-ом не актуальны. Вместо использованного когда-то Карлом Шееле оксида марганца и соляной кислоты применяют обычные соль и воду. Натрий хлор растворяют и подвергают действию электрического тока.
Не нужно ни специального оборудования, ни тары, ни повышенных температур. Современный метод прост и дешев. Сколько хлора произвести диктует спрос. Так, в 1970-е миру требовались 20 000 000 тонн в год.
Тогда, в производстве основных неорганических продуктов 17-ый элемент занял 5-е место. Позиция осталась прежней, но объем потребления вырос. На 2015-ый год — около 28 000 000 тонн. Это и хлор для бассейна, и хлористый винил, и пестициды, и растворители, и хлор в таблетках.
Последние растворяют в воде и используют, как моющее и обеззараживающее средство.
Половину хлора производят в Соединенных Штатах. Это обосновано потребностью в 17-ом веществе самой Америки.
В год внутренняя промышленность потребляет около 12 000 000 тонн реагента. Весома роль на рынке и у Великобритании. Производят, в основном, соединения 17-го элемента, к примеру, кислоты хлора.
Если говорить не об искусственном получении хлора и его производстве, а о добычи в природе, то она сводится к выработке каменной соли. Получается, месторождения 17-го вещества разрабатывали еще 3000-4000 лет назад. Тогда, добывать соль начали на землях современной Ливии.
Общее количество хлора в земных недрах – всего 0,017%. Получается, при активной добыче есть возможность истощения ресурсов. Так что, в далекой перспективе стоимость 17-го элемента может возрасти. А какова она на данный момент?
Цена хлора
Хлор купить в чистом виде можно канистрами. Как правило, это 30-литровая тара. В нее вмещаются 34 килограмма хлора. Это указывает на тяжесть вещества, даже в газообразном состоянии. Цена канистры со сжиженным хлором 1500-1800 рублей.
Остальная продукция основана на соединениях 17-го элемента, поэтому, стоимость, порой, непредсказуема. Ценник зависит от производителя, разрекламированности товара, его транспортировки, затрат на синтез, или добычу основы.
Так, белизну можно купить и за 13, и за 45 рублей. На отбеливающие порошки, собственно, столь же весомый разброс цен. Речь и о стиральных, и о чистящих составах. Средство для плиты, к примеру, предлагают и за 20, и за 80 рублей. Причем, объем одинаков. Обычно, это 500 граммов.
Интересно! Многие хлорсодержащие средства можно использовать в качестве изоляторов.
Сжиженный элемент №17 проводит электрический ток в миллиард раз хуже дистиллированной воды. Можно поаплодировать сему факту. Но, услышать авиации придется с запозданием. Дело в том, что звук тоже «вязнет» в хлоре, распространяясь в полтора раза медленнее, чем в атмосферном воздухе.
Хлор (Cl, Chlorine)
История хлора
В 1774 году Карл Шееле, химик из Швеции, впервые получил хлор, но считалось, что это не отдельный элемент, а разновидность соляной кислоты (calorizator). Элементарный хлор был получен в начале XIX века Г. Дэви, который разложил поваренную соль на хлор и натрий путём электролиза.
Общая характеристика хлора
Хлор (от греческого χλωρός – зелёный) является элементом XVII группы периодической таблицы химических элементов Д.И. Менделеева, имеет атомный номер 17 и атомную массу 35,452. Принятое обозначение Cl ( от латинского Chlorum).
Нахождение в природе
Хлор является самым распространённым в земной коре галогеном, чаще всего в виде двух изотопов. В силу химической активности встречается лишь в виде соединений многих минералов.
Физические и химические свойства
Хлор является ядовитым жёлто-зелёным газом, имеет резкий неприятный запах и сладковатый вкус. Именно хлор после его открытия предложили называть галогеном, в одноимённую группу он входит как один из самых химически активных неметаллов.
Суточная потребность в хлоре
В норме взрослый здоровый человек должен получать в сутки 4-6 г хлора, потребность в нём возрастает при активных физических нагрузках или жаркой погоде (при повышенном потоотделении). Обычно суточную норму организм получает из продуктов питания при сбалансированном рационе.
Продукты питания богатые хлором
Основным поставщиком хлора в организм является поваренная соль – особенно, если она не подвергается термической обработке, поэтому лучше солить уже готовые блюда. Также хлор содержат яйца, морепродукты, мясо, горох, фасоль и чечевица, гречка и рис, оливки.
Взаимодействие с другими
Кислотно-щелочной и водный баланс организма регулируется калием, натрием и хлором.
Признаки нехватки хлора
Нехватка хлора вызвана процессами, приводящими к обезвоживанию организма – сильное потоотделение в жару или при физических нагрузках, рвота, диарея и некоторые заболевания моче-выделительной системы. Признаками недостатка хлора являются вялость и сонливость, слабость в мышцах, явная сухость во рту, потеря вкусовых ощущений, отсутствие аппетита.
Признаки избытка хлора
Признаками избытка хлора в организме являются: повышение кровяного давления, сухой кашель, боль в голове и в груди, резь в глазах, слезотечение, расстройства деятельности желудочно-кишечного тракта. Как правило, переизбыток хлора может быть вызван употреблением обычной воды из-под крана, которая проходит процесс дезинфекции хлором и случается у работников тех отраслей промышленности, которые напрямую связаны с использованием хлора.
Полезные свойства хлора и его влияние на организм
Хлор в организме человека:
Применение хлора в жизни
Основное применение хлора – химическая промышленность, где с его помощью изготавливают поливинилхлорид, пенопласт, материалы для упаковки, также боевые отравляющие вещества и удобрения для растений. Обеззараживание питьевой воды хлором – практически единственный доступный способ очистки воды.
Основные сведения о хлоре как химическом элементе
История открытия хлора
Хлор — химический элемент с атомным номером 17. Принадлежит к 17-й группе периодической таблицы химических элементов, находится в третьем периоде таблицы. Обозначается символом Cl. Активный неметалл. Галоген. Молекула хлора состоит из двух атомов. Кристаллическая решетка хлора ромбическая. Молярная масса хлора (M (Cl)) составляет 35,446-35,457 г/моль.
Ковалентная связь хлора:
В 1772 году Джозеф Пристли впервые получил первое соединение с хлором — газообразный хлороводород.
В 1774 году хлор был получен шведским ученым Вильгельмом Шееле, который описал выделение хлора при взаимодействии пиролюзита с соляной кислотой: 4 H C l + M n O 2 = C l 2 + M n C l 2 + 2 H 2 O
Шееле вывел хлор со следующими характеристиками:
Однако Вильгельм, используя теорию флогистона, сделал предположение о том, что хлор состоит из дефлогистированной муриевой (соляной) кислоты.
В 1810 году Г. Дэви с помощью процесса электролиза разложил поваренную соль на хлор и натрий, тем самым доказав элементарную природу хлора. В 1811 году ученый предложил новое название для элемента — «хлорин». А спустя год Ж. Гей-Люссак доработал окончательное название, которое мы используем по сей день — хлор. В 1811 также Иоганн Швейгер хотел предложить для хлора название галоген, но вскоре для всей 17 группы элементов закрепился этот термин.
В 1826 году химиком Йёнсом Якобом Берцелиусом была определена точная атомная масса хлора 35,446. 35,457 а. е. м
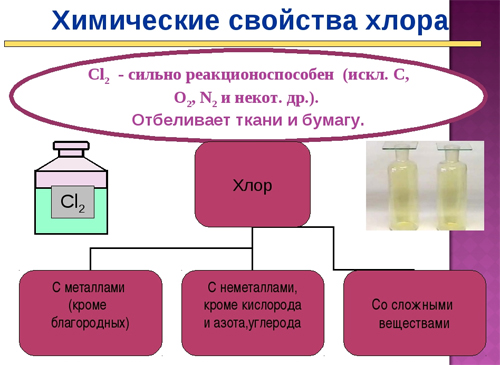
Физические и химические свойства
К физическим свойствам хлора относят:
К химическим свойствам относят:
C l 2 + 2 H B r → B r 2 + 2 H C l — при таких реакциях хлор вытесняет бром из соединений с водородом или металлом;
2 N a + C l 2 → 2 N a C l — при взаимодействии натрия и хлора мы получаем хлорид натрия;
2 F e + 3 C l 2 → 2 F e C l 3 — при взаимодействии железа и хлора мы получим хлорид железа(III);
C l 2 + H 2 O ⇄ H C l + H C l O
C l 2 + 2 N a O H → N a C l + N a C l O + H 2 O ;
H 2 + C l 2 → 2 H C l ;
Строение электронной оболочки
Электронная оболочка — совокупность всех электронов в атоме, которые окружают ядро.
На валентном уровне атома хлора содержится 1 неспаренный электрон: 1s2 2s2 2p6 3s2 3p5. За счет присутствия в атоме хлора незанятой орбитали d-подуровня, атом хлора может проявлять и прочие степени окисления.
Обратимся к схеме возбужденных состояний атомов хлора:
| Валентность | Возможные степени окисления | Электронное состояние валентного уровня | Пример соединений |
|---|---|---|---|
| I | +1, −1, 0 | 3s2 3p5 | NaCl, NaClO, Cl2 |
| III | +3 | 3s2 3p4 3d1 | NaClO2 |
| V | +5 | 3s2 3p3 3d2 | KClO3 |
| VII | +7 | 3s1 3p3 3d3 | KClO4 |
Нахождение в природе
Биологическая роль хлора
Ионы хлора жизненно необходимы растениям, потому что они участвуют в энергетическом обмене у растений. Человек потребляет 5-10 г NaCl в сутки. Каждый день с пищей человек получает 3-6 г хлора, что абсолютно покрывает потребность в этом элементе откуда-либо из внешней среды.
Хлорные каналы присутствуют во многих типах митохондриальных мембран, скелетных мышцах и клетках. Эти каналы выполняют исключительные функции в нормализации объема жидкости, участвуют в поддержании кислотно-щелочного баланса — рН клеток. Всасывание хлора происходит в толстой кишке.
Получение и применение хлора
Получение хлора в химии
Хлор, который производят, хранится в специальных «танках» или закачивается в стальные баллоны высокого давления. Баллоны с жидким хлором под давлением имеют специальную окраску — болотный цвет.
В настоящее время химические методы получения хлора не используют, так как они являются очень ресурсозатратными и малоэффективными.
Метод Дикона
В 1867 году ученым химиком Диконом был разработан метод получения хлора каталитическим окислением хлороводорода кислородом воздуха: 4 H C l + O 2 → 2 H 2 O + 2 C l 2 ↑
Современные лабораторные методы
На данный момент хлор используется в лабораториях в баллонах.
Для того чтобы получить небольшое количество хлора, обычно используют процессы, основанные на окислении хлороводорода более сильными окислителями. Чаще всего это перманганат калия или диоксид марганца: 2 K M n O 4 + 16 H C l → 2 K C l + 2 M n C l 2 + 5 C l 2 ↑ + 8 H 2 O
Электрохимические методы
При невозможности использования сжиженного хлора в баллонах, используют электрохимические методы.
В промышленности применяются три варианта электрохимического метода: два из них — электролиз с твердым катодом, третий — электролиз с жидким ртутным катодом (ртутный метод производства). При таких методах качество получаемого хлора почти не отличается.
Мембранный метод
Мембранный метод производства хлора наиболее энергоэффективен, но при этом довольно сложен в организации и эксплуатации.
В мембранном методе катодное и анодное пространства полностью разделены непроницаемой для анионов катионообменной мембраной. Поэтому в мембранном электролизере два потока.
В анодное пространство поступает поток раствора соли. А в катодное — деионизированная вода. Все потоки предварительно очищаются от всевозможных примесей.
Применение хлора
Реакции с органическими веществами
Замещение атомов водорода в молекулах О В :
Ароматические соединения замещают атом водорода на хлор в присутствии катализаторов: C 6 H 6 + C l 2 → C 6 H 5 C l + H C l