Как выглядит модель атома азота
Строение атома азота
Общие сведения о строении атома азота
Порядковый номер равен 7. Заряд ядра равен +7. Атомный вес – 14,007а.е.м. В природе встречаются два изотопа азота: 14 N — 99,635 % и 15 N — 0,365 % (в скобках указано их процентное соотношение).
Электронное строение атома азота
Атом азота имеет две оболочки, как и все элементы, расположенные во втором периоде. Номер группы –V – свидетельствует о том, что на внешнем электронном уровне атома азота находится 5 валентных электронов.
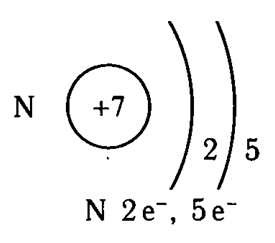
Рис. 1. Схематичное строение атома азота.
Электронная конфигурация основного состояния записывается следующим образом:
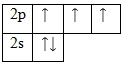
Азот – элемент p-семейства. Энергетическая диаграмма для валентных электронов в невозбужденном состоянии выглядит следующим образом:
Возбужденного состояния нет. По числу неспаренных электронов можно сказать, что азот в соединениях проявляет валентность III. Однако, валентность так же определяется по номеру группы (V), следовательно, азот может проявлять две валентности – III и V.
Рис. 2. Пространственное изображение строения атома азота.
Примеры решения задач
| Задание | Назовите элементы, атомы которых имеют электронные конфигурации: |
а) ls 2 2s 2 2p 6 3s 2 3p 3 ;
б) ls 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 ;
а) всего 15 электронов, значит это фосфор;
б) всего 22 электрона, значит это титан;
в) всего 25 электронов, значит это марганец;
г) всего 72 электрона, значит это гафний.
| Задание | Распределите электроны по энергетическим уровням и подуровням в атомах: |
8 O 1s 2 2s 2 2p 4
9 F 1s 2 2s 2 2p 5
10 Ne 1s 2 2s 2 2p 6
18 Ar 1s 2 2s 2 2p 5 3s 2 2p 6
в) 24 Cr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1
Азот, свойства атома, химические и физические свойства
Азот, свойства атома, химические и физические свойства.
14,00643-14,00728* 1s 2 2s 2 2p 3
Азот — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 7. Расположен в 15-й группе (по старой классификации — главной подгруппе пятой группы), втором периоде периодической системы.
Атом и молекула азота. Формула азота. Строение азота:
Азот (фр. azote, по наиболее распространённой версии, от др.-греч. ἄζωτος – «безжизненный») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением N и атомным номером 7. Расположен в 15-й группе (по старой классификации — главной подгруппе пятой группы), втором периоде периодической системы.
Азот самый лёгкий элемент периодической таблицы химических элементов Д. И. Менделеева из группы пниктогенов.
Азот – химически весьма инертный неметалл.
Азот обозначается символом N.
Как простое вещество азот (химическая формула N2) при нормальных условиях представляет собой двухатомный газ без цвета, вкуса и запаха. В жидком состоянии азот – бесцветная, подвижная, как вода, жидкость, а в твёрдом – представляет собой белоснежные кристаллы или снегоподобную массу.
Молекула азота двухатомна.
Химическая формула азота N2.
Строение атома азота. Атом азота состоит из положительно заряженного ядра (+7), вокруг которого по атомным оболочкам движутся семь электронов. При этом 2 электрона находятся на внутреннем уровне, а 5 электронов – на внешнем. Поскольку азот расположен во втором периоде, оболочки всего две. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внешняя оболочка представлена s- и р-орбиталями. Два спаренных электрона находится на 1s-орбитали, вторая пара электронов – на 2s-орбитали. На 2р-орбитали находятся три неспаренных электрона. В свою очередь ядро атома азота состоит из семи протонов и семи нейтронов. Азот относится к элементам p-семейства.
Радиус атома азота (вычисленный) составляет 56 пм.
Атомная масса атома азота составляет 14,00643-14,00728 а. е. м.
Азот – один из самых распространённых элементов на Земле. Азот – основной компонент воздуха. Он занимает 78, 084 % его объёма и 75,5 % по массе.
Молекула азота крайне прочна. Атомы азота связаны прочными тройными связями. Даже при высокой температуре молекула азота N2 слабо диссоциирует на атомарный азот. При 3000 °C на атомарный азот диссоциирует 0,1 % молекулярного азота, при 5000 °C – несколько процентов. Переход в атомарное состояние вызывается также полем высокочастотного электрического разряда при сильном разрежении газообразного азота или под действием солнечного излучения в высоких слоях атмосферы.
Атомарный азот намного активнее молекулярного.
Изотопы и модификации азота:
Свойства азота (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Азот |
| 102 | Прежнее название | |
| 103 | Латинское название | Nitrogenium |
| 104 | Английское название | Nitrogen |
| 105 | Символ | N |
| 106 | Атомный номер (номер в таблице) | 7 |
| 107 | Тип | Неметалл |
| 108 | Группа | Пниктоген |
| 109 | Открыт | Даниэль Резерфорд, Великобритания, 1772 г. |
| 110 | Год открытия | 1772 г. |
| 111 | Внешний вид и пр. | Газ без цвета, запаха и вкуса |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 4 аллотропные модификации: – α-азот с простой кубической кристаллической решёткой, – β-азот с гексагональной плотноупакованной кристаллической решёткой, – «чёрный» азот |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 75,5 % |
| 119 | Содержание в земной коре (по массе) | 0,002 % |
| 120 | Содержание в морях и океанах (по массе) | 0,00005 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,1 % |
| 122 | Содержание в Солнце (по массе) | 0,1 % |
| 123 | Содержание в метеоритах (по массе) | 0,14 % |
| 124 | Содержание в организме человека (по массе) | 2,6 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 14,00643-14,00728 а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 3 |
| 203 | Электронная оболочка | K2 L5 M0 N0 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 56 пм |
| 205 | Эмпирический радиус атома* | 65 пм |
| 206 | Ковалентный радиус* | 71 пм |
| 207 | Радиус иона (кристаллический) | N 3- 0,026 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-азот |
| 512 | Структура решётки | Простая кубическая |
| 513 | Параметры решётки | 5,661 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | Pa3 или P213 |
| 517 | Номер пространственной группы симметрии | |
| 521 | Кристаллическая решётка #2 | β-азот |
| 522 | Структура решётки | Гексагональная плотноупакованная |
| 523 | Параметры решётки | a = 3,93 Å, c = 6,50 Å |
| 524 | Отношение c/a | 1,653 |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | P63/mmc |
| 527 | Номер пространственной группы симметрии | 194 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7727-37-9 |
201* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
205* Эмпирический радиус атома азота согласно [3] составляет 92 пм.
206* Ковалентный радиус азота согласно [1] и [3] составляет 71±1 пм и 75 пм соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) азота согласно [4] составляет 0,721 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) азота согласно [3] и [4] составляет 5,57 кДж/моль и 5,59 кДж/моль соответственно.
410* Молярная теплоемкость азота согласно [3] составляет 29,125 Дж/(K·моль).
Строение атома азота – электронная схема
Азот (N) – газ, содержание которого в атмосфере составляет около 78 %. Азот входит в состав аминокислот и нуклеотидов. Строение атома азота определяет физические и химические свойства элемента.
Строение
Азот – седьмой элемент периодической таблицы, расположенный в пятой группе и втором периоде. Относительная атомная масса равна 14. В природных условиях встречаются два изотопа азота – 14N и 15N.
Рис. 1. Азот в таблице Менделеева.
Азот состоит из ядра с зарядом +7 и семи электронов, распределённых по двум энергетическим уровням. Нахождение элемента в пятой группе указывает на количество электронов на внешнем уровне и высшую валентность. В невозбуждённом состоянии на внешнем энергетическом уровне находится три электрона, поэтому азот может проявлять две валентности – III и V.
Запись электронного строения атома азота – 1s22s22p3 или +7 N)2)5.
Физические свойства
Рис. 2. Жидкий и твёрдый азот.
Химические свойства
Атомы азота соединены тройной связью (N ≡ N), что обеспечивает максимальную прочность. Даже при нагревании азота до 3000°C наблюдается незначительное разложение молекул (до 0,1 % от взятого количества газа). Именно поэтому азот – химически малоактивный элемент. В соединениях при нагревании азот легко расстаётся с другими элементами.
Основные химические свойства азота приведены в таблице.
Взаимодействие
Продукт реакции
Пример
С металлами (реагирует с сильными восстановителями)
Окисление под действием электрического тока
С водородом в присутствии катализатора (Fe), под действием температуры (400 °С) и давления (200 атм)
С неметаллами при высоких температурах
Соединения азота с металлами и неметаллами называются нитридами.
Азот не реагирует с кислотами, водой и основаниями. Невозможно непосредственное взаимодействие молекул азота с серой и галогенами. Более активно с этими веществами при нормальных условиях реагирует атомарный азот.
Применение
Несмотря на пассивность азота, элемент широко применяется в промышленности. Кроме того, азот входит в состав клеток, без него невозможно построение белка и ДНК.
Рис. 3. Азот в составе ДНК.
Азот используется при производстве:
Жидкий азот используется для охлаждения, заморозки, а также для окисления двигателей ракет. Оксид азота применяется в качестве наркоза и для производства аэрозолей.
Что мы узнали?
Рассмотрели схему строения азота, его физические, химические свойства, применение. Азот состоит из положительно заряженного ядра и двух электронных оболочек, на которых находится семь электронов. Азот – малоактивный газ. Молекула азота состоит из двух атомов элемента, соединённых тройной связью. Азот может находиться в трёх агрегатных состояниях. Элемент реагирует с некоторыми металлами, неметаллами и кислородом. Азот используется в промышленности, медицине, сельском хозяйстве. Кроме того, азот входит в состав живых организмов.
Азот: что это такое, молярная масса, строение атома, характеристика
Азот — что это за элемент в химии
Азот — является элементом, расположенным в главной подгруппе V группы (или в 15 группе в современной форме периодической системы химических элементов Д.И. Менделеева) и во втором периоде.
Азот относят к пниктогенам, он представляет собой один из самых распространенных элементов на нашей планете.
В основном состоянии азот обладает следующей электронной конфигурацией:
Азот в природном мире можно обнаружить в виде простого вещества газа N2. Молекула N2 неполярная. По этой причине в воде азот практически не растворяется. В молекуле азота атомы соединены тройной связью, в связи с тем, что каждый атом в молекуле обладает тремя неспаренными электронами. Одна из трех связей является σ-связью (сигма-связью), и две — π-связями.
Схема образования молекулы азота:
Структурно-графическая формула молекулы азота имеет вид: N≡N
Схема перекрывания электронных облаков при образовании молекулы азота:
Простое вещество N2 — двухатомный газ, без цвета, вкуса и запаха. Вещество обладает химической инертностью, вступает в химические реакции с комплексными соединениями переходных металлов.
Азот N2 является ключевым компонентом воздуха: составляет 78% от общего объема атмосферного воздуха. В промышленности азот получают путем разделения (фракционирования) воздуха, свыше ¾ от массы производимого в промышленности азота используют для получения аммиака. Простое вещество N2 применяют в качестве инертной среды для реализации разнообразных технологических процессов. Жидкий азот играет роль хладагента.
Азот представляет собой один из ключевых биогенных элементов, который входит в компонентный состав белков и нуклеиновых кислот. В земной коре азот встречатеся преимущественно в виде нитратов — солей азотной кислоты.
Первооткрыватели
У азота нет конкретного ученого, который считался бы первооткрывателем этого элемента. Точнее есть, но несколько. Выяснить, кому именно принадлежат лавры открытия, сейчас уже невозможно.
1772 год — важный год для химического элемента. Сразу четверо ученых вплотную приблизились к открытию азота. Это и британский химик Генри Кавендиш, и первооткрыватель кислорода Джозеф Пристли, и шведский химик-фармацевт Карл Шееле, и шотландский химик Даниэль Резерфорд. Все они в одно и то же время проводили различные исследования и эксперименты с газами. Эти люди близко подошли к открытию нового химического элемента. Но выделить кого-то из них в качестве однозначного первооткрывателя нельзя.
Степень окисления азота
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Химические свойства азота
Химический элемент азот образует только одно простое вещество. Данное вещество является газообразным и образовано двухатомными молекулами, т.е. имеет формулу N2. Не смотря то, что химический элемент азот имеет высокую электроотрицательность, молекулярный азот N2 является крайне инертным веществом. Обусловлен данный факт тем, что в молекуле азота имеет место крайне прочная тройная связь (N≡N). По этой причине практически все реакции с азотом протекают только при повышенных температурах.
Взаимодействие азота с металлами
Единственное вещество, которое реагирует с азотом в обычных условиях – литий:
Интересным является тот факт, что с остальными активными металлами, т.е. щелочными и щелочноземельными, азот реагирует только при нагревании:
Взаимодействие азота с металлами средней и низкой активности (кроме Pt и Au) также возможно, однако требует несравнимо более высоких температур.
Нитриды активных металлов легко гидролизуются водой:
Взаимодействие азота с неметаллами
Азот реагирует с водородом при нагревании в присутствии катализаторов. Реакция является обратимой, поэтому для повышения выхода аммиака в промышленности процесс ведут при высоком давлении:
Как восстановитель азот реагирует со фтором и кислородом. Со фтором реакция идет при действии электрического разряда:
С кислородом реакция идет под действием электрического разряда или при температуре более 2000 оС и является обратимой:
Из неметаллов азот не реагирует с галогенами и серой.
Взаимодействие азота со сложными веществами
В рамках школьного курса ЕГЭ можно считать, что азот не реагирует ни с какими сложными веществами кроме гидридов активных металлов:
Физические свойства азота

Рис. 1. Атом азота.
Атмосферный азот состоит из двух изотопов: 14N (99.64%) и 15N (0.36%). Известны также радиоактивные изотопы азота 13N и 16N.
Перевод названия элемента «азот» – безжизненный. Это название справедливо для азота, как для простого вещества, но в связанном состоянии он является одним из главных элементов жизни, а также входит в состав белков, нуклеиновых кислот, витаминов и т. д.
Способы получения азота и его применение
Существуют разные способы получения азота. К примеру, в лабораторных условиях вещество синтезируют в процессе химической реакции между растворами хлорида аммония и нитрита натрия. Продуктом реакции обмена является нитрит аммония, который достаточно просто разлагается, что приводит к образованию азота и воды. Колбу заполняют раствором хлорида аммония, а капельную воронку — раствором нитрита натрия. В процессе добавления нитрита натрия в колбу начинает выделяться азот, который собирают с помощью цилиндра. Затем можно посмотреть, сколько газа получено. Горящая лучинка в атмосфере азота гаснет, так проверяют наличие азота в сосуде.
Следующим лабораторным способом получения азота является восстановление оксида меди (II) аммиаком при температуре около 700 °C:
В промышленной сфере азот получают из воздуха. Эффективность промышленного производства зависит от наличия дешевого и доступного сырья определенного класса. Воздух в данном случае представлен в неограниченном количестве и является бесплатным. Азот из воздуха выделяют по нескольким технологиям:
Адсорбционный метод синтеза азота заключается в разделении воздуха на компоненты с помощью связывания твердым веществом, называемым адсорбентом, отдельных компонентов газовой смеси. Принцип работы мембранных систем заключается в создании разницы скоростей проникновения компонентов газа через вещество мембраны. В качестве движущей силы разделения газов выступает разница парциальных давлений на различных сторонах мембраны. Криогенные установки функционируют по методу разделения газовых смесей за счет разности температур кипения компонентов воздуха и различии составов, которые находятся в равновесии жидких и паровых смесей.
Азот используют для выпуска минеральных удобрений, синтеза аммиака, получения инертной атмосферы в лампах, применяют в медицине. Жидкий азот обеспечивает глубокое охлаждение и вымораживание. Полученный с помощью азота аммиак применяют в производстве азотной кислоты, азотсодержащих солей, мочевины и соды, им заправляют холодильное оборудование. Жидкий аммиак и его растворы используют в качестве жидких удобрений, а также в сфере медицины.
С помощью оксида одновалентного азота N2O создают аэрозоли и анестезирующие средства при наркозах. Жидкий диоксид азота NО2играет роль неводного растворителя и окислителя в двигателях космических кораблей. Нитрит натрия нашел широкое применение в органическом синтезе. Данное вещество используют в качестве добавки к колбасным изделиям, которая придает им цвет натурального мяса. Азотная кислота необходима для производства минеральных удобрений, взрывчатых веществ, красителей, пластмасс, искусственных волокон. Концентрированную азотную кислоту используют в ракетной технике, как окислитель топлива для сгорания в двигателях.
Сферы применения азота:
Азот в природе
Азот находится в атмосфере в виде молекул, состоящих из двух атомов. Помимо атмосферы, азот есть в мантии Земли и в гумусном слое почвы. Основной источник азота для промышленного производства – это полезные ископаемые.
Однако в последние десятилетия, когда запасы минералов стали истощаться, возникла острая необходимость выделения азота из воздуха в промышленных масштабах. В настоящее время эта проблема решена, и огромные объемы азота для нужд промышленности добываются из атмосферы.
Роль азота в биологии
Это вещество является одним из основных биогенных элементов и входит в состав важнейших элементов живых клеток — нуклеиновых кислот и белков. Однако количество азота в живых организмах невелико (примерно 1–3 % на сухую массу). Имеющийся в атмосфере молекулярный материал усваивают лишь сине-зеленые водоросли и некоторые микроорганизмы.
Довольно большие запасы этого вещества сосредоточены в почве в виде различных минеральных (нитраты, аммонийные соли) и органических соединений (в составе нуклеиновых кислот, белков и продуктов их распада, включая еще не полностью разложившиеся остатки флоры и фауны).
Растения отлично усваивают азот из грунта в виде органических и неорганических соединений. В природных условиях большое значение имеют особые почвенные микроорганизмы (аммонификаторы), которые способны минерализировать органический N почвы до солей аммония.
Нитратный азот грунта образуется в процессе жизнедеятельности нитрифицирующих бактерий, открытых С. Виноградским в 1890 году. Они окисляют аммонийные соли и аммиак до нитратов. Часть усвояемого флорой и фауной вещества теряется из-за воздействия денитрифицирующих бактерий.
Микроорганизмы и растения отлично усваивают как нитратный, так и аммонийный N. Они активно превращают неорганический материал в различные органические соединения — аминокислоты и амиды (глутамин и аспарагин). Последние входят в состав многих белков микроорганизмов, растений и животных. Синтез аспарагина и глутамина путем амидирования (ферментативного) аспарагиновой и глутаминовой кислот осуществляется многими представителями флоры и фауны.
Производство аминокислот происходит при помощи восстановительного аминирования ряда кетокислот и альдегидокислот, возникающих путем ферментативного переаминирования, а также в результате окисления различных углеводов. Конечными продуктами усвоения аммиака (NH₃) растениями и микроорганизмами являются белки, которые входят в состав ядра клеток, протоплазмы, а также откладываются в виде так называемых запасных белков.
Человек и большинство животных могут синтезировать аминокислоты лишь в довольно ограниченной мере. Они не способны производить восемь незаменимых соединений (лизин, валин, фенилаланин, триптофан, изолейцин, лейцин, метионин, треонин), и потому для них главным источником азота являются потребляемые с пищей белки, то есть, в конечном счете, — собственные белки микроорганизмов и растений.




















:max_bytes(150000):strip_icc()/nitrogen-chemical-element-186451118-5810efe03df78c2c7313e500.jpg)
