Как выглядит нервная ткань рисунок
Нервная ткань
Нейрон
Нейроны обладают 4 свойствами:
Отростки нейронов проводят нервные импульсы и передают их другим нейронам, эффекторам, благодаря чему мышцы сокращаются или расслабляются, а секреция желез усиливается или уменьшается.
Миелиновая оболочка
В миелиновых нервных волокнах отростки нейронов покрыты миелиновой оболочкой (на 70-75% состоит из липидов (жиров)), которая обеспечивает изолированное проведение нервного импульса по нерву. Если бы не было миелиновой оболочки (вообразите!) нервные импульсы распространялись бы хаотично, и, когда мы хотели сделать движение рукой, то вместе с рукой двигалась бы нога.
Миелиновый слой представлен несколькими слоями мембраны глиальной клетки (леммоцит, шванновская клетка), которые закручиваются вокруг осевого цилиндра (отростка нейрона). Это закручивание хорошо видно на картинке, где изображен здоровый нерв, чуть выше 😉
Нейроглия (греч. νεῦρον — волокно, нерв + γλία — клей)
Классификация нейронов
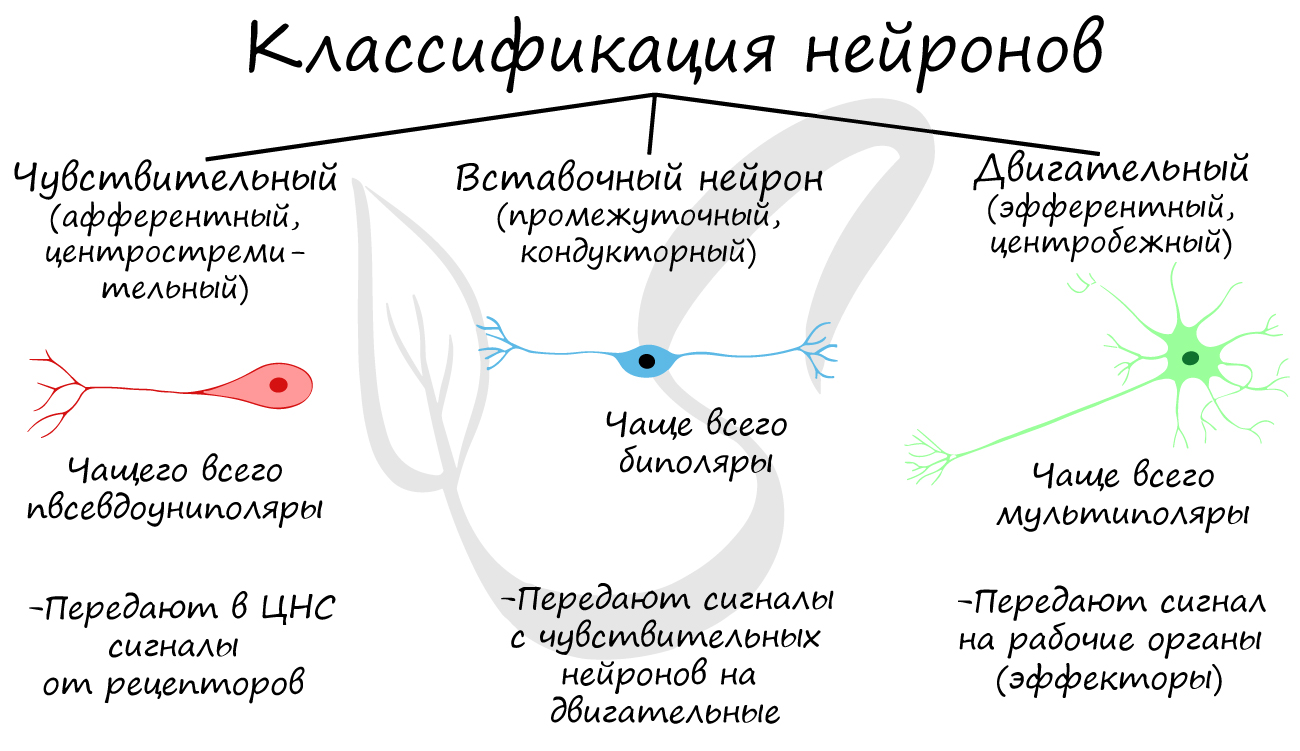
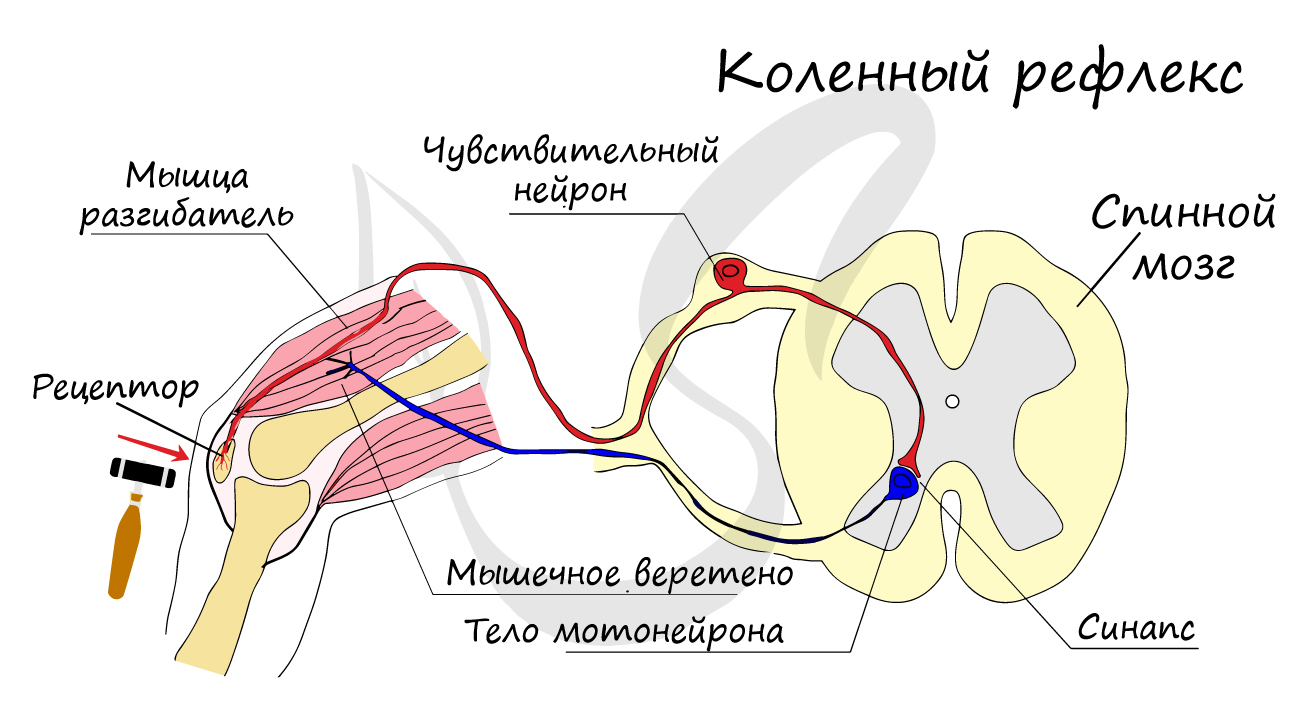
Нейроны функционально подразделяются на чувствительные, двигательные и вставочные.
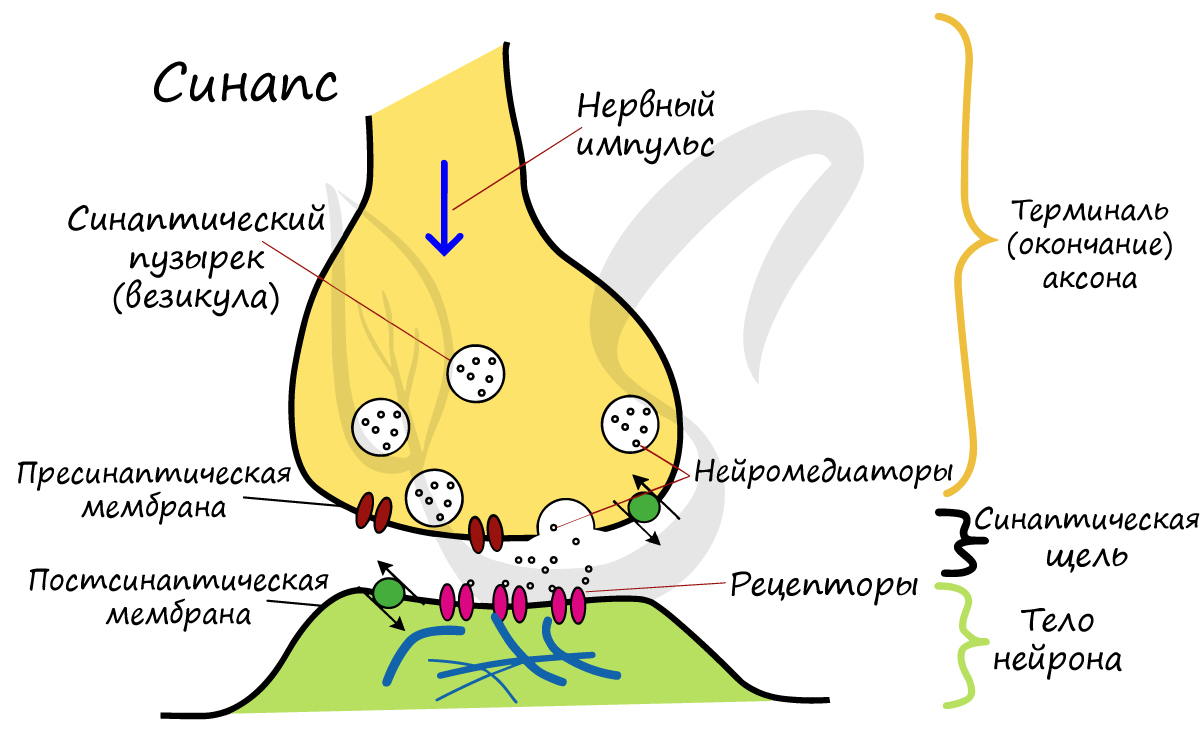
Синапс
Разберем строение синапса на схеме. Его составляют пресинаптическая мембрана аксона, рядом с которой расположены везикулы (лат. vesicula — пузырек) с нейромедиатором внутри (ацетилхолином). Если нервный импульс достигает терминали (окончания) аксона, то везикулы начинают сливаться с пресинаптической мембраной: ацетилхолин поступает наружу, в синаптическую щель.
Попав в синаптическую щель, ацетилхолин связывается с рецепторами на постсинаптической мембране, таким образом, возбуждение (нервный импульс) передается другому нейрону. Так устроена нервная система: электрический путь передачи сменяется химическим (в синапсе).
Яд кураре
Гораздо интереснее изучать любой предмет на примерах, поэтому я постараюсь как можно чаще радовать вас ими 😉 Не могу утаить историю о яде кураре, который используют индейцы для охоты с древних времен.
Нервы и нервные узлы
Болезни нервной системы
Неврологические болезни могут развиваться в любой точке нервной системы: от этого будет зависеть клиническая картина. В случае повреждения чувствительного пути пациент перестает чувствовать боль, холод, тепло и другие раздражители в зоне иннервации пораженного нерва, при этом движения сохранены в полном объеме.
Если повреждено двигательное звено, движение в пораженной конечности будет невозможно: возникает паралич, но чувствительность может сохраняться.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Нервная ткань: строение, функции
Содержание:
Нервная ткань — одна из четырех основных тканей многоклеточных животных и человека. Способна возбуждаться и передавать возбуждение посредством электрических импульсов и химических веществ. Нервная ткань обеспечивает наиболее сложную и точную регуляцию функций организма (в отличие от гормонов).
Нейроны: строение, виды и типы
Нервная ткань содержит клетки нервные клетки и нейроглию (рис. 1). Ткань образует головной и спинной мозг, нервные волокна и узлы. Нервная система отвечает за согласованную работу органов и систем органов, обеспечивает связь организма с окружающей средой.
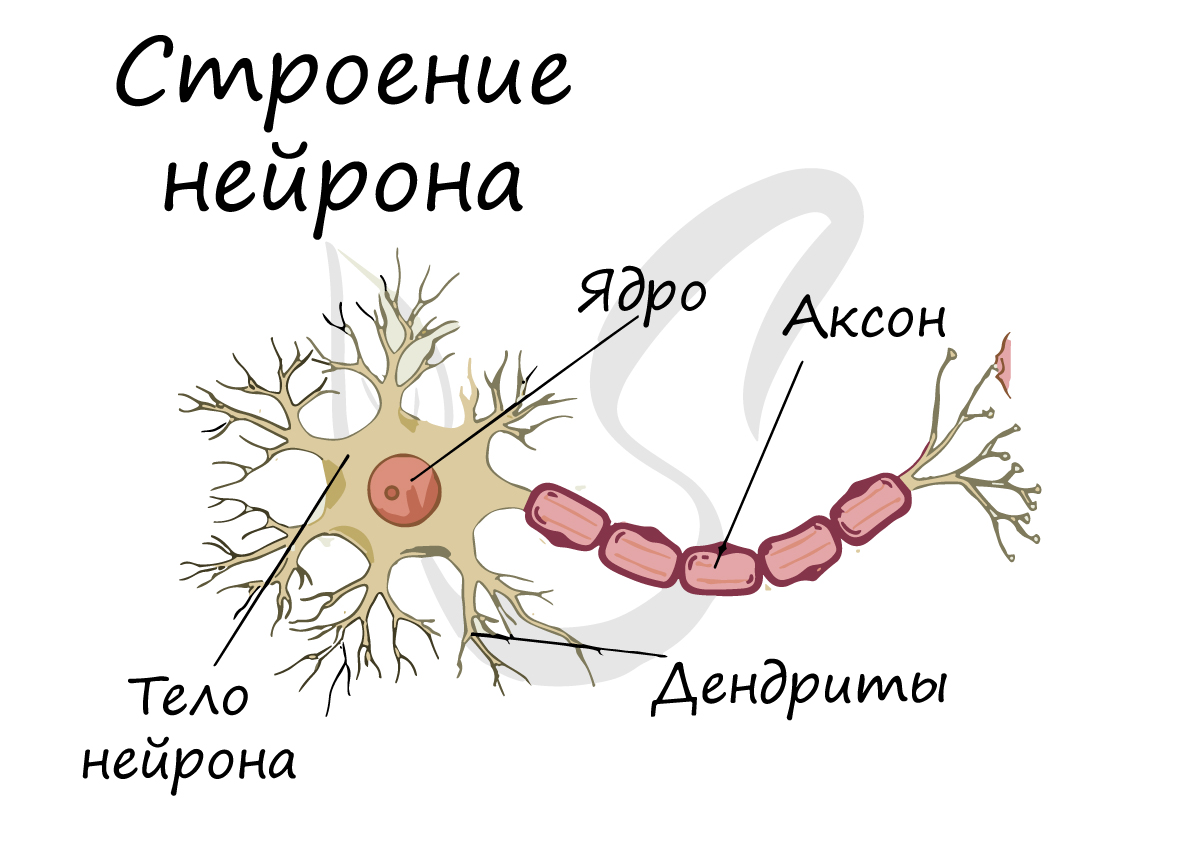
Нейрон — основная, высокоспециализированная клетка нервной ткани. Она осуществляет прием, обработку и передачу информации. Состоит из тела или сомы, в котором заключены ядро с основной массой цитоплазмы, и отростков. Диаметр тела нервной клетки составляет 15–150 мк или 0,001 мм.
Виды нейронов по количеству отростков (рис. 2):
Тела нейронов сконцентрированы, главным образом, в сером веществе головного и спинного мозга. Длинные отростки тянутся на большие расстояния от места, где находятся нервные клетки с ядром. Длина аксона может достигать 1 м и более.
Составные части двигательного (мультиполярного) нейрона (рис. 3):
Типы нейронов в зависимости от выполняемой функции
Основное название
Дополнительные названия
Функции
Проводят информацию об ощущении (импульс) от поверхности тела и внутренних органов в мозг.
Ассоциативные, связывающие, переключающие
Составляют около 99% всех нервных клеток, обрабатывают, анализируют информацию, вырабатывают решения.
Проводят импульс от головного и спинного мозга к исполнительным органам.
Нейроглия
Клетки нейроглии лежат между нейронами и выполняют роль опоры, защиты, питания нервной ткани. Они участвуют в образовании миелиновой оболочки нервных волокон (нервов). Оболочка состоит из шванновских клеток, заполненных жироподобным веществом.
Различают в составе нейроглии астроциты, имеющие звездчатую форму и небольшие размеры. Они имеют многочисленные отростки, входят в состав серого вещества мозга, участвуют в образовании гематоэнцефалического барьера.
Олигодендроциты отвечают за выполнение основных функций нейроглии — опоры, питания, изолирования и регенерации. Микроглия — клетки с 2– отростками, способные к фагоцитозу. Такие клеточные элементы нервной ткани обеспечивают защиту нейронов от чужеродных веществ и тел, удаляют продукты распада.
Нейроглия отличается от нейронов по ряду свойств. Вспомогательные клетки размножаются, но не способны возбуждаться, не образуют и не проводят импульсы. Формирование миелиновых оболочек с помощью шванновских клеток происходит постепенно в первые 3–10 лет жизни.
Свойства нервной ткани
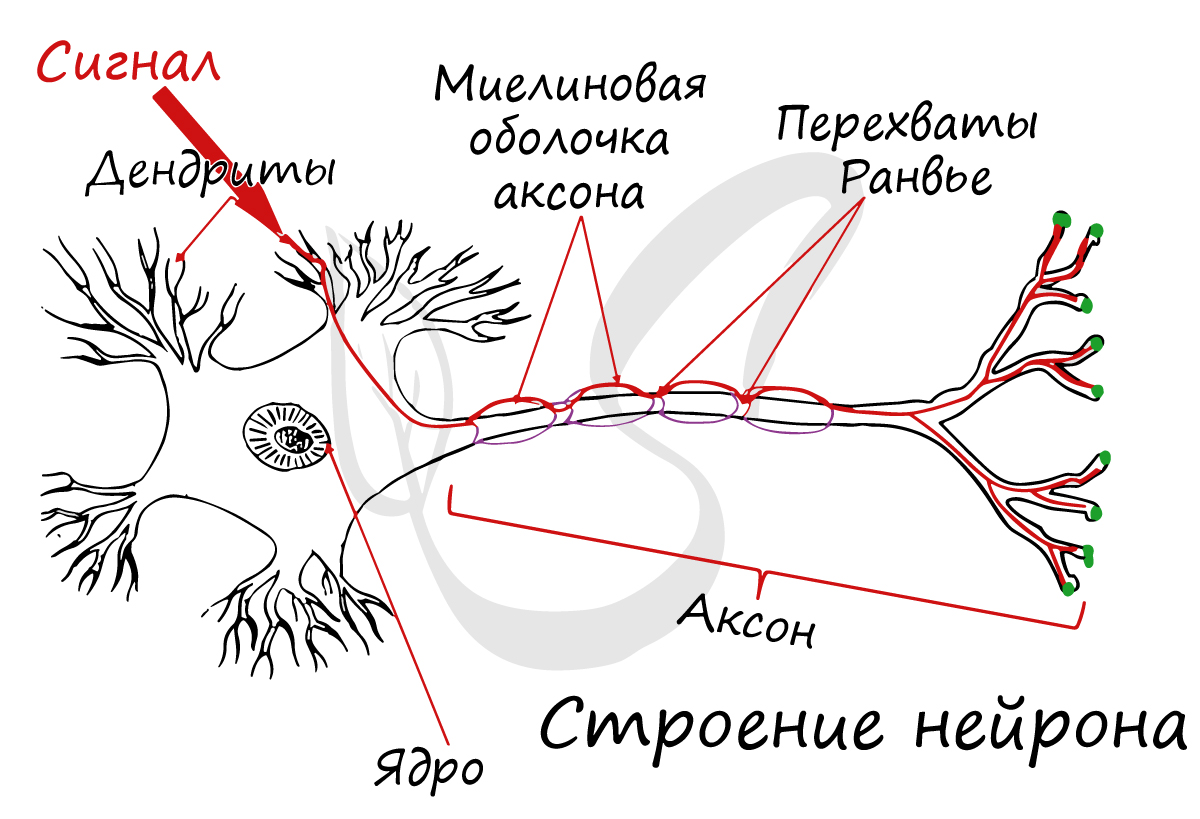
Возбудимость и проводимость — характерные особенности нейронов. Информация передается по отросткам в виде электрических импульсов возбуждения (рис. 4). Это быстрые и кратковременные изменения электрического заряда наружной клеточной мембраны.
Передача информации от нейрона к нейрону происходит в синапсах — местах сближения клеток (нейронов друг с другом или с клетками других тканей). Процесс осуществляется с помощью физиологически активных веществ. Они получили названия «медиаторы» или «нейротрансмиттеры». Медиатор (гистамин, ацетилхолин, дофамин) содержится в специальных пузырьках в окончании аксона.
При возбуждении нейрона импульс достигает окончания аксона. Медиатор выходит из пузырьков и передается через синаптическую щель аксону (дендриту, телу другой нервной клетки или другим клеткам организма). В этих соседних клетках возникает возбуждение или торможение.
Пучки аксонов в изолирующей оболочке образуют нервы. По этим волокнам распространяются нервные импульсы. Передача сигналов происходит только в одном направлении благодаря асимметричной конструкции синапса.
Нервная ткань способна выполнять сложные функции благодаря особому строению нервных клеток и наличию вспомогательных элементов, образующих нейроглию. Основные свойства ткани — раздражимость и возбудимость.
Как выглядит нервная ткань рисунок
Нервная ткань
Нервная ткань является основным компонентом нервной системы. Она состоит из нервных клеток и клеток нейроглии. Нервные клетки способны под действием раздражения приходить в состояние возбуждения, вырабатывать импульсы и передавать их. Эти свойства определяют специфическую функцию нервной системы. Нейроглия органически связана с нервными клетками и осуществляет трофическую, секреторную, защитную функции и функцию опоры.
Нейроглия представлена клетками различной формы и величины, которые делятся на две группы: макроглию (глиоциты) и микроглию (глиальные макрофаги) (рис. 11). Среди глиоцитов различают эпендимоциты, астроциты и олигодендроциты. Эпендимоциты выстилают спинномозговой канал и желудочки головного мозга. Астроциты образуют опорный аппарат центральной нервной системы. Олигодендроциты окружают тела нейронов в центральной и периферической нервной системе, образуют оболочки нервных волокон и входят в состав нервных окончаний. Клетки микроглии подвижны и способны фагоцитировать.
Пучки миелиновых и безмиелиновых нервных волокон, покрытые соединительнотканной оболочкой, образуют нервные стволы, или нервы. Соединительнотканная оболочка нерва называется эпиневрием. Она проникает в толщу нерва и покрывает пучки нервных волокон (периневрий) и отдельные волокна (эндоневрий). В эпиневрии располагаются кровеносные и лимфатические сосуды, которые проходят в периневрий и эндоневрий.
Связь между нервными клетками осуществляется при помощи синапсов. Они образованы концевыми ветвлениями нейрита одной клетки на теле, дендритах или аксонах другой. В синапсе нервный импульс проходит только в одном направлении (с нейрита на тело или дендриты другой клетки). В различных отделах нервной системы они устроены по-разному.
Общая физиология возбудимых тканей
Все живые организмы и любая их клетка обладают раздражимостью, т. е. способностью отвечать на внешнее раздражение изменением обмена веществ.
Возбуждение представляет собой сложную биологическую реакцию. Обязательными признаками возбуждения являются изменение мембранного потенциала, усиление обмена веществ (повышение потребления О2, выделение СО2 и тепла) и возникновение деятельности, присущей данной ткани: мышца сокращается, железа выделяет секрет, нервная клетка генерирует электрические импульсы. В момент возбуждения ткань из состояния физиологического покоя переходит к присущей ей деятельности.
Важнейшим признаком распространяющегося возбуждения является возникновение нервного импульса, или потенциала действия, благодаря которому возбуждение не остается на месте, а проводится по возбудимым тканям. Раздражителем, вызывающим возбуждение, может быть любой агент внешней или внутренней среды (электрический, химический, механический, термический и др.) при условии, что он является достаточно сильным, действует достаточно долго и нарастание его силы происходит достаточно быстро.
Биоэлектрические явления
Плазматическая мембрана клетки (плазмолемма), ограничивающая снаружи цитоплазму клетки, имеет
толщину около 10 нм и состоит из двойного слоя липидов, в который погружены глобулы белков (молекулы, свернутые в клубки или спирали). Белки выполняют функции ферментов, рецепторов, транспортных систем, ионных каналов. Они либо частично, либо целиком погружены в липидный слой мембраны (рис. 13). В состав мембраны входит также небольшое количество углеводов.
Потенциал действия, возникая в возбужденном участке, становится раздражителем для соседнего невозбужденного участка мышечного или нервного волокна и обеспечивает проведение возбуждения вдоль мышцы или нерва.
Возбудимость различных тканей неодинакова. Наиболее высокой возбудимостью отличаются рецепторы, специализированные структуры, приспособленные к улавливанию изменений во внешней среде и внутренней среде организма. Затем следует нервная, мышечная и железистая ткани.
Мерой возбудимости является порог раздражения, т. е. та наименьшая сила раздражителя, которая способна вызвать возбуждение. Порог раздражения иначе называют реобазой. Чем выше возбудимость ткани, тем меньшей силы раздражитель способен вызвать возбуждение.
Кроме того, возбудимость можно характеризовать тем временем, в течение которого должен действовать раздражитель, чтобы вызвать возбуждение, иначе говоря, порогом времени. Наименьшее время, в течение которого должен действовать электрический ток пороговой силы, чтобы вызвать возбуждение, называется полезным временем. Полезное время характеризует скорость течения процесса возбуждения.
Возбудимость тканей увеличивается в процессе умеренной деятельности и снижается при утомлении. Возбудимость претерпевает фазовые изменения во время возбуждения. Как только в возбудимой ткани возникает процесс возбуждения, она утрачивает способность отвечать на новое, даже сильное раздражение. Это состояние называется абсолютной невозбудимостью, или абсолютной рефрактерной фазой. Через некоторое время возбудимость начинает восстанавливаться. На пороговое раздражение ткань еще не отвечает, но на сильное раздражение отвечает возбуждением, хотя амплитуда возникающего потенциала действия в это время значительно снижена, т. е. процесс возбуждения слаб. Это фаза относительной рефрактерности. После нее возникает фаза повышенной возбудимости или супернормальности. В это время можно вызвать возбуждение очень слабым раздражителем, ниже пороговой силы. Только после этого возбудимость приходит в норму.
Проведение возбуждения по нерву
С физической точки зрения нерв очень плохой проводник. Его сопротивление в 100 млн. раз больше, чем у медной проволоки того же диаметра, однако нерв отлично выполняет свою функцию, проводя импульсы без затухания на большое расстояние.
Как осуществляется проведение нервного импульса?
Согласно мембранной теории, каждый возбужденный участок приобретает отрицательный заряд, а так как соседний невозбужденный участок имеет положительный заряд, то два участка оказываются противоположно заряженными. При создавшихся условиях между ними потечет электрический ток. Этот местный ток является раздражителем для покоящегося участка, он вызывает его возбуждение и изменяет заряд на отрицательный. Как только это произойдет, между вновь возбужденным и соседним покоящимся участками потечет электрический ток и все повторится.
Так распространяется возбуждение в тонких, безмиелиновых нервных волокнах. Там, где есть миелиновая оболочка, возбуждение может возникать только в узлах нервного волокна (перехватах Ранвье), т. е. в точках, где волокно оголено. Поэтому в миелиновых волокнах возбуждение распространяется скачками от одного перехвата к другому и движется гораздо быстрее, чем в тонких безмиелиновых волокнах (рис. 16).
Рис. 16. Проведение возбуждения в миелиновом нервном волокне. Стрелками показано направление тока, возникающего между возбужденным (А) и соседним покоящимся (Б) перехватами
Следовательно, в каждом участке волокна возбуждение генерируется заново и распространяется не электрический ток, а возбуждение. Этим объясняется способность нерва проводить импульс без затухания (без декремента). Нервный импульс остается постоянным по величине в начале и в конце своего пути и распространяется с постоянной скоростью. Кроме того, все импульсы, которые проходят по нерву, совершенно одинаковы по величине и не отражают качества раздражения. Меняться может только их частота, которая зависит от силы раздражителя.
Величина и длительность импульса возбуждения определяются свойствами нервного волокна, по которому оно распространяется.
Законы проведения возбуждения по нерву
Как выглядит нервная ткань рисунок
В современной медицине в связи с учащением возникновения заболеваний нервной системы довольно остро стоит вопрос о возможности восстановления функционально полноценных нервных клеток. Нейроны имеют довольно ограниченную энергозависимую способность к репаративной регенерации, а сами по себе очень чувствительны к физическим и химическим воздействиям, таким как нейрональная гипоксия, окислительный стресс, а также к нейротоксинам. В связи с этим актуальным является не только вопрос синтеза эффективных нейропротективных препаратов, но и сама возможность стимуляции пролиферации собственной нервной ткани, или нейротрансплантация [1].
Нужно учитывать, что возможность замещения погибшей нервной ткани ограничена: при массивных повреждениях замещение дефицита нервной ткани идет по пути глиальных элементов, что, как известно, не восполняет функционального дефицита поврежденной нервной ткани [2].
Ранее утверждение о том, что нервная ткань не способна к репаративной регенерации с восполнением тканевого дефекта зрелыми нейронами, считалось аксиомой, как и то, что нервные стволовые клетки (НСК) существуют в организме только во время эмбрионального развития. Но J. Altman в своих исследованиях подтвердил возможность регенерации нервной ткани, обнаружив в ЦНС делящиеся клетки, участки локализации которых были названы впоследствии нейрогенными нишами [2]. Такие клетки при определенной стимуляции могут проявлять свойства НСК. У взрослых млекопитающих они преимущественно локализуются в латеральных стенках боковых желудочков головного мозга, а также в зернистом слое зубчатой извилины гиппокампа, где нейрогенез идет параллельно с ангиогенезом [3–5]. Так же они обнаруживаются в эпендимальной зоне спинного мозга, обонятельных луковицах и обонятельном эпителии млекопитающих [6–8]. В литературе встречается информация о предполагаемой возможности нейрогенеза в области черной субстанции и миндалин [9]. Эмбриональный нейрогенез устанавливает нейронную архитектуру и функцию в глобальном масштабе, тогда как нейрогенез во взрослом организме играет более ограниченную роль [8]. Такой нейрогенез способствует формированию и поддержанию памяти у взрослого человека, а нейробласты, дифференцированные из НСК, также участвуют в поддержании гомеостаза головного мозга [4, 5]. Повреждение нервной ткани или воздействие на нее факторов роста в ЦНС стимулирует нейрогенез в данных зонах, а нейродегенеративные процессы, в том числе возрастные изменения, способствуют нарушению регуляции нормального нейрогенеза, вызывая неврологический дефицит [4]. На данный момент нет детального понимания механизмов, которые поддерживают пул нейральных стволовых клеток при обеспечении пожизненного нейрогенеза. К примеру, факторы, способствующие покою и активации этих клеток, остаются в значительной степени неизвестными [7].
Стволовые клетки нервной ткани (НСК) дают начало двум ветвям нейрогенеза – нейрональной и глиальной, способны к дифференцировке в олигодендроциты и зрелые нейроны [10–12]. Предполагается, что хемокины, секретируемые в области нейровоспаления, способствуют миграции клеток-предшественников в зону поражения нервной ткани [13, 14]. Р.Р. Новиков в своей работе ссылается на данные, полученные S.O. Suzuki и J.E. Goldman при экспериментах на новорожденных крысах, указывающие на миграцию клеток в кору больших полушарий и белое вещество мозга с последующей специализацией путем дифференцировки в олигодендроциты и астроциты, а также в зону обонятельной луковицы с последующей дифференцировкой в зрелые нейроны [15]. Стволовые клетки способны мигрировать в зону повреждения по сосудам, по нейронным цепям и глии, а также по астроцитарным отросткам [16]. Мигрировавшие стволовые клетки либо трансплантированные клетки-предшественники способны к восстановлению функциональной способности ткани двумя путями: встраиваясь в ткань-мишень и становясь его частью, либо оказывая терапевтическое воздействие на ткань-мишень без непосредственной интеграции [17]. В то же время нервная ткань взрослого человека регенерирует в разы медленнее, чем нервная ткань зародыша в эмбриональном периоде [4].
Доказано, что существует возможность применения стволовых клеток путем стимуляции эндогенных стволовых клеток, а также трансплантации экзогенных стволовых клеток из различных тканей, размноженных in vitro [14]. Путем проведения множественных экспериментальных трансплантаций было доказано, что успех или неудача в применении клеточных технологий для восстановления функционально полноценной ткани зависит именно от морфологических и функциональных особенностей пересаживаемых стволовых клеток [18].
Таким образом, целью данного аналитического обзора является рассмотрение возможности и способов применения стволовых клеток, полученных из различных тканей, в качестве стимулятора репаративного нейрогенеза.
Трансплантация нервных стволовых клеток в стимуляции репаративного нейрогенеза
Проведены исследования возможности использования для стимуляции нервной регенерации трансплантированных нервных стволовых клеток.
Ученые приводят результаты доклинических исследований, показывающие благоприятное влияние НСК на электрофизиологическое и морфологическое восстановление хронически поврежденного нерва подопытных мышей и крыс [19].
Стволовые клетки, используемые для стимуляции нервной регенерации, могут быть пересажены в их недифференцированном состоянии или пройти период дифференцировки in vitro [19]. При этом нейрональные стволовые клетки, трансплантированные без предварительной обработки in vitro, проходят дифференцировку в основном в клетки глии, реже – в нейроны [14]. S. Lin et al. культивировали эмбриональные клетки крысиного спинного мозга до момента их дифференцировки в клетки нейрональной и глиальной линии, затем пересаживали их в дистальную часть поврежденного большеберцового нерва крысы на седьмые сутки после нанесения травмы и добились анатомического восстановления нерва и тем самым восстановления иннервации икроножной мышцы. Ученые называют срок в 7 дней после получения травмы наиболее оптимальным временем использования НСК для сохранения мышечной иннервации при повреждении периферического нерва [20].
В тоже время существуют исследования, экспериментально опровергающие возможность использования HCК для восстановления нервной ткани. В ряде случаев НСК показывают плохую выживаемость и ограниченное положительное воздействие в зоне поражения с незначительным функциональным улучшением [21].
Hongyun Huang et al. в своем обзоре приводят информацию о том, что трансплантированные в головной мозг незрелые астроциты способны изменять микросреду головного мозга крыс, синтезируя нейротрофины, необходимые для выживания окружающих нейронов и уменьшая образование глиальных рубцов, тогда как зрелые астроциты, напротив, стимулируют их образование и препятствуют росту аксонов нейронов [22]. Танациты, трансплантированные в спинной мозг крыс, также способны поддерживать регенерацию поврежденных аксонов [22]. В то же время многие ученые отвергают теорию о значимой роли в нейрогенезе эпендимальных стволовых клеток, в связи с отличиями их пролиферативной активности от таковой способности у нейрональных предшественников [23].
Попытки использования клеток фетального мозга также дали неоднозначные результаты благодаря неоднородности самой популяции таких клеток, полученных in vivо и in vitro. Такие клетки, кроме как популяциям зрелых нейронов, продуцирующих нейромедиаторы порой противоположного друг другу действия, дают начало также глиальным элементам. Эта особенность не дает полной уверенности в безопасности данного метода [2].
Трансплантация эмбриональных стволовых клеток в стимуляции репаративного нейрогенеза
Эксперимент И.С. Брюховецкого показал способность эмбриональных стволовых клеток (ЭСК) к дифференцировке в нейрональные клетки, способные к секреции соответствующих маркеров, при культивировании на коллаген-хинозановой конструкции «Коллахит-бол» [24]. В то же время трансплантированные ЭСК по мере дифференцировки могут вызвать реакцию отторжения в связи с приобретением ими иммуногенных свойств [10]. Также экспериментально доказано, что использование NeuroGelTM в сочетании с ксенотрансплантацией стволовых клеток нервного гребня для лечения неврологических осложнений при травме спинного мозга на крысиной модели не только не дает ожидаемых положительных результатов, но и усугубляет посттравматические неврологические осложнения [25]. А А.П. Парахонский отмечает высокую онкогенную активность эмбриональных стволовых клеток, что, по его словам, не исключает существование широкой возможности дифференцировки эмбриональных стволовых клеток ex vivo только в качестве культурального феномена [26].
В литературе содержится множество результатов исследований, что демонстрирует активный поиск оптимальных способов активации нейрогенного потенциала стволовых клеток, существующих в организме человека и животных в постнатальном периоде [5].
Трансплантация клеток обонятельного эпителия в стимуляции репаративного нейрогенеза
Возможно, перспективным окажется использование постоянно пролиферирующих в течение всей жизни клеток обонятельного эпителия [2]. Обонятельный эпителий взрослого человека обладает уникальной регенераторной способностью благодаря клеткам-предшественникам, обеспечивающим непрерывную замену клеток на протяжении всей жизни [13].
Потенциально возможно использование обкладочных клеток обонятельного эпителия (OECs). Они схожи по фенотипу со шванновскими клетками периферической нервной системы и с астроцитами ЦНС. Их возможными источниками являются собственная обонятельная пластинка или слой нервных волокон обонятельной луковицы [13]. Также OECs способны продуцировать SDF-1 (stromal cell-derived factor-1) и BDNF (нейротрофический фактор мозга), усиливающие регенерацию аксонов [21]. Однако возможности использования обкладочных клеток обонятельного эпителия являются ограниченными в связи с недоступным расположением.
Начальные клинические испытания по применению обкладочных нейроэпителиальных клеток для восстановления нервной ткани после позвоночно-спинномозговой травмы у человека в 2005 г. не показали серьезных осложнений после проведенной трансплантации в начале постоперационного периода [28].
Особым преимуществом обладает аутологичная трансплантация размноженных ex vivo и клонированных желаемым фенотипом клеток обонятельного эпителия, так как не возникает необходимости в иммуносупрессии. Кроме того, не возникает этических проблем, связанных с изъятием материала для трансплантации [13]. В России проведенная в рамках клинических испытаний оперативная трансплантация аутогенных клеток обонятельного эпителия в препарате «Сферогель» привела к клиническому улучшению у испытуемых в 50 % случаев [10].
В то же время использование клеточной терапии в комбинации с нейротрофинами способно вызвать нежелательные эффекты. Например, Bretzner et al. [29], объединив для восстановления нейронов руброспинального тракта терапию BDNF с трансплантацией высокообогащенных клеток обонятельного эпителия, выявили, что данная терапия, так же как и терапия BDNF и клетками обонятельного эпителия по отдельности, предотвращает отмирание, но не стимулирует регенерацию руброспинального тракта за пределами участка поражения (зоны трансплантации). Кроме того, комбинация клеток обонятельного эпителия с BDNF с инфузией в красное ядро уменьшала и задерживала функциональное восстановление [29].
Трансплантация клеток костного мозга и мезенхимальных клеток другого происхождения в стимуляции репаративного нейрогенеза
Для стимуляции репаративного нейрогенеза исследовались два типа стволовых клеток костного мозга: SCs (гемопоэтических стволовых клеток костного мозга), BMSC (мезенхимальных (негемопоэтических) стволовых клеток костного мозга). В то же время использование таких стволовых клеток в экспериментах демонстрирует как положительные, так и отрицательные результаты [2].
1. Применение гемопоэтических стволовых клеток костного мозга (SCs)
Гемопоэтические стволовые клетки обладают экспериментально доказанной способностью к дифференцировке в клетки различных тканей организма, в том числе в нервные клетки [30]. Так, эксперимент Roubon et al. ставит под сомнение возможность дифференцировки высокоочищенных HSCs в нервные клетки, указывая, однако, на то, что их значительное количество способно принимать примитивные нейроподобные фенотипы, не способные к окончательной дифференцировке в нейроны [31]. S. Vitry et al., проводя попытки инициации дифференцировки HSCs в нейральном направлении, трансплантировали очищенные культивированные HSCs из AGM зоны (aorta-gonad-mesonephros region) мышей в желудочки головного мозга, выяснили, что, не вызывая отторжения, они дифференцируются в нормальные клетки микроглии и макрофаги мозга, но не способны к дифференцировке в нормальные нейроны или миелинизирующие олигодендроциты [32]. В экспериментах, проведенных Massensale et al. по трансплантации гемопоэтических стволовых клеток (HSC) в мозг подопытных животных, было установлено, что трансплантированные клетки не проходят нейральную дифференцировку, превращаясь в гемопоэтические клетки [33].
Проведен ряд клинических исследований использования HSCs для стимуляции репаративного нейрогенеза. Так мобилизация HSCs гранулоцитарным колониестимулирующим фактором, введенным пациентам подкожно в рамках клинических исследований с последующей трансплантацией стволовых клеток костного мозга дает значительное улучшение в процессе восстановления сенсорной и моторной функции после полученной позвоночно-спинномозговой травмы [34]. В России так же была проведена аутогенная трансплантация HSCs в субарахноидальное пространство пациентам с травматической болезнью спинного мозга. По результатам эксперимента отмечен положительный эффект в 50 % случаев, при этом не выявлено посттрансплантационных осложнений. Однако ряд исследований указывает на значительное онкогенное действие подобной трансплантации [35].
2. Применение мезенхимальных (негемопоэтических) стволовых клеток костного мозга и мезинхимальных клеток другого происхождения
Scintu et al. в своих экспериментах использовали BMSC, обрабатывая их вариациями смеси FGF-1 (фактор роста фибробластов-1) с соактиваторами – РКС (активатор протеинкиназы С), ретиноевой кислотой, РКА (активатор протеинкиназы А, форсколин) и IBMX (3-изобутил-1-метилксантин) – с целью изучения их возможной дифференцировки по нейрональному фенотипу. Ученые выяснили, что после такой обработки BMSC становятся способны экспрессировать нейрональные маркеры. Однако данное свойство BMSС при обработке смесью активаторов РКС, РКА и FGF-1 носило временный характер, как и их дифференцировка – в течение суток клетки возвращались к своему первоначальному фенотипу. При обработке ретиноевой кислотой и BME (2-меркаптоэтанолом) клеточная дифференциация сохранилась после окончания действия активаторов и их удаления. BMSC при обработке данной смесью медленно дифференцировались в нейроноподобные клетки и по истечению семи дней с момента их обработки были способны экспрессировать NF-M (нейротрофический фактор мозга) [36].
Jia et al., исследуя эффективность использования бесклеточного нервного трансплантата (ANX) в сочетании с BMSCs для репаративной регенерации периферического нерва как альтернативу ANA (бесклеточному нервному аллотрансплантату), пришли к выводу, что данный метод способствует регенерации нерва путем стимуляции шванновских клеток реципиента и подходит для улучшения миелинизации и удлинения аксона поврежденного нерва [37].
Мезенхимальные стволовые клетки (МСК), полученные из тканей взрослого организма, потенциально являются терапевтически важным источником клеток для лечения нарушений в центральной и периферической нервной системе, поскольку обладают способностью как к нейрональной, так и к глиальной дифференцировке, а также экспрессируют многочисленные противовоспалительные и нейротрофические факторы, поддерживающие репарацию нервной ткани [38]. Введение МСК после инъекции в мозг крыс липополисахарида (ЛПС) увеличивало плотность астроцитарных филаментов вокруг сосудов головного мозга подопытных животных, а также снижало индуцированный влиянием ЛПС уровень VEGF-A. Таким образом, лечение МСК стабилизировало гематоэнцефалический барьер, уменьшило инфильтрацию нейтрофилами и повысило выживаемость дофаминэргических нейронов среднего мозга у животных, получивших лечение ЛПС [39]. М.Н. Карагяур и Н.И. Калинина упоминают о положительных результатах экспериментального лечения механической травмы периферического нерва мыши путем трансплантации мезенхимальных мультипотентных клеток стромы, способных продуцировать BDNF, GDNF и VEGF, в препарате MatrigelTM [40]. При экспериментальной имплантации культивированных ex vivo мезенхимальных стволовых клеток (МСК) животным с острым нарушением мозгового кровообращения наблюдалось клиническое улучшение благодаря проникновению клеток через ГЭБ в зону ишемии [6].
Ю.А. Калинина и др. в своей работе упоминают о взаимодействии трансплантированных мультипотентных мезенхимальных стволовых клеток (ММСК) и ишемизированной астроглии. ММСК стимулируют перестройку нервной ткани и переход предшественников нейротрофинов в их активную форму, а активные нейротрофины – NGF, BDNF – стимулируют рост аксонов. Авторы ссылаются на работы L.H. Shen et al., а также N. Pavlichenco et al., указывая, что воздействие ММСК на нервную ткань способствует сохранению жизнеспособности клеток области, граничащей с зоной повреждения и, таким образом, уменьшению размеров глиального рубца [41]. Существуют данные о том, что ММСК способствуют снижению проницаемости гематоэнцефалического барьера и, таким образом, стабилизируют его. Также эти клетки стимулируют выработку астроцитами ангиогенных факторов, запуская ангиогенез [41].
Некоторые эксперименты показали, что трансплантированные мезенхимальные стволовые клетки, взаимодействуя с иммунокомпетентными клетками, угнетают функциональную активность лимфоцитов, а также подавляют созревание дендритных клеток [42]. Е.С. Петрова, однако, в своей работе упоминает о том, что МСК, введенные в место повреждения аксона нерва, потенцируют его регенерацию. Вероятно, это связано со стимуляцией собственных эндогенных шванновских клеток, способных к синтезу BDNF, тем самым способствуя восстановлению нервного волокна. Так же МСК способны вырабатывать FGF и VEGF, которые способствуют регенерации поврежденной ткани, улучшая ее кровоснабжение [42].
L.G. Dai et al. в своей работе указывают на то, что культивирование МСК в определенных условиях повышает эффективность применяемой клеточной терапии. Так, например, совместное культивирование мезенхимальных стволовых клеток с леммоцитами способствует их дифференцировке в шванновские клетки (SCs), способные к усиленному синтезу и секреции нейротрофинов [43]. Мезенхимальные стволовые клетки, полученные из желе Уортона, способны дифференцироваться в SC-подобные клетки, продуцирующие нейротрофины NGF, BDNF, NT-3, стимулирующие рост нейритов in vitro [19]. Возможна дифференцировка стволовых клеток в SC-подобные клетки посредством воздействия на них бета-меркаптоэтанола, форсколина, трансретиноевой кислоты, рекомбинантного человеческого bFGF, рекомбинантного человеческого тромбоцитарного фактора роста – АА. Стимулированная таким образом дифференцировка увеличивает жизнеспособность этих клеток in vivo, усиливает способность к секреции нейротрофинов, а также миелинизирующую способность [19].
Трансплантация шванновских клеток (нейролеммоцитов) в стимуляции репаративного нейрогенеза
Возможно трансплантирование и самих шванновских клеток (нейролеммоцитов, SCs). При повреждении периферического нерва они играют важную роль в процессе его восстановления, так как способные к синтезу нейротрофинов BDNF, NGF, VEGF [42].
Миграция SC, трансплантированных в белое вещество ЦНС, ингибируется астроцитами головного мозга, но при введении в демиелинизированную нервную ткань, способствуют ее миелинизации [22, 42]. По данным N.G. Fairbairn et al. шванновские клетки, являясь главными глиальными клетками периферической НС, после травматизации нерва, имея способность к переключению с миелинизирующего на фагоцитарный фенотип, стимулируют регенерацию аксона, посредством усиления хемотаксиса циркулирующих макрофагов в зону повреждения. Регенерирующая часть аксона образует симбиотическое соединение с SCs, способствующее росту аксонов [19].
Существуют данные о возможном использовании в терапевтических целях генетически модифицированных шванновских клеток, которые способствуют усилению роста и миелинизации аксонов нервных клеток [3, 22].
Использование трансплантации других видов клеток в стимуляции репаративного нейрогенеза
Имеются результаты использования трансплантатов, содержащих и другие клеточные культуры.
Исследование D. Kim et al. в стимуляции нейрогенной дифференцировки стволовых клеток жировой ткани (ADSCs) при помощи смеси активаторов и их применении для восстановления поврежденного периферического нерва крысы совместно с использованием нанокаркаса PCL (поликапролактон) показало, что данный метод лечения увеличивает степень нейрональной индукции поврежденного участка при использовании как нейронально дифференцированных, так и недифференцированных ADSCs [40]. Авторы также указывают на потенциальную возможность совместного с ADSCs использования FGF, NGF, GGF (глиального фактора роста), CNTF (цилиарного нейротрофина), VEGF (эндотелиальный фактор роста сосудов), NT-3 и BDNF для увеличения нейротропного потенциала клеток путем модуляции микросреды [44].
Стволовые клетки пульпы зуба (DPSC), происходящие из краниального нервного гребня, обладающие такими МСК-подобными характеристиками, как способность к самообновлению и многолинейной дифференцировке, можно получить из ткани пульпы зуба, в том числе третьих моляров. DPSC обладают высокой пролиферативной способностью, способны дифференцироваться в шванноподобные клетки и олигодендроцитарные клетки и секретировать нейрональные маркеры, например GFAP (глиальный фибриллярный кислый белок), а также нейротрофины [38, 45]. Дентальные стволовые клетки участвуют в нейрорегенерации путем замены погибших клеток, напрямую дифференцируясь в нейроподобные клетки, либо привлекая эндогенные нейральные стволовые клетки при проведении процедуры их трансплантации в зону повреждения [45]. Так же эти клетки способны снижать нейродегенерацию на ранних стадиях апоптоза нейронов и способствовать выживанию моторных и сенсорных нейронов поврежденного спинного мозга за счет секреции BDNF и NGF, а также трофических факторов, способствующих регенерации аксонов [38]. В контролируемых условиях in vitro существует возможность дифференцировать их в нейронные линии, экспрессирующие многочисленные нейронные маркеры, или в спиральные ганглиозные нейроноподобные клетки путем их обработки BDNF, NT-3, GDNF [38]. Однако до сих пор неясно, какой из методов является наиболее подходящим для нейральной дифференцировки стволовых клеток зубов [45].
Существуют исследования о применении DPSC в лечении инсульта, болезни Паркинсона, болезни Альцгеймера, повреждений сетчатки, а также повреждений периферических нервов. Некоторые исследования in vivo показали, что трансплантация стволовых клеток дентальной пульпы в ишемизированные зоны при окклюзии средней мозговой артерии у крыс способствовала восстановлению локомоторных функций и уменьшению площади инфаркта за счет их дифференцировки в дофаминэргические нейроны и секреции нейротрофических факторов [38].
В регенеративной медицине нашли применение MDSC (стволовые клетки мышечного происхождения). Искусственно культивируемые MDSC способны к дифференцировке в нейрональные и глиальные клетки, однако до настоящего времени не достигнут консенсус в отношении эффективных протоколов культивирования и индукции для нейронной дифференцировки MDSC [46].
Способы трансплантации клеток и стимуляторов дифференцировки стволовых клеток
Вопрос о возможности применения клеточных технологий в клинической неврологии в настоящее время весьма сложен. Сложность заключается не только в выборе типа клеток и способа их активации, но еще и в выборе наиболее эффективного и в том числе наиболее безопасного метода введения клеток или стимуляторов их дифференцировки.
В качестве одного из таких способов предлагается периневральное введение НСК в ЦНС. Такое введение позволяет свести травматизацию сохранных нервных клеток к минимуму, а также способствует более естественному проникновению НСК в ЦНС через ГЭБ [5].
Второй из предложенных способов – введение стволовых клеток в рецептивное поле nervi olfactorii. Командой ученых из Беларуси был проведен эксперимент по эндоскопическому введению аутотрансплантата мезенхимальных стволовых клеток (МСК) в зону иннервации nervi olfactorii, который показал улучшение состояния у пациентов с инсультами и инфарктами головного мозга уже в первые 24 часа после проведения данной терапии в сочетании с классической медикаментозной терапией данной патологии [5].
Возможна доставка суспензированных стволовых клеток путем микроинъекции непосредственно в нервные окончания или трансплантаты. Метод является наиболее простым и в то же время наименее эффективным, так как даже процесс микроинъекции может служить причиной дополнительной травматизации интранейронной архитектуры [19, 47].
Упоминается возможность интраартериального введения стволовых клеток, однако эффективность данного метода не является доказанной [38].
В качестве носителя стволовых клеток можно использовать и нервные проводники, содержащие стимулирующие регенерацию факторы. В частности, новые каркасы, такие как гидрогели, которые имеют трехмерную пористую структуру и хорошую цитосовместимость, и могут быть использованы для обеспечения структурной поддержки клеточной адгезии, пролиферации и роста. Каркасы могут быть разработаны для встраивания биологически активных веществ, таких как NGF [38]. Применение каркасов, например, из полиэтиленгликоля, Матригеля, гиалуроновой кислоты и др. материалов, обеспечивающих межклеточную коммуникацию и пролиферацию клеток, помогает предотвратить нежелательное рассеивание последних из локализации необходимого воздействия [19]. А.В. Балябин и др., проводя трансплантацию аутологичных нейральных стволовых клеток обонятельного эпителия мышей в гидрогеле на основе гиалуроновой кислоты, добились восстановлению рефлекторной активности, а также когнитивных способностей животных с искусственно нанесенной открытой черепно-мозговой травмой [48]. Положительный эффект применения аутогенных обкладочных клеток обонятельного эпителия в препарате «Сферогель» позволяет рекомендовать его для использования в клинике [10].
Доказано, что мультипотентные мезенхимальные стволовые клетки в альгинатных микрокапсулах теряют свою способность к пролиферации, так же как и ММСК, культивированные в широкопористых альгинатных губках, что А.Ю. Петренко и др. связывают с недостаточными адгезивными свойствами альгината. Присоединение наночастиц желатина к поверхности пор губок способствует увеличению адгезивных свойств носителя (губки) [49].
Заключение
Таким образом, поиск наиболее эффективного и безопасного варианта направленной стимуляции регенерации нервной ткани является перспективной, но тем не менее сложнейшей задачей современной нейротрансплантологии. Несмотря на существование большого количества работ по положительному влиянию трансплантации стволовых клеток для стимуляции регенерации нервной ткани, механизмы их влияния на процессы репарации в настоящее время до конца не установлены. То же самое касается и побочных эффектов применения клеточной терапии. Важным условием успеха является разработка протоколов направленной дифференцировки клеток. В данный момент именно получение клеток с высоким потенциалом к пролиферации и дифференцировке в нервные клетки конкретного фенотипа является наиболее важной целью, достижение которой позволит производить необходимое для проведения клеточной терапии количество специализированных нервных клеток.