Как выглядит свищ в горле
Как выглядит свищ в горле
Бранхиогенные свищи шеи следует отличать от облитерированного синуса жаберных щелей.
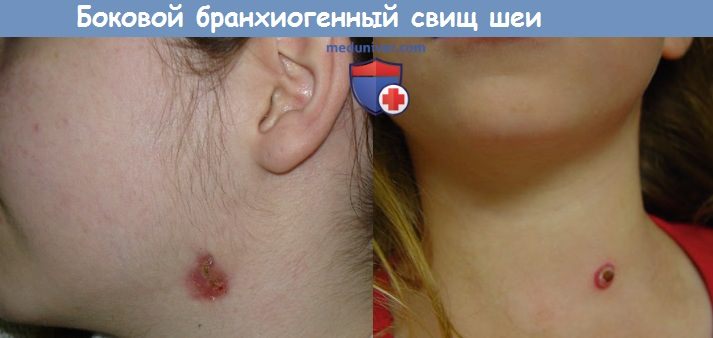
а) Симптомы и клиника бранхиогенного свища шеи. Периодическое открытие свища, сопровождающееся гиперемией и отеком тканей в области его наружного отверстия. В некоторых случаях отмечается ямочка на коже шеи без признаков воспаления.
Свищевое отверстие всегда располагается у переднего края грудино-ключично-сосцевидной мышцы либо на уровне сонного треугольника, если свищ исходит из второй жаберной дуги, на уровне перстневидного хряща, если свищ исходит из третьей жаберной дуги, или вблизи яремной вырезки грудины, если свищ исходит из четвертой жаберной дуги. Выделения из свища могут напоминать молоко или быть гнойными. У 5% больных свищ бывает двусторонним.
б) Причины и механизмы развития. Причинами образования бранхиогенного свища шеи бывают генетические факторы или действие токсических факторов внешней среды во время беременности, в том числе гипоксемии, гиперкарбии, курения, приема алкоголя, аспирина, уретана, талидомида, соединений свинца, ртути, а также метаболические расстройства, ионизирующее излучение, из-за которого жаберная щель облитерируется неполностью или персистирует шейный синус.
Эмбриогенез развития жаберных дуг:
1. Первая жаберная дуга, нижняя челюсть:
Эктодермальные органы: кожа щек, нижняя челюсть, передняя половина ушной раковины, наружный слуховой проход, тройничный нерв, паренхима слюнных желез, эмаль зубов, эпителиальный покров губ, язык до уровня слепого отверстия, барабанная перепонка
Мезодермальные органы: жевательные мышцы, переднее брюшко двубрюшной мышцы, мышца, напрягающая барабанную перепонку, суставной отросток нижней челюсти, молоточек, наковальня, козелок, ножка завитка, фиброзный слой барабанной перепонки Энтодермальные органы: эпителий дна и боковых стенок полости рта, слуховая труба, слизистая оболочка барабанной перепонки, полость среднего уха, сосцевидный отросток
2. Вторая жаберная дуга, подъязычная кость:
Эктодермальные органы: кожа задней поверхности ушной раковины и верхней части шеи, часть лицевого (VII) и преддверно-улиткового (VIII) нервов
Мезодермальные органы: стременная мышца, завиток и противозавиток, тело подъязычной кости
Энтодермальные органы: эпителий корня языка, слепое отверстие, центральная часть щитовидной железы, нёбные миндалины
3. Третья жаберная дуга:
Эктодермальные органы: кожа средней части шеи, часть языкоглоточного (IX) нерва Мезодермальные органы: верхняя порция глоточного констриктора, общая и внутренняя сонная артерии
Энтодермальные органы: эпителий, выстилающий глотку, корень языка, надгортанник и грушевидный карман
4. Четвертая жаберная дуга:
Эктодермальные органы: блуждающий нерв (X)
Мезодермальные органы: нижняя порция глоточного констриктора, мышцы гортани, щитовидный хрящ, часть надгортанника, правая подключичная артерия, дуга аорты Энтодермальные органы: эпителий корня языка, эпителий, выстилающий глотку и надгортанник, часть щитовидной железы
5. Пятая жаберная дуга:
Эктодермальные органы: кожа нижней части шеи, добавочный нерв (XI)
Мезодермальные органы: мышцы гортани, черпаловидные и перстневидный хрящи Энтодермальные органы: подслизистая лимфоидная ткань, легкие
в) Диагностика. Часто удается нащупать поверхностно расположенный подкожный тяж, который тянется от наружного отверстия свища у переднего края грудино-ключично-сосцевидной мышцы. Обычно при легком надавливании на кожу над тяжем книзу из наружного отверстия свища появляются выделения. Введение в свищ контрастного вещества позволяет уточнить направление его хода и выявить разветвления, если они имеются.
Если свищ полный и его устье расположено в глотке, контрастное вещество вытекает из него в глотку, и больной ощущает его вкус.
г) Лечение бранхиогенного свища шеи. Предотвратить возникновение рецидивов, связанных с сохранением остатков свища, можно лишь при условии полного иссечения свища. Достижению этой цели помогают использование бинокулярной лупы или операционного микроскопа и введение в свищ красителя.
P.S. Ход боковых свищей шеи вариабельный. Наиболее часто свищи, образующиеся из второй жаберной дуги, направляются к бифуркации сонной артерии (тонзиллофарингеальный проток), в то время как свищи, образующиеся из нижерас-положенных жаберных дуг, направляются вверх, располагаясь позади общей сонной артерии (тимофарингеальный проток).
— Вернуться в оглавление раздела «отоларингология»
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Паратонзиллярный абсцесс: диагностика, симптомы и лечение
4.14 (Проголосовало: 7)
В медицине термином паратонзиллярный абсцесс называют скопление гноя в тканях, окружающих небные миндалины. Также выделяют термин «паратонзиллит/перитонзиллит», когда гнойный еще не сформировался. Это стадия до образования самого абсцесса.
Паратонзиллит и паратонзиллярный абсцесс занимают первое место среди гнойных процессов глотки и являются следствием распространения острого воспалительного процесса с небных миндалин на паратонзиллярную клетчатку и окружающие ткани, характеризуется их воспалительной инфильтрацией (отёком). Чаще бывает односторонний процесс. Данные состояния являются осложнением острого или обострения хронического тонзиллита, ангины, вследствие травмы глотки инородным телом, одонтогенного процесса (кариес, пародонтит и др.).
Паратонзиллярные абсцессы относятся к группе заболеваний, при которых требуется оказание неотложной помощи. При разлитом гнойном воспалении паратонзиллярной клетчатки в течение 2 суток, когда еще не сформировался абсцесс, лечение такое же, как при тяжелой форме ангины (лакунарной или фолликулярной). При отсутствии положительной динамики больного госпитализируют. В случаях, образовавшегося абсцесса (обычно к 5—6-му дню, а при некоторых инфекциях и снижении иммунитета организма абсцесс может образоваться, несмотря на активное лечение, раньше — на 3—4-й день от начала заболевания) необходимо как можно скорее произвести его вскрытие.
Как проходит лечение паратонзиллярного абсцесса?
Лечение подобных тяжелых форм заболеваний, как правило, требует интенсивной медикаментозной терапии. Паратонзиллит и паратонзиллярный абсцесс относятся к категории чрезвычайно опасных болезней, требующих немедленного вмешательства врачей.
Без адекватного лечения, инфекция из области паратонзиллярного абсцесса может распространиться на соседние ткани горла, в глубину шеи, в грудную клетку (медиастинит) или в кровь (сепсис), что может привести к смерти заболевшего человека в течение нескольких часов или дней.
У детей паратонзиллярные абсцессы могут вызывать очень сильный отек горла, от которого ребенок может задохнуться (асфиксию).
Диагноз устанавливается на основании типичной клинической картины и данных мезофарингоскопии. Дополнительного инструментального или лабораторного подтверждения диагноза обычно не требуется. В зависимости от состояния пациента решается вопрос о направлении его в стационар.
Показания к госпитализации:
Наличие сопутствующей тяжелой патологии (некомпенсированная гипертоническая болезнь, сахарный диабет, ВИЧ инфекция, гепатиты и др.).
Вскрытие паратонзиллярного абсцесса
Выбор хирургического разреза определяется локализацией воспалительного процесса в паратонзиллярной клетчатке. Операция проводится под местной анестезией.
После вскрытия абсцессов проводятся полоскания глотки растворами антисептиков, рекомендуется проводить повторное раскрытие краев разреза в связи с тем, что в первые сутки после вскрытия в полости абсцесса снова может накопиться гной, а края рассеченной слизистой оболочки быстро начинают регенерировать. После дренирования полости абсцесса воспалительные изменения в глотке претерпевают обратное развитие, нормализуется температура тела, исчезают боли при глотании, улучшается общее самочувствие. В комплексном лечении паратонзиллярных абсцессов применяются антибактериальные препараты, противовоспалительные средства, десенсибилизирующие препараты. При выраженной общей интоксикации рекомендуется проведение инфузионной и дезинтоксикационной терапии.
Возможные осложнения
Возможные осложнения: при вскрытии паратонзиллярного абсцесса могут развиться осложнения, как и при любом хирургическом вмешательстве:
В плане обследования пациента обязательно назначаются клинические исследования крови в динамике, общий анализ мочи, с целью определения степени выраженности общей реакции организма на инфекционно-воспалительный процесс, электрокардиография. Проводятся бактериологические исследования посевов из зева и исследование чувствительности микроорганизмов к антибактериальным препаратам.
Поскольку паратонзиллярные абсцессы развиваются обычно у лиц, страдающих хроническим тонзиллитом, то в спокойном периоде рекомендуется произвести удаление небных миндалин.
Как выглядит свищ в горле
Материал и методы
С 1963 г. по февраль 2012 г. в РНЦХ им. акад. Б.В. Петровского находились на лечении 107 больных с ТПС различной этиологии. Возраст больных варьировал от 8 до 65 лет и в среднем составил 33,6 года. С течением времени серьезно изменились этиология, методы диагностики, а также тактика лечения и варианты оперативных вмешательств.
Сочетанные заболевания в виде ТПС и рубцового стеноза трахеи мы диагностировали у 55 (75,3%) больных 2-й и всего у 7 (20,5%) больных 1-й группы.
Попытки разобщения ТПС в других медицинских учреждениях ранее были предприняты у 11 (15,1%) больных 2-й группы.
При поступлении обследование начинали с оценки клинической картины, осмотра, анализа жалоб и анамнеза.
Основным патогномоничным симптомом был кашель с обильным выделением мокроты с примесью пищи (табл. 2). 
С целью выявления и оценки свища, его размеров и локализации, а также состояния окружающих органов и тканей использовали методы лучевой диагностики: рентгеноскопию, рентгенографию, компьютерную томографию органов грудной клетки. Эндоскопическое исследование расценивали как основное. При этом использовали фибротрахеобронхоскопию, эзофагогастроскопию, сочетанную эзофагогастротрахеобронхоскопию (см. рис. 1-3 и далее на цв. вклейке). 


Из 107 больных, прошедших лечение в отделении, радикально были оперированы 92 (86,0%) (табл. 3). 
Радикальное лечение проведено 24 (70,6%) больным 1-й и 68 (93,1%) больным 2-й группы. Сравнительный анализ вариантов радикального вмешательства представлен в табл. 4.
Непосредственные результаты: после радикальных операций госпитальной летальности не было. Рецидив свища возник у 13 больных: у 4 (16,7%) из 1-й и у 9 (13,2%) из 2-й группы.
В связи с рецидивом свища повторно оперировали 3 из 4 больных 1-й группы. У всех свищ ликвидирован. В одном наблюдении добиться ликвидации свища удалось с помощью консервативных мероприятий. Во 2-й группе повторно оперировали 7 из 9 больных с хорошим клиническим результатом. Один больной отказался от повторной операции. Еще у одной больной сохраняется точечный ТПС без клинических проявлений. Ей проводится этапное хирургическое лечение по поводу стеноза трахеи.
При анализе причин развития рецидива свища у некоторых больных 2-й группы отмечено что у 8 из 9 больных ТПС сочетался с рубцовым стенозом трахеи. Как вариант операции им выполнили разобщение свища с трахеопластикой и введением Т-образной трубки, которая является инородным телом и неблагоприятна для заживления швов трахеи и пищевода.
При сочетанных заболеваниях приходится оценивать результаты лечения не только ТПС, но и рубцового стеноза трахеи. Хорошим считали результат, при котором свищ был ликвидирован, отсутствовала одышка при физической нагрузке, в трахее не было стента или Т-образной трубки, ее просвет был более 9 мм; удовлетворительным, когда свищ был ликвидирован, трахеостома устранена, одышка появлялась только при физической нагрузке, просвет трахеи не менее 6-8 мм. Неудовлетворительным результатом признано развитие рецидива свища или постоянное канюленосительство.
Консервативную терапию как вариант самостоятельного лечения провели 10 (9,3%) больным (7 из 1-й и 3 из 2-й группы). Причинами отказа от проведения хирургического лечения среди пациентов
1-й группы были: тяжелые сопутствующие заболевания (3), отказ больных от операции (2), перевод в специализированное ЛОР-отделение (2). Причинами проведения консервативной терапии во 2-й группе были отказ от операции (1), ликвидация свища (1), низкий комплаенс и отсутствие аспирационных осложнений (1). После проведения комплексной консервативной терапии (антибактериальной, нутритивной, инфузионной, противовоспалительной и т.д.) все пациенты отметили улучшение состояния. Добиться излечения удалось в 1 (1,4%) наблюдении.
Обсуждение
Основным клиническим симптомом ТПС у наблюдавшихся нами больных был кашель во время еды с обильным выделением мокроты и с примесью пищи. Л.М. Гудовский [2] отмечал подобную симптоматику в 100% наблюдений. У больных, которым продолжали ИВЛ, основным клиническим признаком свища является обнаружение желудочного содержимого в дыхательных путях во время санации и нарушение вентиляции при переинтубации или смене трахеостомической канюли вплоть до асфиксии. Это обусловлено дислокацией трубки в свищевой дефект [5, 20]. Часто именно это и вынуждает реаниматологов и врачей отделений интенсивной терапии, неврологической реабилитации проводить эндоскопическое обследование, уточнять состояние трахеи и пищевода.
Окончательное хирургическое лечение ТПС остается довольно сложной проблемой торакальной хирургии. Накопленный опыт трахеальной хирургии позволил полностью устранить ТПС у 97,8% наблюдавшихся нами пациентов и восстановить естественное питание через рот. Основные технические аспекты разобщения патологического соустья подразумевают несколько этапов: 1) выделение пищевода, трахеи и места ТПС; 2) разделение соустья; 3) ушивание дефектов трахеи и пищевода; 4) разобщение линии швов различными способами. Однако в современных условиях зачастую хирургу приходится не только разобщать сам свищ, но и производить восстановительные операции на трахее и пищеводе [6, 11, 12, 14, 16-18, 20, 21]. Характер лечения, проведенного в двух группах наблюдавшихся нами больных, различался. В последние годы операцией выбора стали радикальные вмешательства, направленные на разобщение патологического соустья. Паллиативные операции в настоящее время мы практически не используем. Развитие реаниматологии позволяет значительно расширить показания к радикальному лечению. Кроме этого, большинство больных поступали уже после выполнения паллиативных операций. Консервативное лечение рассматривали как этап предоперационной подготовки. Единственно возможным методом излечения больного на сегодняшний день является радикально выполненная операция.
При анализе характера радикальных операций, выполненных больным с ТПС в двух группах (см. табл. 4), в последние годы отмечается необходимость увеличения их объема. Это связано с более частым сочетанием ТПС с рубцовым стенозом трахеи и пищевода, вовлечением в патологический процесс прилежащих органов и тканей. При решении вопроса о варианте радикальной операции у таких больных необходимо не только определить локализацию соустья по отношению к гортани и бифуркации трахеи, но и учесть наличие сочетанного поражения трахеи, гортани и пищевода. Развитие трахеальной хирургии в настоящее время позволяет выполнять радикальные одномоментные операции с минимальным риском, особенно при ограниченных поражениях. Мы стремимся к выполнению операций, заключающихся в разобщении ТПС и циркулярной резекции трахеи. Они позволяют излечить больного в один этап от двух тяжелых конкурирующих заболеваний. Ни в одном из 7 подобных наблюдений не было рецидива ТПС.
Приводим пример аналогичного лечения.
Больная Ш., 21 года, поступила с жалобами на поперхивание при приеме пищи и жидкости, на одышку при умеренной физической нагрузке, наличие трахеостомы.
В мае 2008 г. в результате дорожно-транспортного происшествия получила закрытую черепно-мозговую травму. Ей выполнили костно-пластическую трепанацию, удаление субдуральной гематомы. В течение длительного времени проводили ИВЛ через трахеостомическую трубку. Через несколько дней после декануляции возникло затрудненное дыхание. При трахеоскопии диагностировали стеноз трахеи. В июле 2011 г. по месту жительства выполнили трахеопластику с введением в просвет трахеи Т-образной трубки. В сентябре 2009 г. при контрольной трахеоскопии выявили ТПС.
При поступлении состояние удовлетворительное. Дыхание свободное, осуществляется через Т-образную трубку. Во время эзофагографии контрастное вещество (омнипак) через ТПС поступало в трахею на 1 см ниже трахеостомы (рис. 4). 

При ларинготрахеоскопии сразу после удаления Т-образной трубки слизистая подскладочного отдела гортани и начального отдела трахеи была отечна и гиперемирована. На расстоянии 3,5 см от нижнего края трахеостомы стенки трахеи рубцово изменены. Просвет дыхательного пути в этой области соответствовал наружному диаметру Т-образной трубки. Каудальнее стеноза стенка трахеи визуально была не изменена, на фоне отека слизистой ее хрящевые полукольца визуализировались нечетко. Верхнее из четко видимых хрящевых полуколец находилось на расстоянии 4 см от карины. На 1,5 см ниже трахеостомы (около 6 см от голосовых складок) в задней мембранозной стенке трахеи по средней линии имелось свищевое отверстие диаметром 4-4,5 мм с эпителизированными краями, через которое был виден просвет пищевода. При эзофагогастроскопии в 20 см от резцов по правой стенке пищевода определялся дивертикулообразный карман, в дне которого имелось свищевое отверстие диаметром около 4-5 мм.
Учитывая наличие изменений в краниальной части трахеи, с целью проведения контрольного периода и оценки состояния подскладочного отдела гортани и шейного отдела трахеи Т-образную трубку заменили на трахеостомическую. Однако в связи с возникшей аспирацией при проглатывании жидкой пищи и слюны от проведения контрольного периода отказались, а реальную протяженность рубцово-измененных тканей трахеи выявили позже, только во время операции.
Клинический диагноз: посттрахеостомический протяженный рубцовый стеноз шейного и грудного отделов трахеи II-III степени. ТПС. Состояние после закрытой черепно-мозговой травмы, трахеостомии и длительной ИВЛ, неоднократных трахеопластических операций.
С иссечением трахеостомического канала рассекли кожу и подкожную клетчатку. Выделили шейный отдел трахеи. При ревизии установлено, что ее стенки в проекции трахеостомы и ниже на протяжении 4 см утолщены до 1 см, уплотнены и кровоточивы, с признаками хронического воспаления. С помощью трансиллюминации через фибробронхоскоп уточнили границы рубцовых изменений трахеи. Нижняя граница последних располагалась на расстоянии 3,5-4 см ниже яремной вырезки. Общая протяженность рубцовых изменений трахеи, включая трахеостому, составила 8-8,5 см. С помощью трансиллюминации определили локализацию ТПС, который располагался в задней стенке трахеи, в области нижней части стенозированного участка. После мобилизации грудного отдела и частично шейного отдела выше трахеостомы установили, что грудной отдел трахеи возможно переместить на шею для осуществления резекции и анастомоза с одномоментным разобщением ТПС, что и было выполнено.
Диастаз между концами трахеи составил 8 см. Свищевое отверстие пищевода ушили за счет оставшихся тканей трахеи кисетным швом с последующим погружением его в стенку пищевода вторым слоем швов. С целью изоляции швов из медиальной части левой грудиноключично-сосцевидной мышцы выкроили лоскут, который ротировали между трахеей и пищеводом и фиксировали к предпозвоночной фасции. Целостность дыхательного пути восстановили с помощью межтрахеального анастомоза.
Послеоперационный период протекал без осложнений. Рана зажила первичным натяжением. Через 8 сут после эзофагографии начали энтеральное питание. Через 15 сут после операции при контрольной трахеоскопии на расстоянии 3 см от голосовых складок и 3 см от карины трахеи определялась линия анастомоза в виде незначительной деформации стенок и циркулярного ряда лигатур синего цвета. Просвет трахеи не был сужен. Пациентка выписана в удовлетворительном состоянии, без затруднения дыхания и с полностью восстановленным приемом пищи через рот.
Подобная хирургическая ситуация встречается нечасто. Локализация патологических процессов на разных уровнях исключает возможность одномоментных операций и требует длительного этапного лечения, но в первую очередь всегда следует производить разобщение патологического соустья. В тех ситуациях, когда выполнение одномоментной радикальной операции было невозможно, производили разобщение ТПС, пластику трахеи с введением Т-образной трубки или использовали другие варианты операции.
Таким образом, ведущим этиологическим фактором формирования трахеопищеводного свища в настоящее время стало трансмуральное повреждение трахеи и пищевода при проведении ИВЛ через трахеостомическую или интубационную трубку. Более чем у половины больных трахеопищеводный свищ сопровождается стенозом дыхательного пути.
Эндоскопический метод остается основным как при первичной диагностике, так и при определении качества паллиативной и окончательной хирургической помощи. Он может быть трансформирован в лечебную процедуру, направленную на восстановление дыхания и изоляцию трахеобронхиального дерева от желудочно-кишечного тракта.
Основной целью первой помощи больному с трахеопищеводным свищом является изоляция трахеобронхиального дерева от желудочно-кишечного тракта. При сочетании трахеопищеводного свища с рубцовым стенозом трахеи прежде всего следует восстановить дыхание и нормальный газообмен, а затем изолировать трахею от пищевода.
Разработанные новые варианты операций позволяют эффективно и безопасно излечивать 97,8% больных, в том числе с сочетанными заболеваниями. Одномоментные резекционные операции позволяют достичь излечения в один этап и снизить риск развития рецидива свища.
Лечение подобных больных следует проводить в условиях специализированных медицинских учреждений, обладающих опытом операций на трахее и пищеводе.