Как выглядят атомы и молекулы
Атом и молекула – что это и отличия
Мельчайшие частицы – атом и молекула, об этом знают многие люди, но не все могут рассказать подробно, что же это такое. Также сложно, не имея специальных знаний, объяснить, в чем состоят отличия между этими структурами. Из различных исторических источников известно, что про эти структурные единицы знали еще древнегреческие ученые. Так философ Демокрит одним из первых высказал предположение о том, что все известная людям материя состоит из крошечных по своим размерам, неделимых человеческому глазу частиц. Их он назвал атомами. Современные ученые подтвердили эту теорию и установили опытным путем, что вещества состоят из атомов и молекул. Для того чтобы установить разницу межу этими структурными единицами, необходимо сначала дать им определение, а затем сравнить, чтобы определить, в чем состоят различия.
Определение понятий
На первых этапах изучения считалось, что атом и молекула – элементы неделимые. Более глубокие исследования и всесторонние изучения позволили опровергнуть это мнение. Сегодня этими терминами обозначают самостоятельные элементы, которые образуют все, что окружает человека.
Атомом называют мельчайшую структурную единицу, составляющую любое вещество.
Молекулой принято считать элементарную частицу, из которых состоят все окружающие людей вещества, материи и компоненты.
Сравнение
После приведенных определений можно приступить к сравнению элементарных структурных единиц вещества. Атом является наименьшей ее составляющей. Он имеет собственную массу и размер. Основная задача – определение, какими свойствами будет обладать то или иное химическое вещество.
Нужно учитывать, что атом не является конечным элементом. Он в свою очередь делится на ядро и электроны, которые совершают движение по орбите, расположенной вокруг ядра. Подобное строение и определяет, какими свойствами будет обладать то или иное вещество. Особенностью атома является то, что его невозможно увидеть вне компонента, в свободном состоянии. Все атомы имеют тесные связи между собой, которые и образуют молекулу. Происходит это благодаря электрическим зарядам частиц, из которых состоят атомы.
Молекула — это единица, составляющая вещество. В состав молекул входят атомы. Разное их количество определяет свойства. Атомы внутри молекулы имеют межатомные связи. Каждая молекула состоит из атомных ядер и внутренних электронов. Они совершают движение по своим орбитам. В состав входят также внешние валентные электроны. В разных молекулах находится разное количество атомов. Это свойство и определяет разнообразие химических веществ и компонентов. Молекула имеет сложную архитектурную постройку. Так у каждого атома свое место внутри молекулы. Количеством атомов в ней определяются свойства – химические реакции и превращения. Имеющиеся свойства влияет порядок и конфигурация соединения всех атомов. Атомная постройка, которая образует молекулу, может быть жесткой. Также бывают и исключения. Особенность мельчайшей единицы – постоянное движение. Атомы никогда не останавливаются, они продолжают колебание на положенном ему месте в молекуле, чтобы удержать равновесие.
Выводы
Атомы и молекулы – структурные единицы, образующие любое вещество. Атомы образуют молекулу. В составе атома присутствуют еще более мелкие элементы — ядро и электроны, которые движутся по своим орбитам вокруг ядра. Молекулы состоят из атомов (одного или нескольких).
Атом имеет электрический заряд (положительный или отрицательный) а молекула по этому показателю полностью нейтральная. Только молекула в веществе обладает способностью к самостоятельному существованию.
Увидеть каждый атом: за что дали Нобелевку по химии
В школе все науки понятно и привычно делили сферы влияния. В домашних заданиях явления требовали отнести либо к физическим, либо к химическим. В реальной жизни это уже давно не так, и Нобелевская премия по химии 2017 года — очередное тому доказательство. На престижнейшую научную награду для химиков номинированы трое учёных, работающих в сфере биологии и открывших способ, как увидеть структуру отдельных биомолекул в их естественной среде обитания — водном растворе.
Коллаж © L!FE. Фото: © Shutterstock © wikipedia.org
Уже не первый год Нобелевскую премию по химии присуждают за биологические открытия. И на этот раз Ричард Хендерсон, Иоахим Франк и Жак Дубоше были номинированы на Нобелевку за «развитие криоэлектронной микроскопии высокого разрешения для определения структуры биомолекул в растворе». Неужели в науке о превращениях веществ за последние десятилетия не случилось ничего прорывного? А если случилось, то почему с химиками обходятся так несправедливо?
На самом деле несправедливости тут нет. Современная наука мультидисциплинарна. Каждый уважающий себя исследователь подходит к интересующей его проблеме с самых разных сторон, используя солидный набор методов для её изучения. Теперь уже недостаточно провести какую-нибудь одну химическую реакцию или вывести линию мух с определённым геном. Статью об исследовании, в котором использованы один-два метода, приличный научный журнал не примет. Необходимо использовать и физические, и химические, и биологические подходы к одному и тому же вопросу. В конце концов, всё живое состоит из молекул, традиционных объектов изучения химии, а эти молекулы и их группы подчиняются физическим законам.
К тому же наука о жизни давно уже ушла от препарирования лягушек и наблюдения за цветением растений. Многие современные биологи в ходе работы ни разу не сталкиваются с живыми объектами. Огромные силы брошены на фронт биоинформатики — анализа последовательностей нуклеотидов ДНК и аминокислот в белках с использованием компьютерных алгоритмов. Классической биологии в этом, прямо скажем, нет. Для биоинформатических изысканий не нужны ни пробирки, ни микроскопы, ни другие предметы, на фоне которых журналисты и телевизионщики обычно снимают учёных.
Но есть и те, кто стоит к живому чуть ближе. Они работают не с целыми организмами и даже не с конкретными органами, а с отдельными биологическими молекулами. Кстати, эти молекулы не такие уж и мелкие. Как правило, они состоят из сотен тысяч атомов — особенно если говорить о белках и нуклеиновых кислотах. Способов соединить эти атомы великое множество, а ведь от них зависят форма и поведение молекулы. Ферменты — биологические катализаторы — потому и помогают проводить биохимические реакции, что способны менять форму своих молекул.
Как увидеть отдельную молекулу?
Фото: © REUTERS/Toby Melville
Конечно, молекулы белков и нуклеиновых кислот крупнее, чем какой-нибудь глюкозы. Но всё же они недостаточно большие, чтобы их было видно в обычный, световой микроскоп. Его разрешение ограничено длиной световой волны, падающей на исследуемый объект. Как правило, она составляет не более 250 нанометров. Соответственно, все объекты размером меньше 250 нанометров в световой микроскоп видны не будут.
Обойти эту проблему в 1930-х годах позволили электронные микроскопы. В них на исследуемый объект не светит солнце или лампочка — на него обрушивается поток электронов. В остальном принцип работы электронного микроскопа похож на принцип самого простого светового микроскопа, но длина волны электронов существенно короче длины волны видимого света. Поэтому теоретическое разрешение электронной микроскопии в теории позволяет различать чуть ли не отдельные атомы.
Есть способы увидеть структуру молекул и без использования электронного микроскопа. Это рентгеноструктурный анализ и спектроскопия ядерно-магнитного резонанса (ЯМР). Но ЯМР-спектроскопия, к сожалению, подходит только для сравнительно небольших белков, а более крупные, в сотни тысяч аминокислот длиной, она «не берёт». Рентгеноструктурный анализ требует, чтобы молекулы находились в форме кристаллов. С этим есть трудности, так как далеко не все белки просто кристаллизовать. Ко всему прочему, когда биомолекулы находятся в кристаллической форме и/или в вакууме, как это часто бывает при электронной микроскопии, их свойства могут заметно отличаться от тех, что проявляются в натуральных условиях. А «натуральные условия» в данном случае — это водный раствор, потому что живые организмы по большей части состоят из воды.
Стекло и пачки фотографий
С водой в электронном микроскопе проблемы. Её не должно там быть, потому что между источником электронов и исследуемым образцом необходимо поддерживать вакуум. Если электроны будут «натыкаться» на препятствия до встречи с образцом, картинка получится зашумлённой. В воздушной атмосфере электроны пролетят всего несколько сантиметров, прежде чем полностью рассеяться.
Один из сегодняшних нобелевских лауреатов, швейцарский биофизик Жак Дубоше, придумал способ обойти эту проблему и при этом сохранить исследуемые молекулы в том виде, в котором они «плавают» в водном растворе цитоплазмы клеток. С помощью жидкого этана и азота он сильно охлаждал воду, окружающую образцы, так быстро, что она приобретала свойства стекла — витрифицировалась. Витрифицированная твёрдая вода по свойствам отличается ото льда. Её молекулы не выстраиваются в характерные для льда кристаллические решётки, а остаются практически на тех же местах, что и в момент начала охлаждения. Благодаря этому растворённые в такой воде молекулы «застывают» с той же структурой, какую они имеют и в живых клетках. На них точно так же, как и при «обычной» электронной микроскопии, могут налетать электроны, и «тени» от них будут всё так же видны. Фактически Дубоше добавил «крио-» (что значит «заморозка») к электронной микроскопии.
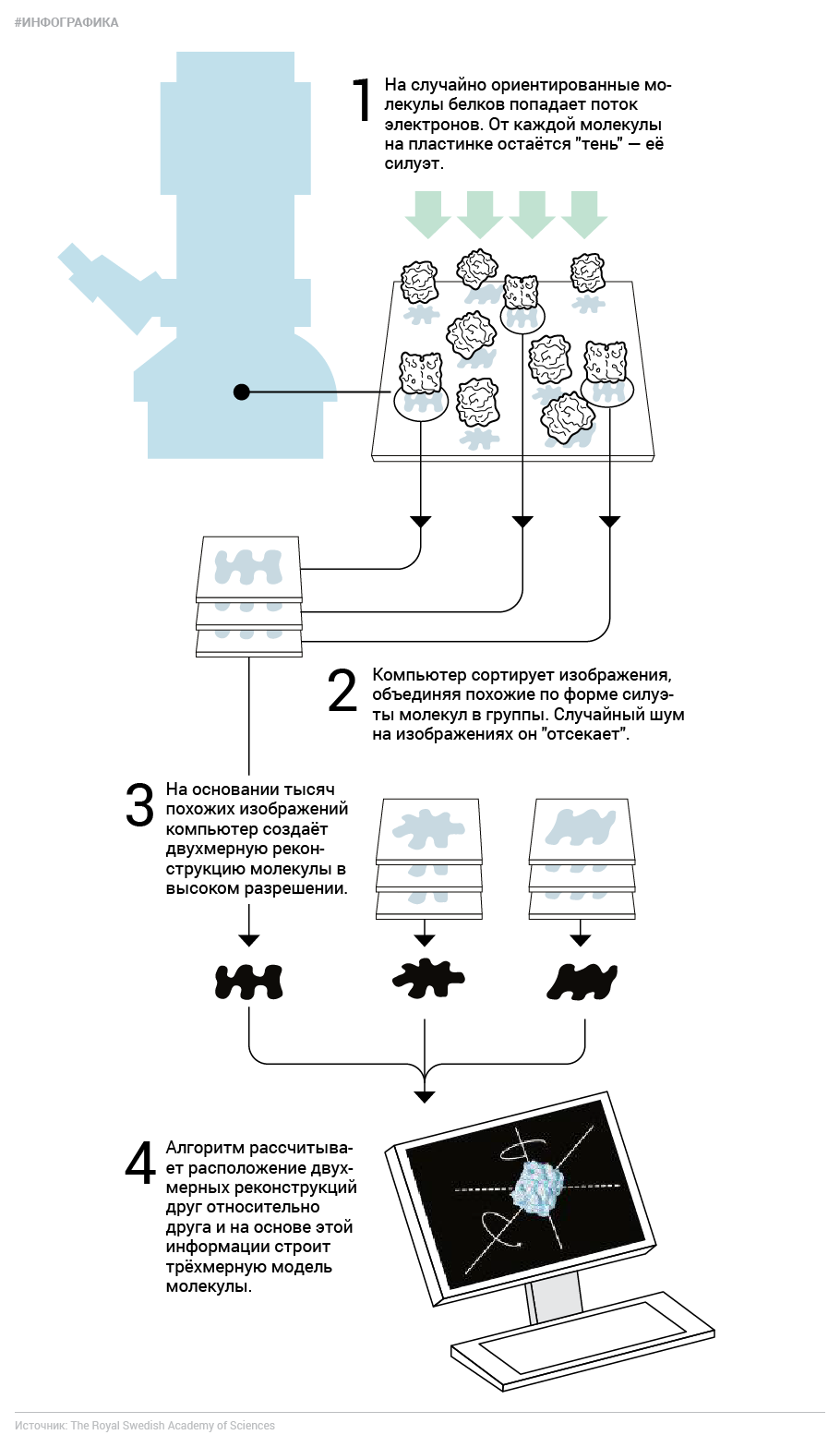
Казалось бы, все проблемы на этом закончились. Мы сохранили белок в первозданном виде, вот мы получили его «отпечаток», чего же ещё? Проблема в том, что крупные молекулы трёхмерны и при этом имеют очень сложную форму, а отдельные изображения проекций содержат очень много шума. Стало быть, по одной-единственной проекции белка его строение не вычислишь даже близко. Нужно много «фотографий» одинаковых молекул, сделанных с разных сторон, чтобы создать двухмерную реконструкцию. Первым задачу реконструкции трёхмерной структуры из двухмерной проекции решил Аарон Клуг ещё в 1962-м на примере симметричного хвоста бактериофага, за что в 1982 году получил Нобелевскую премию по химии.
А новоиспечённый лауреат Иоахим Франк, американский биофизик немецкого происхождения, разработал вычислительные принципы для реконструкции частиц с любой симметрией. Он создал алгоритмы, позволяющие вычленить изображение исследуемой молекулы из общей картины, и научил компьютер сортировать такие изображения по степени их сходства, чтобы из отдельных шумных проекций создать виды молекулы с разных сторон. Затем Франк и другие его коллеги придумали, как комбинировать эти двухмерные виды, чтобы создавать трёхмерные реконструкции. До недавних пор эта была нетривиальная задача, и её решение зависело от конкретного образца. Сейчас улучшенное ПО и высокие вычислительные мощности позволяют решить эту задачу гораздо проще.
Красивые картинки и не только
Методами, разработанными Дубоше и Франком, воспользовался шотландец Ричард Хендерсон и добавил к ним кое-что своё. Именно он в 1990 году выпустил статью, в которой продемонстрировал структуру пурпурного белка бактериородопсина в достаточно высоком разрешении. Однако не надо думать, что он пришёл на всё готовое. Бактериородопсином Хендерсон занимался уже задолго до развития криоэлектронной микроскопии и первый раз попытался установить строение этого белка в 1975 году. Тогда это казалось невозможным: молекула «в оригинале» была встроена в мембрану бактериальной клетки, да и кристаллизоваться никак не хотела. Тем не менее кое-какие детали структуры бактериородопсина ему удалось узнать уже тогда.
С тех пор Хендерсон и его коллеги вот уже более 40 лет уточняют структуры отдельных биологических молекул. Во многом благодаря его стараниям в 2013 году начался бум в области криоэлектронной микроскопии: были выпущены новые детекторы и программное обеспечение для реконструкций. Тогда же впервые была получена структура мембранного канала с атомарным разрешением. Говоря проще, в изучаемой молекуле можно было разглядеть каждый атом. После этого начался настоящий бум криоэлектронной микроскопии, и работ с использованием этого метода публикуют всё больше.
The final technical hurdle was overcome in 2013, when a new type of electron detector came into use. pic.twitter.com/Ue9c0R6v7y
В чём прелесть структур биомолекул, полученных таким образом, кроме их красоты и подробности? Как мы уже говорили выше, тонкое строение молекул надо знать, чтобы представлять себе их физические и химические свойства. Это важно в первую очередь для современной фармакологии. Известно, что очень близкие по строению вещества могут оказывать кардинально разное действие на организм из-за какого-нибудь небольшого различия в расположении нескольких атомов в их молекулах. Активность белков сильно разнится в зависимости от их конформации. А ведь сейчас всё большее количество лекарств от рака и прочих тяжёлых заболеваний представляют собой именно белки.
Криоэлектронная микроскопия также позволяет прояснить механизмы действия уже существующих лекарств. Можно сделать раствор препарата и того вещества, на которое он действует, витрифицировать этот раствор и посмотреть, как выглядят молекулы в нём. Скорее всего, лекарство и его мишень сольются в одну молекулу, и важно знать, какими частями они будут соприкасаться и как изменится форма каждого из участников тандема. Если витрифицировать несколько таких идентичных смесей в разное время, можно отследить этапы взаимодействия одной молекулы с другой.
Метод позволяет изучать не только отдельные молекулы, но и структуры покрупнее — например, вирусы. Учитывая недавние эпидемии лихорадки Эбола и лихорадки Зика, возбудители которых именно вирусы, знать их строение критически важно, чтобы понимать, какими лекарствами с ними бороться. Это верно и для ВИЧ, который хоть и громко заявил о себе на десятилетия раньше, но до сих пор угрожает нам. Так что у специалистов по криоэлектронной микроскопии впереди ещё много работы на благо человечества.
Атомы: строительные блоки молекул
Если молекулы – основные структуры, задействованные в химии – это слова, из которых состоят все окружающие нас материалы, тогда атомы – это буквы, строительные блоки молекул. Слова бывают разной длины, и типичная молекула тоже может содержать несколько атомов, или несколько сотен, или даже сто тысяч атомов. Молекула столовой соли NaCl состоит из двух атомов, натрия Na и хлора Cl. Молекула воды H2O содержит два атома водорода и один кислорода. Молекула столового сахара C12H22O11 содержит 12 атомов углерода, 11 кислорода и 22 водорода, организованных определённым образом.
Откуда нам известно о существовании атомов? Иногда их можно «видеть», так же, как мы видим молекулы, которые они могут формировать. Не глазами, но более продвинутыми устройствами. Один из методов использует сканирующий туннельный микроскоп, способный показывать атомы в кристалле или даже передвигать их по одному. Другой метод использует нашу возможность захвата ионов (немного изменённых атомов – подробности ниже).
На фото – три иона, пойманных одновременно. На них падает свет, они поглощают его и снова испускают. Повторно испущенный свет можно обнаружить, благодаря чему мы можем увидеть, где находятся ионы – примерно так отражение света от небольшого, но яркого бриллианта может помочь нам найти его.
Сколько же типов атомов существует? Типы называются «химическими элементами» и точное их количество зависит от того, как их считать. Но допустим, что атомный алфавит состоит из примерно сотни химических элементов, а к тонкостям подсчёта вернёмся позже. Так же, как мы могли назначить буквам алфавита от А до Я номера от 1 до 33, каждому элементу назначается не только имя, но и атомный номер (обозначается «Z»). Самые простые атомы – у водорода, их атомный номер = 1. Самые сложные в изобилии встречаются в природе, это уран с атомным номером 92. Другие – кислород (8), азот (7), кальций (20), криптон (36), лантан (57), платина (78). Полный список ищите в периодической системе элементов Менделеева. У каждого элемента своя химия – то, как он ведёт себя внутри молекул – примерно так, как у каждой буквы есть свои правила, по которым она может встречаться в словах.
Вопросы, которые можно задать об атомах:
1. Из чего состоят атомы?
2. В чём смысл атомного номера?
3. Каков главный источник различий в химическом поведении атомов разных элементов?
4. До какой степени разные атомы одного элемента схожи между собой?
5. Как части атома удерживаются вместе?
6. Почему атомы удерживаются вместе и образуют молекулы?
Оказывается, на все эти вопросы лучше всего отвечать, начав с первого: из чего состоят атомы? Атомы состоят из того, что обычно называют «субатомными частицами» (к сожалению, этот термин некорректен, поскольку у этих «частиц» есть некоторые свойства, частицам не присущие). Конкретнее, атомы состоят из набора небольших и очень лёгких электронов, окружающих крохотное, но тяжёлое атомное ядро, в котором содержится большая часть массы атома. Ядро состоит из других «частиц», в свою очередь также состоящих из других «частиц», и мы до них ещё доберёмся.
Рисованный атом
Частенько мы видим изображения атомов, нарисованные на книгах по химии, на рекламках и предупреждающих знаках. Пример – рис. 1. Он передаёт очень грубую идею того, как устроен атом: снаружи у него есть определённое количество электронов (синие), и они вращаются вокруг центрального атомного ядра. Ядро – это скопление протонов (красные) и нейтронов (белые).
Теперь мы можем ответить на 2-й вопрос: что означает атомное число Z? Это просто количество протонов в ядре. У кислорода атомный номер 8, и у него в ядре 8 протонов.
В простейших условиях атомное число также равняется количеству электронов атома. С количеством нейтронов всё сложнее, мы вернёмся к этому позже. У электронов отрицательный электрический заряд (-е), а у протонов – положительный (+е). Нейтроны нейтральны, электрического заряда у них нет. Когда количество электронов и протонов совпадает, их заряды взаимно уничтожаются, и у атома электрического заряда не наблюдается – такой атом нейтрален.
Но нет ничего необычного – к примеру, в процессе формирования молекул – если атом приобретёт или потеряет один или несколько внешних, валентных электронов. В этом случае электрические заряды электронов и протонов не уничтожаются, и получившийся заряженный атом называют ионом.
Более реалистичный атом
Хотя рис. 1 примерно описывает архитектуру атома – электроны действительно находятся снаружи, а ядро, состоящее из протонов и нейтронов, в середине – он совершенно не передаёт реальную форму и суть атома, поскольку он выполнен не в масштабе, а мы живём в квантовом мире, в котором объекты ведут себя так, что их сложно нарисовать или представить.
С проблемой масштаба можно разобраться, нарисовав более точное (хотя всё ещё несовершенное) изображение, рис. 2.

Рис 2. Атом – по большей части пуст (серая область). По нему быстро движутся электроны (голубые точки, нарисованы не в масштабе, а гораздо больше). В центре находится тяжёлое ядро (красные и белые точки, нарисованы больше, чем в масштабе).
Вот, что я попытался передать этим изображением. Во-первых, электроны очень, очень малы, настолько малы, что мы так и не смогли измерить их размер – может статься, что они точечные и не имеют размера, но они точно не больше, чем 1/100 000 000 от диаметра атома. Во-вторых, ядра (и протоны с нейтронами, их составляющие) также крайне малы, хотя они и больше, чем электроны. Их размер измерен, и он примерно в 10 000 – 100 000 раз меньше диаметра атома. Атом немного похож на деревню. Протоны и нейтроны в ядре – большие дома, находящиеся в центре деревни, а электроны – далеко разбросанные фермерские домики. На большей части сельской местности растут зерновые культуры и нет домов. И хотя территория, считающаяся частью деревни, может быть большой, реально занимаемая домами площадь очень мала.
Но эта аналогия не полная, поскольку электроны, в отличие от фермерских домиков, очень быстро двигаются по серому региону на картинке и вокруг ядра со скоростями порядка 1% от скорости света. Покрываемая ими территория обычно не сферическая, а более сложной формы, кроме того не все электроны перемещаются по одной и той же территории.
Но, как я вас предупреждал, рис. 2 тоже не точный. Во-первых, нужно было бы нарисовать ядро в тысячи раз меньше, а электроны – в миллионы раз меньше, только тогда их не было бы видно. Если бы атом был размером с вашу спальню, то его ядро было бы размером с пылинку. По сравнению со своими компонентами, атомы огромны! В каком-то смысле большую часть атома составляет пустота!
Во-вторых, изображение не передаёт мутную природу квантовой механики. Уравнения квантовой механики описывают и предсказывают поведение молекул, атомов и субатомных частиц, и эти уравнения говорят нам, что у этих частиц могут быть очень странные и неинтуитивные свойства. Хотя электроны в каком-то смысле точечные (допустим, если вы захотите столкнуть два электрона друг с другом, то обнаружите, что можете сдвинуть их вместе на сколь угодно малое расстояние, и они ничем не выдадут своей внутренней структуры, если она вообще есть), есть возможность сделать так, что они, будучи оставленными в покое, будут распространяться как волна и заполнят всё серое пространство на рис. 2. Если это звучит странно, это не оттого, что вы чего-то не поняли: это странно и об этом тяжело думать. Я-то уж точно не знаю, как нарисовать атом, чтобы не вводить вас в заблуждение, и эксперты всё ещё спорят о том, как лучше всего о нём думать. Так что пока просто примите это как странный факт.
Размер электрона слишком мал для измерения, и его масса настолько мала, что электрон может распространиться по всему атому. А вот у ядра есть вполне измеренный и известный размер, а его масса так велика – больше 99,9% массы всего атома – что оно вообще не распределяется в пространстве. Ядро сидит в середине серой области.
Атом и его химия
Лучший приходящий мне в голову способ описать атом: большая часть массы атома содержится в ядре, находящемся в его центре, вокруг которого распределились чрезвычайно мелкие электроны гораздо меньшей массы, причём сделали это совершенно не так, как ведут себя частицы, заполнив всю серую область рис. 2.
Небольшой размер ядра по отношению к полному размеру атома, и то, что оно обычно находится в его центре, объясняет, почему оно играет относительно слабую роль в химии. Химия происходит – то есть, формируются и меняются молекулы – когда атомы приближаются друг к другу, а это происходит, когда внешние, валентные электроны одного атома близко подходят к внешним электронам другого – когда край серой области одного атома приближается к краю серой области другого. В химических процессах атомное ядро остаётся в центрах атомов, и никогда не приближается к другим ядрам. Основная роль ядра – обеспечение положительного заряда, удерживающего электроны, и большей части массы (определяющей, как сложно другим объектам передвигать этот атом).
Это отвечает на 3-й вопрос: химию атома в основном определяют подробности, связанные с его внешними электронами. Эти детали можно узнать (сложным способом, через уравнения квантовой механики), исходя из атомного номера Z.
Вместо того, чтобы заняться химией – темой, которой хватит на целый курс – мы перейдём на уровень ниже, к субатомным частицам, по пути отвечая на другие вопросы. Перечислим вопросы, с которыми мы разобрались, и вопросы, которые ещё предстоит изучить.
1. Из чего состоят атомы? Снаружи – электроны, в центре – атомное ядро (из протонов и нейтронов).
2. В чём смысл атомного номера? Это количество протонов в ядре атома, которое, в обычных условиях равно количеству электронов, его окружающих.
3. Каков главный источник различий в химическом поведении атомов разных элементов? Свойства внешних электронов, определяемые общим количеством электронов у каждого элемента, к примеру, атомным номером.
4. До какой степени разные атомы одного элемента схожи между собой? Обсудим это в статье про изотопы.
5. Как части атома удерживаются вместе? Обсудим это в статье о роли электрических сил и квантовой механики.
6. Почему атомы удерживаются вместе и образуют молекулы? Обсудим это в статье о роли электронов и электрических сил в построении молекул из атомов.
А вот вам ещё вопрос, который мог возникнуть при изучении рис. 2:
Если атом – по большей части пуст, почему объекты кажутся твёрдыми? Почему нельзя протянуть руку через экран компьютера, если экран состоит из атомов, по большей части пустых?