Как выглядят молекулы разных веществ
Атомы и молекулы
Любые тела и предметы состоят из молекул — мелких частиц, на которые можно раздробить вещество физическими методами (например, растворением). Из этого вытекает определение молекулы: это самая мелкая частица вещества, сохраняющая его химические свойства.
Атомы — это мельчайшие частицы, сохраняющие свойства химического элемента, из них составляются молекулы. Атомы выделяются из молекул химическими методами.
Химические вещества могут быть газообразными, жидкими и твердыми. Частицы твердых веществ расположены ближе, а газов — дальше друг от друга, и они находятся в постоянном движении. Чем выше температура тела, тем быстрее движение молекул и атомов в нем, называемое броуновским, и тем больше расстояние между частицами. Внутри этого «бульона» постоянно действуют силы взаимного притяжения и отталкивания частиц, которые выражены тем сильнее, чем меньше разделяющее их расстояние.
Виды веществ
Вещества определяются как молекулярные и немолекулярные, в зависимости от того, из каких частиц они состоят. Разные типы частиц создают разные виды взаимосвязей, и это определяет физические и химические свойства соединений.
Имеющие молекулярное строение
Здесь связи между отдельными молекулами относительно слабые, поэтому легко разрываются при нагреве, причем тем легче, чем меньше молекулярная масса. Поэтому такие вещества плавятся при низких температурах и в нормальных условиях многие из них находятся в жидком или газообразном состоянии.
Это могут быть простые вещества: сера (S8), азот (N2), кислород (O2) и сложные, например, оксиды азота с разной валентностью (N2O, NO, N2O5, NO3), углекислый газ (CO2), серная кислота (H2SO4).
Самый известный пример такого рода — вода. Человеческое тело содержит около 65% воды. Даже шкала Цельсия привязана к ее плавлению (0°С) и кипению (100°С). В нормальных условиях это жидкость, но в природе встречается во всех трех агрегатных состояниях в виде снега или льда, воды и пара.
Электрическая полярность молекулы задает воде интересные особенности. Например, ее удельная теплоемкость настолько велика, что это делает ее одним из главных регуляторов климата Земли. Интересно, что наибольшей плотности она достигает не в виде льда, а в жидком состоянии, при 4 °C. Поэтому возле дна скапливается самая тяжелая вода, не достигающая замерзания, а более легкий твердый лед выталкивается наверх.
Еще один пример — йод. В нормальных условиях он имеет форму кристаллов, а при нагревании сразу переходит в газообразное состояние, что называется возгонкой.
Строящиеся из немолекулярных частиц
Целые классы соединений состоят не из молекул, а из атомов или ионов. Поскольку электрические связи разнозаряженных ионов или ковалентные атомные связи крепче, чем межмолекулярные, они разрушаются при нагреве гораздо труднее. Поэтому такие вещества, как правило, имеют твердую форму и высокие температуры плавления и кипения. Их определяют как вещества немолекулярного строения.
Примеры:
Таблица молекулярного и немолекулярного строения вещества:
| Строение вещества | Молекулярное | Немолекулярное |
| Мельчайшие структурные единицы | Молекулы | Ионы и атомы |
| Агрегатное состояние | Газообразное, жидкое, твердое | В основном, твердое |
| Температуры плавления и кипения | Низкие | Высокие |
Аморфные и кристаллические вещества
Твердые вещества могут быть аморфными или кристаллическими.
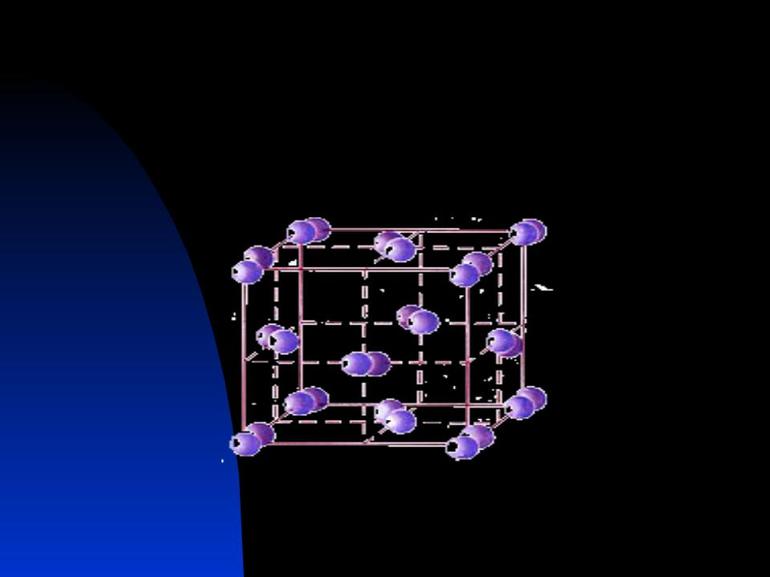
Кристаллические отличаются тем, что их структурные единицы располагаются в повторяющемся порядке, образуя кристаллические решетки.
Аморфные соединения имеют в своем составе длинные тяжелые молекулы, которые не помещаются в правильные структуры кристаллических решеток, и поэтому переход из твердого состояния в жидкое у них совершается постепенно, без четкой границы. То есть аморфные вещества не имеют точно определенной температуры плавления. Очень знакомый пример такого типа — пластилин, который используется в мягком, а не твердом или жидком состоянии. Также это различные пластмассы, смолы, стекло.
Пластичность и мягкость разогретого стекла дает возможность лепить из него, как из пластилина, только не руками, а инструментами. Стеклянная посуда, лампочки, трубки, оконное стекло — все это было бы невозможно сделать из кристаллических веществ. А как выручают человека полиэтиленовые бутылки и фасовочные пакетики!
Еще один близкий пример — сахарная карамель. Она при нагревании становится тягучей, мягкой, как и все аморфные вещества. А если дать карамели залежаться в сухом помещении несколько месяцев, ее поверхность покроется белым налетом маленьких кристаллов сахара. То есть некоторые аморфные вещества способны переходить в кристаллическую форму.
Типы кристаллических решеток
Разные виды частиц образуют разные кристаллические решетки. Существует 4 их типа:
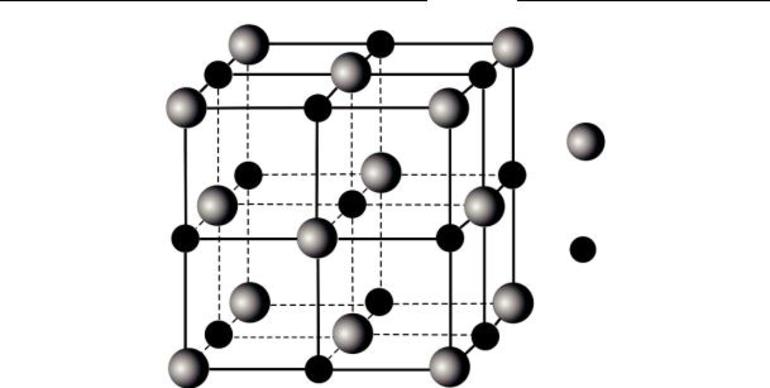
Ионный тип кристалла
Это вид решетки, образуемый ионами — частицами, несущими на себе разноименные электрические заряды, чередующиеся в узлах решетки. Электроотрицательность анионов притягивает к себе положительно заряженные катионы, что придает решетке твердость. Поэтому такие соединения тугоплавки, зато хрупки, обладают хорошей растворимостью в воде и электропроводностью. Это основания, основные оксиды, органические и неорганические соли.
Пример такого кристалла — обычная поваренная соль, хлорид натрия. Его кубическая решетка сформирована катионами Na+ и анионами Cl-.
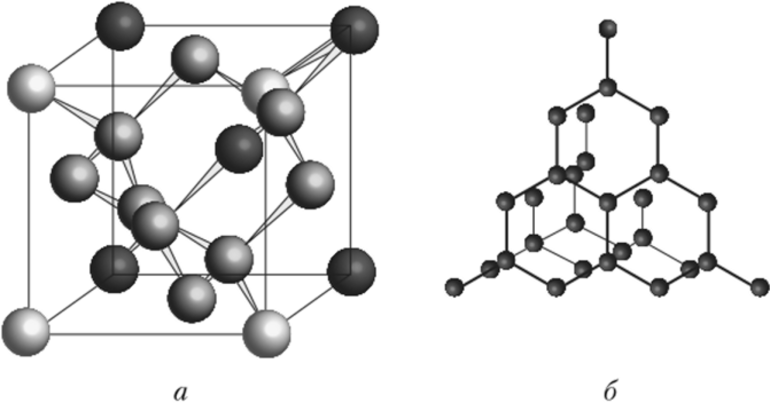
Атомная решетка
Этот вид кристаллов сформирован атомами, образующими между собой полярные и неполярные ковалентные связи. Такие связи очень прочны, поэтому эти вещества обладают высокой твердостью, тугоплавки и не растворяются в воде. В природе они мало распространены.
Характерный пример — углерод, имеющий две аллотропных формы, и обе — атомного типа.
Кристалл графита имеет слоистую структуру, атомы в слоях расположены по углам шестиугольника, расстояние между слоями значительно больше и межатомные связи слабее, чем внутри слоя. Поэтому кристалл хрупкий, легко расслаивается и крошится. Благодаря этому свойству, графит используется в карандашах или в виде графитовой смазки.
Алмаз — очень плотный кристалл кубической формы, среди природных минералов имеет наивысшую твердость. Образуется такая форма углерода из графита при очень высоких температуре и давлении.
Другие примеры: бор (B), германий (Ge), кремний (Si), оксид кремния (SiO2), карбид (B4C) и нитрид (BN) бора.
Состоящая из молекул
Такая решетка имеет в узлах молекулы. Силы межмолекулярного притяжения относительно слабее, и это определяет свойства веществ с молекулярной кристаллической решеткой — их кристаллы непрочные, плавятся при низких температурах, не электропроводны.
Примеры веществ с молекулярной кристаллической решеткой: полярной ковалентной связью обладает вода (H2O); а соединения неполярной ковалентной связью — твердый оксид углерода (CO2), сера (S8).
Очень интересно, что сера образует два вида кристаллов. В нормальных условиях кристаллы серы имеют интересную усечённо-ромбическую форму, а при 96 °C и выше вырастают длинные игольчатые кристаллы.
Также молекулярные кристаллы образуют многие из твердых органических соединений с достаточно сложной формулой: сахар, глюкоза.
Металлическая решетка
Эта решетка выделяется из общего ряда необычностью строения. Атомы металла, расположенные в узлах решетки, легко расстаются с внешними электронами, что превращает атом в катион, а свободно блуждающие электроны создают делокализованное электронное облако. Эта необычность определяет характерные особенности металлов: ковкость, пластичность, металлический блеск, электро- и теплопроводность.
Ионы более химически активны, чем электронейтральные атомы, этим объясняется способность металлов к поверхностному окислению. Окислы некоторых металлов, например, алюминия, образуют пленку, защищающую поверхность от контакта с кислородом воздуха. Такая особенность даже используется для защиты металлических изделий. Металлы, окислы которых образуют рыхлую структуру (например, железо), подвержены коррозии в гораздо большей степени. Примеры: железо (Fe), серебро (Ag), медь (Cu), алюминий (Al).
Что такое молекула?
Определение:
В космосе обнаружены как простые, так и сложные органические (углеродосодержащие) молекулы. Углерод образуется в ядрах красных гигантских звезд, где он циркулирует на поверхности и распределяется в пространстве.
Впечатление художника о простых и сложных органических (углеродосодержащих) молекулах, обнаруженных в космосе.
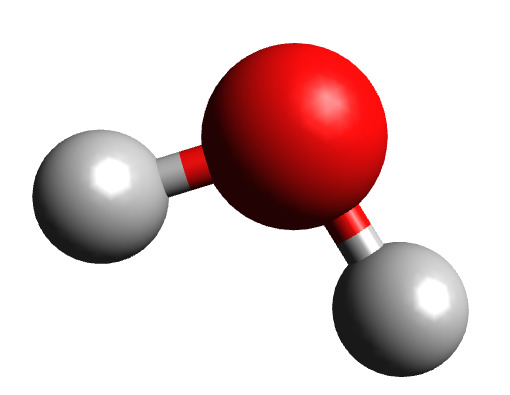
Она может состоять из атомов одного химического элемента, как в случае с кислородом (O2), или из различных элементов, как в случае с водой (H2O). Как компоненты материи, молекулы распространены в органических веществах (и, следовательно, в биохимии) и являются тем, что позволяет создавать жизнетворные элементы, таким как жидкая вода и воздухопроницаемые атмосферы.
Типы связей:
Ионная связь, напротив, представляет собой тип химической связи, которая включает электростатическое притяжение между противоположно заряженными ионами. Ионы, участвующие в такой связи, — это атомы, которые потеряли один или несколько электронов (называемые катионами), и те, которые приобрели один или несколько электронов (называемые анионами). В отличие от ковалентности, этот перенос называется электровалантом.
Схема молекулы воды, которая состоит из двух атомов водорода и одного атома кислорода.
История
Исторически молекулярная теория и атомная теория тесно переплетены. Первые упоминания о том, что материя состоит из “отдельных единиц”, появились в Древней Индии, где последователи джайнизма придерживались идеи, что все вещи состоят из мелких неделимых элементов, которые, соединяясь, образуют более сложные объекты.
В Древней Греции философы Левкипп и Демокрит ввели термин «атомос», имея в виду «мельчайшие неделимые части материи», от которых мы получаем современный термин «атом».
Затем в 1661 году натуралист Роберт Бойл в трактате по химии под названием «Скептический химик» утверждал, что материя состоит из различных комбинаций «корпускул» (устаревший термин для обозначения мельчайшей частицы материи), а не земли, воздуха, ветра, воды и огня. Однако эти наблюдения ограничивались областью философии.
Только в конце 18-го и начале 19-го веков Закон сохранения массы Антуана Лавуазье и Закон множественных пропорций Дальтона привели атомы и молекулы в область точной науки. Первые предположили, что элементы являются основными веществами, которые не могут быть подвергнуты дальнейшему разложению, в то время как последние предположили, что каждый элемент состоит из одного уникального типа атома и что они могут соединяться вместе, образуя химические соединения.
Сканирующий туннельный микроскоп
Еще одна находка пришла в 1865 году, когда Иоганн Йозеф Лошмидт измерил размер молекул, составляющих воздух, что дало ощущение масштаба молекул. Изобретение сканирующего туннельного микроскопа (СТМ) в 1981 году позволило впервые непосредственно наблюдать атомы и молекулы.
Сегодня наше понятие молекул получает дальнейшее развитие благодаря постоянным исследованиям в области квантовой физики, органической химии и биохимии. А когда речь заходит о поисках жизни в других мирах, необходимо понимание того, что нужно органическим молекулам, чтобы выйти из комбинации химических строительных блоков.
Увидеть каждый атом: за что дали Нобелевку по химии
В школе все науки понятно и привычно делили сферы влияния. В домашних заданиях явления требовали отнести либо к физическим, либо к химическим. В реальной жизни это уже давно не так, и Нобелевская премия по химии 2017 года — очередное тому доказательство. На престижнейшую научную награду для химиков номинированы трое учёных, работающих в сфере биологии и открывших способ, как увидеть структуру отдельных биомолекул в их естественной среде обитания — водном растворе.
Коллаж © L!FE. Фото: © Shutterstock © wikipedia.org
Уже не первый год Нобелевскую премию по химии присуждают за биологические открытия. И на этот раз Ричард Хендерсон, Иоахим Франк и Жак Дубоше были номинированы на Нобелевку за «развитие криоэлектронной микроскопии высокого разрешения для определения структуры биомолекул в растворе». Неужели в науке о превращениях веществ за последние десятилетия не случилось ничего прорывного? А если случилось, то почему с химиками обходятся так несправедливо?
На самом деле несправедливости тут нет. Современная наука мультидисциплинарна. Каждый уважающий себя исследователь подходит к интересующей его проблеме с самых разных сторон, используя солидный набор методов для её изучения. Теперь уже недостаточно провести какую-нибудь одну химическую реакцию или вывести линию мух с определённым геном. Статью об исследовании, в котором использованы один-два метода, приличный научный журнал не примет. Необходимо использовать и физические, и химические, и биологические подходы к одному и тому же вопросу. В конце концов, всё живое состоит из молекул, традиционных объектов изучения химии, а эти молекулы и их группы подчиняются физическим законам.
К тому же наука о жизни давно уже ушла от препарирования лягушек и наблюдения за цветением растений. Многие современные биологи в ходе работы ни разу не сталкиваются с живыми объектами. Огромные силы брошены на фронт биоинформатики — анализа последовательностей нуклеотидов ДНК и аминокислот в белках с использованием компьютерных алгоритмов. Классической биологии в этом, прямо скажем, нет. Для биоинформатических изысканий не нужны ни пробирки, ни микроскопы, ни другие предметы, на фоне которых журналисты и телевизионщики обычно снимают учёных.
Но есть и те, кто стоит к живому чуть ближе. Они работают не с целыми организмами и даже не с конкретными органами, а с отдельными биологическими молекулами. Кстати, эти молекулы не такие уж и мелкие. Как правило, они состоят из сотен тысяч атомов — особенно если говорить о белках и нуклеиновых кислотах. Способов соединить эти атомы великое множество, а ведь от них зависят форма и поведение молекулы. Ферменты — биологические катализаторы — потому и помогают проводить биохимические реакции, что способны менять форму своих молекул.
Как увидеть отдельную молекулу?
Фото: © REUTERS/Toby Melville
Конечно, молекулы белков и нуклеиновых кислот крупнее, чем какой-нибудь глюкозы. Но всё же они недостаточно большие, чтобы их было видно в обычный, световой микроскоп. Его разрешение ограничено длиной световой волны, падающей на исследуемый объект. Как правило, она составляет не более 250 нанометров. Соответственно, все объекты размером меньше 250 нанометров в световой микроскоп видны не будут.
Обойти эту проблему в 1930-х годах позволили электронные микроскопы. В них на исследуемый объект не светит солнце или лампочка — на него обрушивается поток электронов. В остальном принцип работы электронного микроскопа похож на принцип самого простого светового микроскопа, но длина волны электронов существенно короче длины волны видимого света. Поэтому теоретическое разрешение электронной микроскопии в теории позволяет различать чуть ли не отдельные атомы.
Есть способы увидеть структуру молекул и без использования электронного микроскопа. Это рентгеноструктурный анализ и спектроскопия ядерно-магнитного резонанса (ЯМР). Но ЯМР-спектроскопия, к сожалению, подходит только для сравнительно небольших белков, а более крупные, в сотни тысяч аминокислот длиной, она «не берёт». Рентгеноструктурный анализ требует, чтобы молекулы находились в форме кристаллов. С этим есть трудности, так как далеко не все белки просто кристаллизовать. Ко всему прочему, когда биомолекулы находятся в кристаллической форме и/или в вакууме, как это часто бывает при электронной микроскопии, их свойства могут заметно отличаться от тех, что проявляются в натуральных условиях. А «натуральные условия» в данном случае — это водный раствор, потому что живые организмы по большей части состоят из воды.
Стекло и пачки фотографий
С водой в электронном микроскопе проблемы. Её не должно там быть, потому что между источником электронов и исследуемым образцом необходимо поддерживать вакуум. Если электроны будут «натыкаться» на препятствия до встречи с образцом, картинка получится зашумлённой. В воздушной атмосфере электроны пролетят всего несколько сантиметров, прежде чем полностью рассеяться.
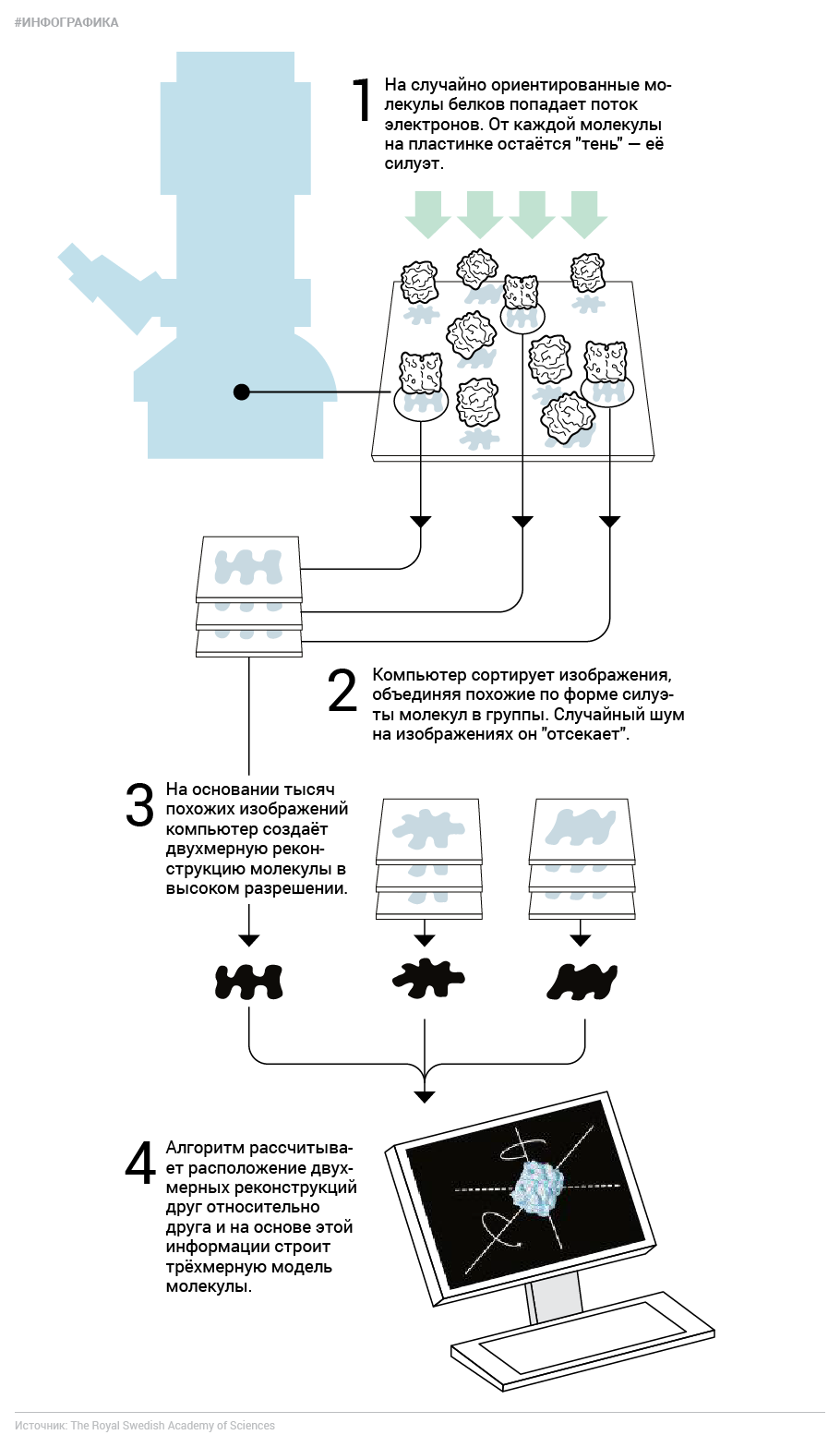
Один из сегодняшних нобелевских лауреатов, швейцарский биофизик Жак Дубоше, придумал способ обойти эту проблему и при этом сохранить исследуемые молекулы в том виде, в котором они «плавают» в водном растворе цитоплазмы клеток. С помощью жидкого этана и азота он сильно охлаждал воду, окружающую образцы, так быстро, что она приобретала свойства стекла — витрифицировалась. Витрифицированная твёрдая вода по свойствам отличается ото льда. Её молекулы не выстраиваются в характерные для льда кристаллические решётки, а остаются практически на тех же местах, что и в момент начала охлаждения. Благодаря этому растворённые в такой воде молекулы «застывают» с той же структурой, какую они имеют и в живых клетках. На них точно так же, как и при «обычной» электронной микроскопии, могут налетать электроны, и «тени» от них будут всё так же видны. Фактически Дубоше добавил «крио-» (что значит «заморозка») к электронной микроскопии.
Казалось бы, все проблемы на этом закончились. Мы сохранили белок в первозданном виде, вот мы получили его «отпечаток», чего же ещё? Проблема в том, что крупные молекулы трёхмерны и при этом имеют очень сложную форму, а отдельные изображения проекций содержат очень много шума. Стало быть, по одной-единственной проекции белка его строение не вычислишь даже близко. Нужно много «фотографий» одинаковых молекул, сделанных с разных сторон, чтобы создать двухмерную реконструкцию. Первым задачу реконструкции трёхмерной структуры из двухмерной проекции решил Аарон Клуг ещё в 1962-м на примере симметричного хвоста бактериофага, за что в 1982 году получил Нобелевскую премию по химии.
А новоиспечённый лауреат Иоахим Франк, американский биофизик немецкого происхождения, разработал вычислительные принципы для реконструкции частиц с любой симметрией. Он создал алгоритмы, позволяющие вычленить изображение исследуемой молекулы из общей картины, и научил компьютер сортировать такие изображения по степени их сходства, чтобы из отдельных шумных проекций создать виды молекулы с разных сторон. Затем Франк и другие его коллеги придумали, как комбинировать эти двухмерные виды, чтобы создавать трёхмерные реконструкции. До недавних пор эта была нетривиальная задача, и её решение зависело от конкретного образца. Сейчас улучшенное ПО и высокие вычислительные мощности позволяют решить эту задачу гораздо проще.
Красивые картинки и не только
Методами, разработанными Дубоше и Франком, воспользовался шотландец Ричард Хендерсон и добавил к ним кое-что своё. Именно он в 1990 году выпустил статью, в которой продемонстрировал структуру пурпурного белка бактериородопсина в достаточно высоком разрешении. Однако не надо думать, что он пришёл на всё готовое. Бактериородопсином Хендерсон занимался уже задолго до развития криоэлектронной микроскопии и первый раз попытался установить строение этого белка в 1975 году. Тогда это казалось невозможным: молекула «в оригинале» была встроена в мембрану бактериальной клетки, да и кристаллизоваться никак не хотела. Тем не менее кое-какие детали структуры бактериородопсина ему удалось узнать уже тогда.
С тех пор Хендерсон и его коллеги вот уже более 40 лет уточняют структуры отдельных биологических молекул. Во многом благодаря его стараниям в 2013 году начался бум в области криоэлектронной микроскопии: были выпущены новые детекторы и программное обеспечение для реконструкций. Тогда же впервые была получена структура мембранного канала с атомарным разрешением. Говоря проще, в изучаемой молекуле можно было разглядеть каждый атом. После этого начался настоящий бум криоэлектронной микроскопии, и работ с использованием этого метода публикуют всё больше.
The final technical hurdle was overcome in 2013, when a new type of electron detector came into use. pic.twitter.com/Ue9c0R6v7y
В чём прелесть структур биомолекул, полученных таким образом, кроме их красоты и подробности? Как мы уже говорили выше, тонкое строение молекул надо знать, чтобы представлять себе их физические и химические свойства. Это важно в первую очередь для современной фармакологии. Известно, что очень близкие по строению вещества могут оказывать кардинально разное действие на организм из-за какого-нибудь небольшого различия в расположении нескольких атомов в их молекулах. Активность белков сильно разнится в зависимости от их конформации. А ведь сейчас всё большее количество лекарств от рака и прочих тяжёлых заболеваний представляют собой именно белки.
Криоэлектронная микроскопия также позволяет прояснить механизмы действия уже существующих лекарств. Можно сделать раствор препарата и того вещества, на которое он действует, витрифицировать этот раствор и посмотреть, как выглядят молекулы в нём. Скорее всего, лекарство и его мишень сольются в одну молекулу, и важно знать, какими частями они будут соприкасаться и как изменится форма каждого из участников тандема. Если витрифицировать несколько таких идентичных смесей в разное время, можно отследить этапы взаимодействия одной молекулы с другой.
Метод позволяет изучать не только отдельные молекулы, но и структуры покрупнее — например, вирусы. Учитывая недавние эпидемии лихорадки Эбола и лихорадки Зика, возбудители которых именно вирусы, знать их строение критически важно, чтобы понимать, какими лекарствами с ними бороться. Это верно и для ВИЧ, который хоть и громко заявил о себе на десятилетия раньше, но до сих пор угрожает нам. Так что у специалистов по криоэлектронной микроскопии впереди ещё много работы на благо человечества.
Молекула – определение, виды и примеры
Определение молекулы
Молекула представляет собой два или более атомов, связанных вместе, чтобы сформировать единый химический объект. Каждый атом несет определенное количество электронов, которые вращаются вокруг ядра. Ядро состоит из протонов и нейтронов, разных чисел в разных элементах. Электроны, которые вращаются вокруг ядра, существуют в различных облаках или валентных оболочках. Эти оболочки предпочитают иметь определенное количество электронов, в зависимости от оболочки. Иногда один атом отдает электроны другому атому. Эти атомы одновременно изменяют электрический заряд и становятся ионами. Один будет положительным, а другой – отрицательным. Эти противоположные электрические эффекты притягивают друг друга и образуют ионные связи. Эти связи не образуют молекулы, и ионы могут быть легко разделены. Однако иногда атом делится электронами.
Примеры Молекулы
Молекулы на основе углерода
Углерод, вероятно, самый важный элемент для всех живых организмов. Углерод обладает уникальной способностью образовывать 4 ковалентные связи, которые могут привести к образованию длинных цепочек молекул. Все органические молекулы содержат углерод, и способность манипулировать углеродными связями была, вероятно, очень ранним развитием в эволюции жизни. Все типы молекул, описанные ниже, содержат углерод с большим разнообразием других атомов, ковалентно связанных с углеродом. Углерод, когда он образует двойные связи с другими атомами углерода, может вращаться вокруг связи. Это может создать молекулы, которые являются гибкими, и различаются по форме. Большое разнообразие молекул углерода различной формы в биологическом мире создает уникальные взаимодействия.
Аденозинтрифосфат (АТФ)
Молекула, которая почти каждый организм использует аденозинтрифосфат или АТФ. Аденозин – это молекула из нескольких углеродных колец, представленная правой стороной молекулы ниже. Левая сторона представляет собой цепь фосфатных групп, которые представляют собой атомы фосфора, ковалентно связанные с атомами кислорода. Когда связи между этими фосфатными группами разрываются, энергия высвобождается. Обычно АТФ функционирует как коэнзим, передавая энергию от связи ферменту, который может использовать энергию для ускорения химической реакции. Две молекулы присутствуют после разрыва, свободно плавающие фосфатная группа и аденозиндифосфат или ADP. Через процессы гликолиза (расщепление глюкозы) и дыхания (использование кислорода для дальнейшего расщепления глюкозы) вырабатывается АТФ, который затем может использоваться для получения энергии в других клеточных процессах.
Типы Биологических Молекул
Молекула может иметь совсем другие свойства, чем атомы, из которых она состоит. Например, сахар представляет собой комбинацию углерода, кислорода и водорода. Углерод, как вы видели в конце пожара, представляет собой серо-пыльное вещество. Кислород и водород – оба газа. Каким-то образом, в сочетании с ковалентными связями, углеродные нити с кислородом и водородом становятся сладким и богатым энергией питательным веществом, на которое многие животные полагаются для выживания. В биологии есть много молекул, которые производят животные, но они бывают только нескольких типов.
Белки
Одним из наиболее важных типов молекул, продуцируемых клетками, является белок. Молекула белка представляет собой полимер. Это означает, что он был образован из множества более мелких молекул, известных как мономеры. Эти молекулы называются аминокислоты, ДНК каждого организма кодирует определенные последовательности аминокислот. Подходящие аминокислоты связаны вместе, и сложные взаимодействия между аминокислотами заставляют их складываться. Эти складки приводят к более сложным структурам. Структура белка позволяет ему функционировать по-разному.
Клетки используют белковые молекулы в широком спектре задач. Их можно использовать в качестве ферментов для катализа специфических реакций. Они могут образовывать антитела как часть иммунной защиты организма. Некоторые белки просто хранят аминокислоты для последующего использования. Есть белки, встроенные в клетка мембраны, которые позволяют ионам и другим молекулам проходить через мембраны. На нервных клетках белки используются для получения сигналов, посылаемых другими нервами, таким образом, передавая сигнал. В мускул клетки, белки несут ответственность за сокращение мышц. Еще другие белки используются просто как структурная поддержка. Список функций, для которых клетки используют белковые молекулы, огромен.
Липиды
Другим важным классом молекулы является класс липидов. Липиды – это молекулы, которые плохо смешиваются с водой. гидрофобный, Часто связи в молекулах липида не создают зарядов, а являются неполярными. Эти неполярные молекулы не любят смешиваться с водой, очень полярная молекула, Липиды также являются полимерами и созданы из двух меньших молекул, глицерин и жирная кислота. Эти молекулы липидов накапливают много энергии и часто используются в жировых клетках для хранения энергии для организма. Иногда гидрофильный или любящий воду фосфат глава прикрепляется к молекулам липидов. Это создает фосфолипид, Многие фосфолипиды могут быть соединены для создания клеточных мембран. Иногда липиды могут стать стероидами или химическими веществами, которые заставляют клетки реагировать по-разному. Один из них, холестерин, может влиять на жесткость клеточных мембран, что, в свою очередь, может влиять на жесткость артерий и вен. Это одна из причин, почему врачи рекомендуют снизить уровень холестерина, чтобы ткани могли иметь правильную текстуру.
углеводы
В то время как белки и липиды обеспечивают структуру, поддержку и функции ферментов, углеводы в основном отвечают за энергию. Большинство животных перерабатывают какой-то сахар, чтобы их клетки функционировали. Растения часто хранят эти сахара в виде более сложных углеводов, таких как крахмалы. Отдельные сахара известны как моносахариды, в то время как несколько связанных сахаров называются полисахаридами. Растения иногда используют эти молекулы углеводов для других функций, таких как структура. Основным структурным углеводным растением является целлюлоза, которую они используют для создания клеточных стенок вокруг своих клеток. Оказывая давление на заполненный водой вакуоль внутри клетки молекулы целлюлозы сдвигаются и становятся жесткими.
Как молекула энергии, растения создают глюкозу через фотосинтез, Используя энергию света, растения могут накапливать энергию в связях глюкозы. Хотя глюкоза является легкой молекулой для получения энергии, ее не удобно хранить. Вместо этого растения объединяют молекулы глюкозы вместе, образуя более крупные полисахариды, которые можно складывать и хранить в специализированных клетках для дальнейшего использования. Животные хорошо знают об этом факте, и травоядные могут выживать только на глюкозе и других углеводах, присутствующих в растение матер. Фактически, даже люди могут процветать на травоядной диете, потому что у растений есть все углеводы и белок, в которых человек нуждается.
Нуклеиновые кислоты
Самая важная молекула жизни, ДНК, состоит из переплетенных нитей нуклеиновых кислот. Нуклеиновые кислоты – это молекулы, которые сами по себе ничего не значат, но при соединении в серию содержат информацию. Информация, которую они несут, может быть «прочитана» определенными белками, которые работают вместе, чтобы преобразовать кодоны ДНК в цепочки аминокислот, которые превращаются в функциональные белки. Этот процесс создания белков из информации, содержащейся в молекулах, известен как биосинтез и является основой всей жизни. Организмы могут копировать свои информационные молекулы и передавать их генетика на их потомстве. Начало жизни, вероятно, началось только с одной или двух из этих самовоспроизводящихся молекул, и за миллиарды лет расширилось (и сократилось) в разнообразие, которое мы видим сегодня.
викторина
1. Что из следующего НЕ является молекулой?A. H2OB. Cl-C. O2
Ответ на вопрос № 1
В верно. Cl– является примером иона или заряженного атома. Поскольку есть только один атом, это не молекула. O2 состоит из 2 атомов кислорода, соединенных вместе, образуя молекулу кислорода.
2. Поваренная соль состоит из двух ионов Na + и Cl–, которые существуют в матрице. Ионы не связываются вместе, но притягиваются друг к другу и образуют поваренную соль или NaCl. Является ли NaCl молекулой?A. даB. нетC. Только когда в матрице
Ответ на вопрос № 2
В верно. Только ковалентно связанные атомы могут образовывать молекулы. Даже в матрице ионных связей, которая существует в соли, между ионами существует только слабая связь, и они легко могут быть растворены растворитель,
3. Полимеры – это мономеры, связанные вместе. Мономеры являются примером чего?A. МолекулыB. атомыC. Ядра
Ответ на вопрос № 3
верно. И мономеры, и полимеры считаются молекулами, потому что они состоят из атомов, связанных вместе. Полимеры обычно считаются макромолекулами, потому что они очень большие.