Как вылечить брадикардию у ребенка
Брадикардия у детей
Брадикардия – это состояние, характеризующееся уменьшением частоты сокращений сердца относительно возрастной нормы. Она может быть проявлением самых разных заболеваний, начиная от кардиологической патологии и заканчивая особенностями психоэмоционального развития. Вне зависимости от причины брадикардия сердца у детей, подростков и взрослых требует постоянного мониторинга и своевременного лечения.
Общая информация
Современная медицина не выделяет урежение частоты сердечных сокращений в самостоятельное заболевание, а расценивают ее как симптом тех или иных патологических процессов. Как правило, у детей (в том числе новорожденных) и подростков выявляется синусовая форма брадикардии сердца, которая может также сопровождаться аритмией.
Оценка наличия или отсутствия патологии требует комплексного подхода, поскольку нормы ЧСС в зависимости от возраста – это лишь усредненные значения.
Симптомы брадикардии у детей
Легкая форма синусовой брадикардии сердца у ребенка или подростка состояние не вызывает никаких патологических симптомов. Ткани организма получают достаточное количество кислорода, так что малыш не испытывает дискомфорта.
При значительном замедлении частоты сердечных сокращений появляются признаки кислородного голодания тканей: утомляемость, сонливость, снижение успеваемости в школе, забывчивость. По мере прогрессирования заболевания появляются головокружения различной тяжести, приводящие к падениям и потере сознания. При этом кожа становится бледной с синюшным оттенком, появляется синева вокруг рта и холодный липкий пот. Как правило, приступ длится несколько секунд. При постоянной брадикардии обмороки нередко возникают на фоне пребывания в душном помещении, стресса, физической перегрузки.
Причины брадикардии у детей
Брадикардия – это, в первую очередь, реакция сердца на те или иные состояния. В связи с этим список причин, которые могут вызвать подобную проблему, очень велик. Наиболее важны следующие факторы:
В зависимости от возраста малыша, в числе наиболее вероятных причин преобладают те или иные группы факторов.
Брадикардия у недоношенных и новорожденных детей
Сниженная частота сердечных сокращений при рождении раньше срока является физиологической и связана с незрелостью систем регуляции ЧСС. При должном уходе и медикаментозной поддержке состояние постепенно купируется.
Самыми частыми причинами развития брадикардии у новорожденного ребенка являются пороки сердца, различные виды энцефалопатии, родовые травмы. Иногда выраженное снижение ЧСС говорит о развитии поперечной атриовентрикулярной блокады (АВ-блокады). Это опасное состояние, требующее немедленной медицинской помощи.
Брадикардия у детей первого года жизни (грудничков)
В этом возрасте патологическое состояние может быть вызвано теми же причинами, что и у новорожденных. Кроме того, стоит обратить внимание на уровень гормонов щитовидной железы. Гипотиреоз часто вызывает урежение частоты сердечных сокращений.
Брадикардия у дошкольников
Брадикардия у ребенка в возрасте от 2 до 7 лет нередко связана с инфекционными заболеваниями, которые осложнились миокардитом – воспалением сердечной мышцы. Также в этом возрасте часто встречаются отравления и передозировки лекарственных препаратов. Третьей распространенной причиной брадикардии у ребенка в возрасте 3–4 лет и старше являются аденоиды. Затруднение носового дыхания приводит к хронической гипоксии, вызывающей урежение ЧСС.
Брадикардия у школьников и подростков
Снижение частоты сердечных сокращений в школьном возрасте может быть обусловлено теми же причинами, что у дошкольников, но к ним присоединяются различные виды гастритов и дуоденитов, связанные с изменением режима питания.
Подростки нередко сталкиваются с проявлением вегето-сосудистой дистонии, которая может протекать по ваготоническому типу. Снижение ЧСС сопровождается падением давления, головокружениями, обмороками. В этом же возрасте нередко манифестируют аутоиммунные заболевания, синдром слабости синусового узла.
Особняком стоит синусовая брадикардия сердца у подростков спортсменов, которая не является симптомом заболевания. Регулярные интенсивные занятия спортом приводят к развитию физиологического снижения ЧСС в спокойном состоянии, поскольку сердце адаптируется к дополнительной работе во время тренировок.
Осложнения брадикардии у детей
Наиболее грозным осложнением брадикардии в любом возрасте является приступ Морганьи-Адамса-Стокса – внезапная потеря сознания вследствие острого кислородного голодания головного мозга. Состояние длится не более 3–10 секунд, но внезапное падение может стать причиной различных травм. Кроме того, ишемия в некоторых случаях приводит к развитию инфаркта миокарда или инсульта.
Диагностика брадикардии у детей
Диагностикой брадикардии у детей любого возраста занимается детский кардиолог. В его задачи входит не только выявление факта замедления частоты сердечных сокращений, но и поиск причины этого состояния, а также подбор адекватного лечения. Помимо базового осмотра, выслушивания сердечных тонов, оценки пульса и измерения артериального давления, обследование включает:
Дополнительные исследования и консультации могут быть направлены на поиски конкретной причины. В зависимости от показаний проводится УЗИ щитовидной железы и надпочечников, оценивается содержание электролитов в крови и т. п.
Лечение брадикардии у детей и подростков
Лечение легкой или умеренной брадикардии и аритмии у ребенка любого возраста направлено на нормализацию частоты сердечных сокращений, а также устранение причины патологического состояния. В зависимости от ситуации могут быть использованы средства экстренной помощи и лекарства для постоянного приема, направленные на стабилизацию работы сердца. Выбор метода лечения брадикардии осуществляется врачом-кардиологом.
При развитии у ребенка выраженной брадикардии, сопровождающейся частыми обмороками, приступами Морганьи-Адамса-Стокса и другими состояниями, нарушающими привычный ритм жизни, используется хирургическое лечение. Опытные кардиохирурги имплантируют электрокардиостимулятор, подчиняющий себе работу сердца. Это лечение актуально также, если состояние возникло на фоне тяжелых пороков и блокад.
Прогноз и профилактика
Прогноз при брадикардии у ребенка зависит от ее причины и выраженности. В одних случаях достаточно скорректировать образ жизни или гормональный статус для нормализации работы сердца, в других требуется комплексное лечение и пожизненный контроль. Профилактика развития патологии включает, в первую очередь, приучение ребенка к здоровому образу жизни, предупреждение и своевременное лечение заболеваний, которые могут спровоцировать это состояние.
Если Ваш ребенок или подросток столкнулся с брадикардией, не ждите прогрессирования заболевания, запишитесь к детским кардиологам клиники «СМ-Доктор». Вас ждет комплексное обследование, современное и эффективное лечение при необходимости, а также регулярное наблюдение опытного специалиста.
Синдром слабости синусового узла
Синусовый (сино-атриальный) узел является источником электрических возбуждений и водителем ритма сердца первого порядка. Он локализуется в стенке правого предсердия и продуцирует импульсы частотой 60—80 в минуту. СА-узел подчиняется влияниям ВНС (вегетативной нервной системы) и гормональных систем, это проявляется изменениям ритма адекватно потребностям организма во время физической, психоэмоциональной активности, состоянии сна или бодрствования.
При синдроме слабости синусового узла происходит утрата СА-узлом лидирующей позиции в генерации сердечного ритма.
Классификация СССУ
Формы заболевания СССУ
Симптомы СССУ
Клинически выраженное нарушение функции синусового узла происходит когда остается менее 1/10 работающих клеток-водителей ритма.
Клиническую картину СССУ формируют 2 основные группы симптомов: кардиальные (сердечные) и церебральные (мозговые).
Больные жалуются на ощущение замедленного, нерегулярного пульса, замирания сердца, в случае выраженной брадикардии боли в проекции сердца, за грудиной давящего, сжимающего характера вследствие снижения кровотока по коронарным артериям. Может присоединяться аритмия (пароксизмальная тахикардия, суправентрикулярная и вентрикулярная экстрасистолия, фибрилляция, трепетание предсердий — это ощущается перебоями в работе сердца, сердцебиением, «кувырканием» сердца. При неблагоприятном течении развивается фибрилляция желудочков, часто являющаяся причиной внезапной сердечной смерти.
Мозговая (церебральная) симптоматика на начальных стадиях СССУ представлена неспецифическими признаками: общая слабость, утомляемость, раздражительность, эмоциональная неустойчивость, снижение памяти и внимания.
По мере развития синдрома слабости синусового узла появляется сонливость, предобморочные состояния, кратковременные потери сознания (приступы Морганьи-Адамса-Стокса), связанные с резким ухудшением кровоснабжения головного мозга. Как правило такие обмороки проходят самостоятельно.
Прогрессируют и головокружение, шум в ушах, слабость, страдает эмоциональная сфера, значительно снижается работоспособность, память, нарушается сон.
Естественно, что при СССУ ухудшается кровоснабжение не только сердца и головного мозга — страдают и другие органы. Нарушается функция почек, больной замечает уменьшение количества мочи; нарушается пищеварительная функция; снижается тонус и сила скелетных мышц.
Причины СССУ
Первичная дисфункция:
Вторичная дисфункция:
Диагностика СССУ
Для выявления органической патологии миокарда применяют ЭхоКГ (УЗИ сердца), реже томографию сердца.
Лечение СССУ
Тактика лечения синдрома слабости синусового узла зависит от степени дисфункции синусового узла, причины болезни, клинических проявлений, выраженности нарушений гемодинамики. Вторичный характер патологии подразумевает лечение основного заболевания.
При легких и умеренных формах СССУ используются лекарственные препараты. Если медикаменты не дают эффекта, либо развивается сложная, комбинированная с другими нарушениями ритма, или острая, тяжелая форма дисфункции синусного узла, нарушающая регионарное и системное кровообращение, показана установка электрокардиостимулятора.
Коррекция функциональных изменений сердечно-сосудистой системы препаратом L-карнитина у детей и подростков с сочетанной патологией
В современных условиях недостаточное потребление микронутриентов, воздействие на организм, особенно растущий, гипоксии различного генеза формируют высокий риск нарушений возрастного развития и повышенной заболеваемости у детей
В современных условиях недостаточное потребление микронутриентов, воздействие на организм, особенно растущий, гипоксии различного генеза формируют высокий риск нарушений возрастного развития и повышенной заболеваемости у детей [24]. Особое место среди этих патофизиологических факторов занимает тканевая гипоксия, возникающая в результате нарушения процессов биологического окисления, ключевые этапы которого происходят в митохондриях [1, 14, 15, 19, 20]. Митохондриальные нарушения полиморфны и могут иметь различные варианты и степень клинической выраженности: от минимальных до грубых, угрожающих жизни изменений. Результатом тканевой гипоксии являются нарушения синтеза АТФ, транспорта энергии от места продукции к эффекторным структурам клеток, нарушение утилизации энергии АТФ [8, 11, 20, 21].
Многочисленные клинические исследования, проведенные в последние годы, свидетельствуют о том, что относительная недостаточность энергетического фона может наблюдаться и у практически здоровых лиц. При этом скрытые нарушения клеточной энергетики могут быстро декомпенсироваться, приводя к снижению активности ферментов митохондриальной дыхательной цепи, вследствие чего возникает широкий спектр метаболических функциональных нарушений, в том числе со стороны нервной и сердечно-сосудистой систем [2, 3, 16, 22, 23]. Поэтому в настоящее время в лечении различных патологических состояний у детей большое значение придается метаболической терапии. В связи с этим важен поиск и создание безопасных и эффективных лекарственных средств комплексного воздействия на обмен веществ. К таким препаратам относят карнитин — низкомолекулярное соединение, производное аминомасляной кислоты, содержащееся во всех органах, особенно в больших количествах в тканях с необходимостью высокого энергетического обеспечения — мышцах, миокарде, мозге, печени, почках [1, 2, 6, 10, 11, 20]. Существуют две изомерные формы карнитина: D- и L-изомеры. В тканях млекопитающих присутствует только L-изомер, выполняющий в организме несколько функций: энергетическую (участвует в катаболизме липидов с образованием большого количества АТФ, модулируя внутриклеточный гомеостаз кофермента А с образованием свободного коэнзима А) и дезинтоксикационную (выводит из организма в виде ацилкарнитина соединения, обладающие мембранотоксическим и ингибирующим активность некоторых ферментов действием).
По данным многих клинических исследований, основными клиническими признаками дефицита L-карнитина являются быстрая утомляемость и снижение работоспособности; мышечная слабость, гипотония и гипотрофия, отставание физического развития; задержка психомоторного развития, снижение школьной успеваемости, сонливость или раздражительность; нарушение функции сердца вплоть до кардиомиопатии; увеличение размеров печени и нарушение ее функции [8, 9, 14–19].
Потребность в L-карнитине индивидуальна, а при умственных, физических и эмоциональных нагрузках повышается в 4–20 раз. Обычный пищевой рацион, включающий продукты животного происхождения, покрывает потребность в L-карнитине лишь на 25%, поэтому очевидна необходимость использования дополнительных источников L-карнитина для обеспечения оптимальной физиологической потребности.
В настоящее время появился новый источник L-карнитина — биологически активная добавка к пище Карнитон, зарегистрированная Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека. В состав препарата Карнитон аминокислота карнитин входит в форме L-карнитина тартрата, который наиболее полно усваивается организмом; в 1 мл препарата содержится 500 мг L-карнитина.
Целью данной работы явилась оценка эффективности влияния применения препарата Карнитон на состояние сердечно-сосудистой системы у детей и подростков с сочетанной соматической патологией в период реабилитации после частых респираторных заболеваний.
Работа осуществлялась под руководством сотрудников кафедры педиатрии МГМСУ на базе детского кардиологического санатория «Быково» МВД России.
В несравнительное исследование был включен 71 ребенок от 9 до 14 лет (34 мальчика и 37 девочек), находившийся в санатории в период с ноября 2009 года по январь 2010 года. Критериями отбора явились наличие жалоб вегетативного характера, изменения на стандартной электрокардиограмме (ЭКГ), эхокардиографии (ЭХО-КГ). Всем детям в течение 30 дней в первую половину дня назначался препарат Карнитон в возрастной дозе. В период лечения другие энерготропные и кардиотрофические препараты не назначались. С целью коррекции вегетативных изменений применялась немедикаментозная терапия (режим, прогулки, лечебная физкультура; физиотерапевтическое лечение, включающее массаж и водные процедуры). Нами не было зафиксировано ни одного случая аллергической реакции, непереносимости или отказа от приема препарата Карнитон. Назначение энерготропной терапии в первой половине дня было обусловлено возбуждающим нервную систему действием, что может вызывать трудности засыпания при вечернем приеме [6, 17, 20, 22].
Эффективность терапии препаратом Карнитон оценена по данным опроса детей, результатам стандартной ЭКГ и ЭХО-КГ после курса лечения. Статистический анализ результатов проведен стандартными методами. Степень достоверности количественных показателей оценивалась по t-критерию Стьюдента. Статистически значимыми считали различия при величине p ≤ 0,05.
Обследование включало физикальный осмотр, анализ генеалогического анамнеза, клинико-анамнестических данных, общеклинические исследования, стандартную ЭКГ, ЭХО-КГ с оценкой результатов в соответствии с нормативными показателями, применяемыми в педиатрии [4]. Оценка умственной работоспособности проводилась по методике Э. Крепелина, физическая работоспособность — по пробе с дозированной физической нагрузкой.
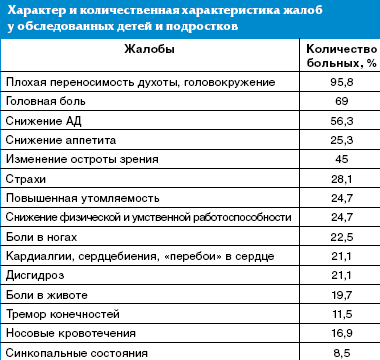
Характер жалоб у детей и подростков носил неспецифический характер, при этом наиболее часто отмечались головокружения и плохая переносимость духоты (95,8% детей), головная боль (69%), снижение артериального давления (АД) — у 56,3% пациентов. У каждого четвертого ребенка отмечались снижение аппетита, повышенная утомляемость со снижением физической и умственной работоспособности, у каждого пятого — или повышенная утомляемость, и/или кардиалгии, и/или дисгидроз, что расценивалось как проявление перманентного течения синдрома вегетативно-сосудистой дистонии (табл.).
Отмечены жалобы на нарушения сна, ночные страхи — у 28,1% пациентов, боли в ногах (22,5%), носовые кровотечения — у 16,9% обследованных. Особое внимание обращалось на детей с вегетативными пароксизмами в анамнезе, симптомами которых были боли в животе, тремор конечностей, синкопальные состояния. Всем детям с синкопальными состояниями ранее проводилось электроэнцефалографическое исследование, и было исключено органическое поражение головного мозга.
При физикальном осмотре патология опорно-двигательного аппарата в виде нарушения осанки, в том числе рахитически измененная (килевидная) грудная клетка (4,2% детей), выявлена у 98,7% больных. Снижение массы тела до 10-го центиля отмечено у 30% детей, избыточная масса — у 7%. При аускультации у 84% пациентов выслушивался низкотембровый систолический шум на верхушке и в V-точке. В процессе обследования исключена органическая патология сердечно-сосудистой, нервной систем. Анализ анамнестических, клинико-инструментальных данных свидетельствовал о том, что изменения сердечно-сосудистой системы носили вторичный характер, обусловленный нарушением вегетативной регуляции, наличием очагов хронической инфекции в носоглотке, полости рта, нарушением двигательного режима, что было выявлено практически у всех обследованных детей. Среди сопутствующих заболеваний наиболее часто встречались миопия (45%), аллергические заболевания, в том числе бронхиальная астма (22,5%), реже отмечались хронический гастродуоденит (6%), хронические запоры (4%).
При стартовом обследовании стандартной ЭКГ изменения зарегистрированы у всех детей. В 71,8% случаев отмечено вертикальное, а в 15,5% — горизонтальное расположение электрической оси сердца. У большинства детей (56,3%) выявлены нарушения автоматизма сердца в виде синусовой брадикардии (45%), эктопического ритма (14%), синусовой тахикардии (9,9%). Нарушения возбудимости сердца зарегистрированы у 45% пациентов, нарушения проводимости в виде атриовентрикулярной блокады (АВБ) I степени отмечены у 4,2%. Эти данные свидетельствуют о выраженных влияниях парасимпатического отдела на сердечно-сосудистую систему у обследованных детей и подростков, что согласуется с характером жалоб, предъявляемых пациентами.
После курса лечения препаратом Карнитон было отмечено статистически значимое (p
Т. И. Рычкова*, кандидат медицинских наук, доцент
И. П. Остроухова*, кандидат медицинских наук
С. А. Яцков**
Л. К. Акулова**
Т. М. Васильева*
* МГМСУ, Москва
** Детский кардиологический санаторий «Быково» МВД России, Московская область
Аритмия сердца у детей
Содержание статьи
Аритмия – одна из самых часто диагностируемых патологий сердечно-сосудистой системы у детей. По частоте выявления заболевание занимает третье место, уступая только порокам сердца и артериальной гипертонии. Источник:
Павлова Н.П., Максимцева Е.А., Артемова Н.М. Аритмии у детей Кардиоваскулярная терапия и профилактика №18, 2019, стр. 118-119 При этом аритмия сердца может возникать у ребенка в любое время: до года, в 5, 7, 10, 12 лет и в подростковом возрасте.
Патологическое состояние сопровождается нарушением работы сердечной мышцы. При этом происходит сбой частоты, регулярности и последовательности ее сокращений. То есть, ритм отклоняется от нормы.
Виды аритмии у детей
С учетом особенностей отклонений сердечного ритма, детскую аритмию распределяют на четыре ключевых вида:
Симптомы сердечной аритмии у ребенка
Симптоматика сбоев сердечного ритма обладает разной спецификой и отличается у детей разных возрастных групп.
Аритмия у новорожденного ребенка может проявляться через:
Аритмия у ребенка от 6 лет и старше очень часто не имеет симптомов. В таких случаях патологию обнаруживают при плановом медицинском осмотре. Лишь иногда у детей проявляются характерные симптомы заболевания:
Причины аритмии у детей
Детская нервная, вегетативная и иммунная системы еще не вошли в устойчивую стадию зрелости. Прежде чем синусовый узел, который отвечает за нормальный ритм, начнет генерировать правильные электрические импульсы для ритмичного сокращения сердечных камер, должны пройти годы. Только у подростков сердце начинает биться в таком ритме, как у взрослых – 60-80 ударов в минуту.
Самыми распространенными причинами аритмии сердца у детей являются:
Чем опасно заболевание
В большинстве случаев аритмия сердца у ребенка обладает благоприятным прогнозом и протекает доброкачественно. Однако при любой форме болезни крайне важно следить за состоянием здоровья малыша, регулярно проводить профилактическое обследование и по решению врача проходить лечение.
При отсутствии грамотной и своевременной терапии патология в будущем может вызывать серьезные осложнения. Длительное течение заболевания пагубно сказывается на работе сердца и приводит к опасным последствиям.
Аритмия может стать причиной сердечной недостаточности и кардиомиопатии, которые несут опасность ранней инвалидизации и даже летального исхода. Повышает риск развития артериальной гипотонии, ишемии миокарда. Длительный приступ тахикардии может спровоцировать кардиогенный шок или острую сердечную недостаточность с отеком легких.
Диагностика
Врачи выделяют несколько острых временных промежутков, когда особо обостряется возможность развития патологии. Зачастую аритмия у ребенка развивается в младенчестве, в 4-5 лет, в 7-8 лет, в 11-12 лет и в подростковом периоде. В эти возрастные интервалы происходят скачки роста. Поэтому проведение профилактической диагностики и кардиологического обследования в это время имеет особое значение, даже если симптомы болезни никак себя не проявляют.
Выявить отклонение и установить диагноз может только детский кардиолог или аритмолог. Изначально следует пройти консультацию у профильного специалиста, который:
Чтобы выявить заболевание и зафиксировать диагноз, доктор назначает:
Результаты диагностики позволяют кардиологу установить заболевание. Дополнительно врач может назначать процедуры, которые помогут выявить причины развития патологии:
Лечение аритмии сердца у детей
После завершения обследования врач изучает результаты диагностических процедур и устанавливает диагноз. Только после этого специалист разрабатывает индивидуальный план терапии с учетом типа и степени развития болезни, ее продолжительности, наличия или отсутствия сопутствующих патологий, причины развития аритмии, возраста и общего самочувствия пациента, а также многих других факторов.
Комплексное лечение аритмии у детей предусматривает прием препаратов разного спектра действия: сосудистых, нейрометаболических, антиаритмических. Применяются также антиоксиданты и стабилизаторы клеточных мембран. Вид медикаментов, дозировку и продолжительность приема врач определяет индивидуально.
Помимо лекарственной терапии, назначаются также профилактические меры. Родители получают рекомендации, которые помогут ускорить выздоровление и стабилизацию сердечно-сосудистой системы ребенка:
Лечение детской аритмии в «СМ-Клиника»
В наших медицинских центрах проводят комплексную диагностику и терапии сердечно-сосудистых патологий у маленьких пациентов. Обращаясь к «СМ-Клиника», вы можете быть уверены в том, что:
Записывайтесь на консультацию по телефону или заполняйте форму обратной связи, и мы свяжемся с вами для подтверждения записи.
Источники:
ФАРМАКОТЕРАПИЯ нарушений ритма сердца у детей
Лечение нарушений ритма сердца (НРС) у детей является одной из серьезнейших проблем в практике и педиатра, и «взрослого» кардиолога.
Лечение нарушений ритма сердца (НРС) у детей является одной из серьезнейших проблем в практике и педиатра, и «взрослого» кардиолога. Несмотря на общность многих терапевтических подходов, особенности физиологического развития ребенка, отсутствие у детей типичных для взрослых причин развития аритмий часто определяют несколько другие патогенетические механизмы развития НРС и подходы к лечению.
В лечении НРС выделяют медикаментозные и немедикаментозные методы. К немедикаментозным относятся хирургические, мини-инвазивные методы электротерапии (радиочастотная катетерная аблация) и использование имплантируемых антиаритмических устройств. Медикаментозные методы можно условно разделить на экстренное купирование наиболее опасных форм НРС и хроническую фармакотерапию.
В экстренном купировании нуждаются НРС с высоким риском развития сердечной недостаточности, остановки кровообращения и внезапной смерти — прежде всего это желудочковая тахикардия (ЖТ), переходящая в фибрилляцию, и брадиаритмии. В значительно меньшей степени непосредственной причиной остановки кровообращения у детей старше года может стать суправентрикулярная пароксизмальная тахикардия (СПТ). Однако у детей грудного возраста СПТ представляет значительно большую угрозу как возможная причина внезапной смерти.
При развитии СПТ лечение начинают с вагусных проб. Их эффективность у детей максимальна в первые 20-30 мин после начала приступа. Если приступ не удалось прервать за это время, переходят к введению антиаритмических препаратов — ААП. Препаратом выбора в данном случае является аденозин (АТФ). Клиническая эффективность АТФ обусловлена быстрым началом действия (до 10 с), минимальными возможными побочными эффектами (кашель, чувство жара, гиперемия, брадикардия), которые быстро проходят. Начальную дозу вводят в виде 1%-ного раствора внутривенно, быстро (3-4 с), без разведения, в дозе 0,1 мг/кг. При экстренном купировании приступа можно ориентироваться и на возрастные дозировки препарата: до 6 мес. — 0,5 мл; 6 мес. — 1 год до 0,7 мл; 1-3 года — 0,8 мл; 4-7 лет — 1,0 мл; 8-10 лет — 1,5 мл; 11-14 лет — 2,0 мл. Если ритм не восстановился в течение 1-2 мин, вводят повторно удвоенную дозу и при необходимости повторяют еще раз. При развитии СПТ у больных с синдромом Вольфа—Паркинсона—Уайта (WPW) эффективно введение гилуритмала (аймалина) в дозе 1 мг/кг, в/в, но не более 50 мг. Сохраняет свою актуальность и купирование СПТ изоптином. Хотя препарат может вызывать брадикардию и артериальную гипотонию, он эффективен в лечении детей с политопной предсердной тахикардией. Используются следующие дозы изоптина: до 1 мес. — 0,2-0,3 мл; до 1 года 0,3-0,4 мл; 1-5 лет — 0,4-0,5 мл; 5-10 лет — 1,0-1,5 мл, больше 10 лет — 1,5-2,0 мл. Изоптин абсолютно противопоказан при тахикардии неясной этиологии с широким QRS-комплексом и синдроме WPW, так как возможна трансформация СПТ в фибрилляцию желудочков вследствие ускорения антероградного проведения по дополнительным проводящим путям. Препаратами выбора для купирования СПТ у детей являются также кордарон (в/в с 5%-ном раствором глюкозы в дозе 5 мг/кг), дигоксин (в/в, медленно, на физрастворе, в дозе 0,1-0,3 мл), новокаинамид (в/в, медленно, на физрастворе, в дозе 0,15-0,2 мл/кг, максимально до 17 мг/кг). Возможная артериальная гипотензия предупреждается введением 1%-ного раствора мезатона в дозе 0,1 мл на год жизни, но не более 1,0 мл. Действие ААП при СПТ усиливается при совместном использовании транквилизаторов с симпатолитическим эффектом (реланиум, тазепам, радедорм).
Выявленная на ЭКГ во время приступа тахикардия с широким QRS-комплексом не всегда позволяет определить, что это — ЖТ или СПТ с абберацией проведения или блокадой ножек пучка Гиса. Если форма аритмии точно не установлена, лечение проводят как при ЖТ. Во всех случаях противопоказаны антагонисты кальция. Препаратом первого ряда при купировании ЖТ является лидокаин, который вводится в/в, медленно, на 5%-ном растворе глюкозы, в начальной дозе 1,0 мг/кг в виде 1-2%-ного раствора. Если ритм не восстанавливается, можно через каждые 5-10 мин дополнительно вводить препарат в половинной дозировке (до общей дозы не более 3 мг/кг). В качестве препаратов второго ряда при ЖТ можно использовать новокаинамид, гилуритмал, кордарон или β-блокаторы (дозировки указаны выше). Средством выбора при купировании приступа тахикардии «пируэт», характерной для больных с удлинением интервала QT, является сульфат магния (введение 10%-ного раствора 25-50 мг/кг, максимум 2 г в течение 1-2 мин, при неэффективности — повторно через 5-10 мин).
Из брадиаритмий в экстренном лечении нуждаются симптомные брадикардии, асистолия или электромеханическая диссоциация (наличие на ЭКГ синусовой брадикардии при отсутствии пульсовой волны). Основные мероприятия при развитии асистолии у детей — введение адреналина и атропина. При неэффективности небольших доз адреналина (0,01 мг/кг/ в/в) и развитии остановки сердца вводят более высокие дозы (0,1-0,2 мг/кг в/в), которые можно повторять каждые 3-5 мин, пока есть угроза рецидива аритмии. Как правило, атропин используется в лечении брадиаритмий после адреналина. Доза для введения в/в — 0,02 мг/кг (максимальная разовая 0,5 мг у детей младшего возраста и 1,0 мг у подростков), которую можно повторять каждые 5 мин (до общей дозы 1,0 мг у детей младшего возраста и 2,0 мг у подростков).
Длительная фармакотерапия НРС у детей основана на коррекции интра- и экстракардиальных механизмов их развития. В первом случае речь идет об использовании традиционных для кардиологии ААП, непосредственно влияющих на электрофизиологический механизм запуска и поддержания аритмии (так называемая симптоматическая терапия). Их применение достаточно эффективно, однако при длительном лечении практически все они дают побочные эффекты и обладают проаритмогенным действием. С учетом доказанного значения вегетативной и центральной нервной системы в патогенезе развития НРС у детей — в схеме лечения идиопатических аритмий в педиатрии значительная роль принадлежит препаратам, нормализующим уровень кардиоцеребральных взаимодействий, что составляет основу так называемой базисной антиаритмической терапии. В нее входят ноотропные, мембраностабилизирующие и метаболические препараты. Ноотропы (пирацетам в дозе 0,2 мл три раза в день; пиридитол 0,05-0,1 мл три раза в день; аминалон 0,5-1,0 мл три раза в день; глютаминовая кислота от 0,1 до 1,0 мл три раза в день; фенибут 0,05 — 0,3 3 раза в день) стимулируют синтез АТФ, обладают ваголитическим эффектом. Рекомендуемый курс лечения — 4-6 недель приема каждого препарата, при этом назначается одновременно не более двух препаратов. Среди других лекарственных средств следует отметить карнитин хлорид, коэнзим Q, милдронат. Как антиоксидантный препарат в лечении детей активно используется ксидифон. В последние годы в комплексной терапии НРС нашли широкое применение препараты магния, в частности магнерот. Соединение магния с оротовой кислотой суммирует их положительные метаболические и антиаритмические эффекты. Рекомендуемые дозировки: Дети до 6 мес 40 мг в сутки, 6 мес-1 год — 60-75 мг в сутки, 1-3 года-80 мг в сутки, 4-6 лет — 120 мг в сутки, 7-10 лет — 170 мг в сутки, 11-14 лет 270 мг в сутки, старше 15 лет 280-400 мг в сутки.
Назначается не более трех представителей разных групп одновременно.
При наличии органического поражения миокарда (кардиомиопатии, пороки сердца, кардиты и т. д.), сохраняющейся более 6 мес. идиопатической аритмии на фоне базисной терапии, развитии гемодинамических нарушений или аритмогенной симптоматики к лечению подключаются классические ААП I-IV класса. К первому классу относятся ААП-блокирующие быстрые каналы кардиомиоцита (калиевые — класс IA и натриевые IB и IC), ко второму — β-блокаторы, к третьему — средства, увеличивающие продолжительность действия, и к четвертому — антагонисты ионов кальция. Это деление достаточно условно, так как не учитывает многих электрофизиологических свойств ААП и в него не вписывается ряд эффективных ААП, выделяемых дополнительно. Ниже мы остановимся на основных ААП, используемых у детей.
Хинидин — наиболее давно используемый из ААП класса IA. Per os применяется в виде сульфата или глюконата. При приеме глюконата пик концентрации наступает через 3-4 ч (прием три раза в день), сульфата — через 1-2 ч. (прием четыре раза в день в дозе 30-60 мг/кг). Из побочных кардиальных эффектов наиболее значимым является возможность развития брадиаритмий и удлинения интервала QT. Возможны гастроэнтерологические или неврологические расстройства. Практическое использование хинидина в педиатрии в настоящее время невелико, хотя он может являться препаратом выбора при лечении мерцательной аритмии. Новокаинамид используется преимущественно при экстренном купировании тахиаритмий (см. выше). Прием per os в дозе 40-100 мг/кг/день. Суточная доза разбивается на шесть приемов у грудных детей, четыре — у детей 1-2-го года жизни и три приема в более старшем возрасте. Из побочных эффектов кроме брадикардии и гипотонии может отмечаться удлинение интервала QT, люпус-синдром, артралгия, сыпь.
Неогилуритмал в отличие от хинидина и новокаинамида не обладает выраженным гипотензивным действием. Он оказывает отрицательное инотропное и умеренное адренолитическое действие. Препарат является высокоэффективным при синдроме WPW. Доза насыщения 20 мг каждые 6-8 ч (3 дня), затем 20-40 мг в сутки. Для профилактики приступов возможен однократный прием 10-20 мг утром. Осложнения — АВ-блокады, брадиаритмии, удлинение интервала QT.
Из препаратов класса IB (местные анестетики) при приеме per os перспективен мексилетин (мекситил). Есть данные об эффективности его применения у больных с синдромом удлиненного интервала QT с дефектом натриевых каналов. Стартовая доза препарата 2 мг/кг, разбитая на 4 приема в сутки. Разовая доза может быть увеличена до 5 мг/кг у старших детей и до 7-8 мг/кг у грудных детей.
Препарат класса IС флекаинид достигает максимума концентрации через 1-2 ч. Расчет дозы на поверхность тела у детей более тесно коррелирует с уровнем препарата в плазме, чем при расчете на вес. Стартовая доза у грудных детей составляет 80-90 мг/м 2 в сутки, разделенная на два приема. В более старшем возрасте доза увеличивается до 100-110 мг/м 2 в сутки (максимально до 200). Есть данные об эффективном использовании препарата в педиатрии в комбинации с кордароном и мексилетином в лечении устойчивых форм ЖТ. Ритмонорм (пропафенон) в последние годы широко используется в педиатрии. Препарат достигает пика концентрации при приеме per os через 2-3 ч. Дозы препарата 10-20 мг/кг в четыре приема или при расчете на поверхность тела 150-200 мг/м 2 в сутки в максимальной дозе до 600 мг/м 2 в сутки. Побочные эффекты флекаинида и ритмонорма общие (удлинение интервала QT, блокады АВ, внутрижелудочковые блокады, парастезии и транзиторные нарушения зрения) и чаще проявляются у детей с органическим поражением миокарда.
II класс ААП составляют блокаторы β-адренергических рецепторов. В педиатрии они являются препаратами первого ряда при лечении ЖТ, но используются и в лечении предсердных НРС. Наиболее распространен в педиатрии обзидан (пропранолол). Стартовая доза составляет 1-2 мг/кг/сутки. У детей от 0 до 8 мес. суточная доза делится на четыре приема, в дальнейшем уменьшается до двух-трех приемов в день. Используется также атенолол, блокирующий преимущественно β1-рецепторы и являющийся конкурентным антагонистом эндогенных катехоламинов (прием 1-2 мг/кг, максимум до 3 мг/кг в один-два приема в сутки). В последние годы в лечении ЖТ активно используется надолол (коргард). Продолжительный период элиминации (20-24 ч) делает возможным его применение (доза 1-3 мг/кг) один раз в сутки. Основные побочные эффекты у всех β-блокаторов общие — брадикардия, артериальная гипотензия, развитие АВ-блокад. Из экстракардиальных эффектов отмечаются головокружения, депрессии, ночные кошмары. Одним из наиболее активно используемых в педиатрии является ААП класса III кордарон (амиодарон). Он блокирует медленные натриевые каналы и оказывает неконкурентное антиадренергическое действие на α- и β-рецепторы. Особенностью кордарона является длительность достижения терапевтического эффекта. При приеме per os доза насыщения составляет 10-15 мг/кг в день, распределенная на два приема в день в течение 5-10 дней. Затем дозу снижают до 2-5 мг/кг в один или два приема в сутки. Несмотря на высокую эффективность при большинстве НРС, кордарон имеет очень серьезный список возможных побочных эффектов. Наиболее частыми экстракардиальными эффектами являются: гипо- и гипертиреоидизм, светобоязнь, корнеальные микроотложения липофусцина, фиброз легочной ткани, парастезии, сыпь. Из кардиальных осложнений наиболее значимы брадикардия, АВ-блокады, удлинение интервала QT, гипотензия. При сочетанном использовании с другими ААП кордарон увеличивает концентрацию дигоксина в плазме на 50-100% и на 30-50% таких ААП, как хинидин, новокаинамид, флекаинид. Антагонисты кальция (IV класс ААП) не нашли широкого применения в хронической терапии НРС у детей и более актуальны при экстренном купировании СПТ (см. выше). Кроме того, при терапии НРС используют и ряд ААП, не вошедших в классическую классификацию. Так, финлепсин (карбамазепин) первоначально применялся как антиконвульсант, однако многочисленные исследования показали его высокую антиаритмическую активность. Финлепсин применяют в дозе 10-15 мг/кг, длительность первого курса 6 мес. По-прежнему для лечения суправентрикулярных аритмий активно назначаются сердечные гликозиды. Наиболее часто у детей используется дигоксин. Взаимодействие дигоксина с другими ААП (хинидин, кордарон, изоптин) способно увеличивать его концентрацию на 50-100%. К побочным эффектам относятся брадиаритмии, АВ-блокады, удлинение интервала QT.
Эффективность и безопасность терапии НРС значительно повышается при использовании хронотерапевтических схем, основанных на определении суточного типа НРС по данным холтеровского мониторирования и приеме 2/3 суточной дозы ААП с расчетом максимума его эффекта перед ожидаемым временем усиления или возникновения аритмии.
Литература
1. Белоконь Н. А., Кубергер М. Б. Болезни сердца и сосудов у детей. М.: Медицина, 1987, с. 448.
2. Школьникова М. А. Жизнеугрожающие аритмии у детей. М., 1999, с. 230.
3. Макаров Л. М. Холтеровское мониторирование. М.: Медпрактика, 2000. 216 с.
4. Гроер К., Кавалларо Д. Сердечно-легочная реанимация. Пер. с англ. М.: Практика, 1996, с. 128.
5. Luedtke S. A., Kuhn R. J., McCaffrey F. M. Pharmacologic management of supraventricular tachycardia in children // ANN Pharmacother 1997; 31: 1227-1359.
6. Kugler J. D., Danford D. A. Management of infants, children and adolescents with paroxysmal supraventricular tachycardia // J. Pediatr. 1996; 129: 324-338.