Как вылечить цистит у подростка
Антибиотики в лечении и профилактике инфекций мочевыводящих путей у детей
Инфекция мочевыводящих путей (ИМП) — рост микроорганизмов в различных отделах почек и мочевыводящих путей (МП), способный вызвать воспалительный процесс, по локализации соответствующий заболеванию (пиелонефриту, циститу, уретриту и т. д.). ИМП детей
Инфекция мочевыводящих путей (ИМП) — рост микроорганизмов в различных отделах почек и мочевыводящих путей (МП), способный вызвать воспалительный процесс, по локализации соответствующий заболеванию (пиелонефриту, циститу, уретриту и т. д.).
ИМП детей встречается в России с частотой около 1000 случаев на 100 000 населения. Довольно часто ИМП имеют тенденцию к хроническому, рецидивирующему течению. Это объясняется особенностью строения, кровообращения, иннервации МП и возрастной дисфункцией иммунной системы растущего организма ребенка. В связи с этим принято выделять ряд факторов, способствующих развитию ИМП:
В детском возрасте ИМП в 80% случаев развиваются на фоне врожденных аномалий верхних и нижних МП, при которых имеются нарушения уродинамики. В таких случаях говорят об осложненной ИМП. При неосложненной форме анатомических нарушений и расстройств уродинамики не определяется.
Среди наиболее часто встречающихся пороков развития мочевого тракта пузырно-мочеточниковый рефлюкс встречается в 30–40% случаев. Второе место занимает мегауретер, нейрогенная дисфункция мочевого пузыря. При гидронефрозе инфицирование почки происходит реже.
Диагностика ИМП строится на многих принципах. Необходимо помнить, что симптоматика ИМП зависит от возраста ребенка. Например, у новорожденных детей отсутствуют специфические симптомы ИМП и инфекция редко генерализуется.
Для детей младшего возраста характерны такие симптомы, как вялость, беспокойство, периодические подъемы температуры, анорексия, рвота и желтуха.
Для детей старшего возраста характерны лихорадка, боли в спине, животе и дизурические явления.
Перечень вопросов при сборе анамнеза включает следующие пункты:
Врач всегда должен стремиться более точно установить локализацию возможного очага инфекции: от этого зависит вид лечения и прогноз заболевания. Для уточнения топики поражения мочевого тракта необходимо хорошо знать клиническую симптоматику инфекций нижних и верхних мочевых путей. При инфекции верхних мочевыводящих путей значимым является пиелонефрит, который составляет до 60% всех случаев госпитализации детей в стационар (таблица).
Однако основу диагностики ИМП составляют данные анализов мочи, в которых главное значение имеют микробиологические методы. Выделение микроорганизма в посеве мочи служит основанием для постановки диагноза. Существует несколько способов забора мочи:
Распространенным непрямым методом оценки бактериурии является анализ на нитриты (нитраты, в норме имеющиеся в моче, при наличии бактерий преобразуются в нитриты). Диагностическая ценность данного метода достигает 99%, но у маленьких детей в связи с коротким пребыванием мочи в мочевом пузыре значительно снижена и достигает 30–50%. Необходимо помнить, что у маленьких мальчиков может быть ложноположительный результат из-за аккумуляции нитритов в препуциальном мешке.
В большинстве случаев ИМП вызывается одним видом микроорганизма. Определение в образцах нескольких видов бактерий чаще всего объясняется нарушениями техники сбора и транспортировки материала.
При хроническом течении ИМП в некоторых случаях возможно выявление микробных ассоциаций.
К другим методам исследования мочи относятся сбор общего анализа мочи, проба Нечипоренко и Аддиса–Каковского. Лейкоцитурия наблюдается во всех случаях ИМП, однако необходимо помнить, что она может быть, например, и при вульвите. Макрогематурия встречается у 20–25% детей с циститом. При наличии симптомов инфекции протеинурия подтверждает диагноз пиелонефрита.
Инструментальные обследования проводятся детям в период ремиссии процесса. Целью их является уточнение локализации инфекции, причины и степени повреждения почек. Обследование детей с ИМП на сегодняшний день включает:
Проведение инструментального и рентгенологического обследования должно выполняться по следующим показаниям:
Бактериальная этиология ИМС при урологических заболеваниях имеет отличительные особенности в зависимости от остроты процесса, частоты осложненных форм, возраста пациента и состояния его иммунного статуса, условий возникновения инфекции (амбулаторно или в стационаре).
Результаты исследований (данные НЦЗД РАМН, 2005) показывают, что у амбулаторных больных с ИМП в 50% случаев выделяются E. coli, в 10% — Proteus spp., в 13% — Klebsiella spp., в 3% — Enterobacter spp., в 2% — Morganella morg. и с частотой 11% — Enterococcus fac. (рисунок). Другие микроорганизмы, составившие 7% выделения и встречавшиеся с частотой менее 1%, были следующими: S. epidermidis — 0,8%, S. pneumoniae — 0,6%, Acinetobacter spp. — 0,6%, Citrobacter spp. — 0,3%, S. pyogenes — 0,3%, Serratia spp. — 0,3%.
В структуре внутрибольничных инфекций ИМП занимают второе место, после инфекций дыхательных путей. Следует отметить, что у 5% детей, находящихся в урологическом стационаре, развиваются инфекционные осложнения, обусловленные хирургическим или диагностическим вмешательством.
У стационарных больных этиологическая значимость кишечной палочки значительно снижается (до 29%) за счет увеличения и/или присоединения таких «проблемных» возбудителей, как Pseudomonas aeruginosa (29%), Enterococcus faec. (4%), коагулазонегативные стафилококки (2,6%), неферментирующие грамотрицательные бактерии (Acinetobacter spp. — 1,6%, Stenotrophomonas maltophilia — 1,2%) и др. Чувствительность этих возбудителей к антибактериальным препаратам часто непредсказуема, так как зависит от ряда факторов, в том числе и от особенностей циркулирующих в данном стационаре внутрибольничных штаммов.
Не вызывает сомнений, что основными задачами в лечении больных с ИМП являются ликвидация или уменьшение воспалительного процесса в почечной ткани и МП, при этом успех лечения во многом определяется рациональной антимикробной терапией.
Естественно, при выборе препарата уролог руководствуется прежде всего сведениями о возбудителе инфекции и о спектре антимикробного действия препарата. Антибиотик может быть безопасным, способным создавать высокие концентрации в паренхиме почек и моче, но если в его спектре нет активности против конкретного возбудителя, назначение такого препарата бессмысленно.
Глобальной проблемой в назначении антибактериальных препаратов является рост резистентности микроорганизмов к ним. Причем наиболее часто резистентность развивается у внебольничных и нозокомиальных больных. Те микроорганизмы, которые не входят в антибактериальный спектр какого-либо антибиотика, естественно, считаются резистентными. Приобретенная же резистентность означает, что изначально чувствительный к определенному антибиотику микроорганизм становится устойчивым к его действию.
На практике часто заблуждаются в отношении приобретенной резистентности, считая, что ее возникновение неизбежно. Но наука располагает фактами, опровергающими такое мнение. Клиническое значение этих фактов состоит в том, что антибиотики, которые не вызывают резистентности, можно использовать, не опасаясь ее последующего развития. Но если же развитие резистентности потенциально возможно, то и появляется она достаточно быстро. Другое заблуждение заключается в том, что развитие резистентности связывают с использованием антибиотиков в больших объемах. Примеры с наиболее часто назначаемым в мире антибиотиком цефтриаксоном, а также с цефокситином и цефуроксимом поддерживают концепцию о том, что использование антибиотиков с низким потенциалом развития резистентности в любых объемах не приведет к ее росту в последующем.
Многие считают, что для одних классов антибиотиков возникновение антибиотикорезистентности характерно (это мнение относится к цефалоспоринам III поколения), а для других — нет. Однако развитие резистентности связано не с классом антибиотика, а с конкретным препаратом.
Если антибиотик обладает потенциалом развития резистентности, признаки резистентности к нему появляются уже в течение первых 2 лет применения или даже на этапе клинических испытаний. Исходя из этого, мы можем с уверенностью прогнозировать проблемы резистентности: среди аминогликозидов — это гентамицин, среди цефалоспоринов II поколения — цефамандол, III поколения — цефтазидим, среди фторхинолонов — тровофлоксацин, среди карбапенемов — имипенем. Внедрение в практику имипенема сопровождалось быстрым развитием резистентности к нему штаммов P. aeruginosa, этот процесс продолжается и сейчас (появление меропенема не было сопряжено с такой проблемой, и можно утверждать, что она не возникнет и в ближайшем будущем). Среди гликопептидов — это ванкомицин.
Как уже указывалось, у 5% больных, находящихся в стационаре, развиваются инфекционные осложнения. Отсюда и тяжесть состояния, и увеличение сроков выздоровления, пребывания на койке, повышение стоимости лечения. В структуре внутрибольничных инфекций ИМП занимают первое место, на втором месте — хирургические (раневые инфекции кожи и мягких тканей, абдоминальные).
Сложности лечения госпитальных инфекций обусловлены тяжестью состояния больного. Часто имеет место ассоциация возбудителей (два и более, при раневой или катетер-ассоциированной инфекции). Также большое значение имеет возросшая в последние годы резистентность микроорганизмов к традиционным антибактериальным препаратам (к пенициллинам, цефалоспоринам, аминогликозидам), применяемым при инфекции мочеполовой системы.
На сегодняшний день чувствительность госпитальных штаммов Enterobacter spp. к Амоксиклаву (амоксициллин + клавулановая кислота) составляет 40%, к цефуроксиму — 30%, к гентамицину — 50%, чувствительность S. aureus к оксациллину составляет 67%, к линкомицину — 56%, к ципрофлоксацину — 50%, к гентамицину — 50%. Чувствительность штаммов P. aeruginosa к цефтазидиму в разных отделениях не превышает 80%, к гентамицину — 50%.
Существуют два потенциальных подхода к преодолению резистентности к антибиотикам. Первый заключается в профилактике резистентности, например путем ограничения применения антибиотиков, обладающих высоким потенциалом ее развития; столь же важными являются эффективные программы эпидемиологического контроля для предотвращения распространения в лечебном учреждении госпитальных инфекций, вызываемых высокорезистентными микроорганизмами (стационарный мониторинг). Второй подход — устранение или коррекция уже имеющихся проблем. Например, если в отделении интенсивной терапии (или в стационаре вообще) распространены резистентные штаммы P. aeruginosa или Enterobacter spp., то полная замена в формулярах антибиотиков с высоким потенциалом развития резистентности на антибиотики-«чистильщики» (амикацин вместо гентамицина, меропенем вместо имипенема и т.п.) позволит устранить или минимизировать антибиотикорезистентность грамотрицательных аэробных микроорганизмов.
В лечении ИМП на сегодняшний день используются: ингибиторозащищенные пенициллины, цефалоспорины, аминогликозиды, карбапенемы, фторхинолоны (ограничены в педиатрии), уроантисептики (производные нитрофурана — Фурагин).
Остановимся на антибактериальных препаратах в лечении ИМП подробнее.
Рекомендуемые препараты при инфекции нижних мочевых путей.
При инфекции верхних мочевых путей.
При госпитальной инфекции.
Для периоперационной антибактериальной профилактики.
Для антибактериальной профилактики при инвазивных манипуляциях: ингибиторозащищенные аминопенициллины — амоксициллин + клавулановая кислота.
Принято считать, что антибактериальная терапия амбулаторных больных с ИМП может проводиться эмпирически, основываясь на данных антибиотикочувствительности основных уропатогенов, циркулирующих в конкретном регионе в данный период наблюдения, и клиническом статусе пациента.
Стратегическим принципом антибиотикотерапии в амбулаторных условиях является принцип минимальной достаточности. Препаратами первого ряда служат:
Ошибочным является использование в амбулаторных условиях ампициллина и ко-тримоксазола, в связи с возросшей резистентностью к ним E. coli. Неоправданно назначение цефалоспоринов I поколения (цефалексин, цефрадин, цефазолин). Производные нитрофуранового ряда (Фурагин) не создают терапевтических концентраций в почечной паренхиме, поэтому их назначают только при цистите. В целях снижения роста резистентности микроорганизмов следует резко ограничить применение цефалоспоринов III поколения и полностью исключить назначение аминогликозидов в амбулаторной практике.
Анализ резистентности штаммов возбудителей осложненных уроинфекций показывает, что активность препаратов группы полусинтетических пенициллинов и защищенных пенициллинов может быть достаточно высокой в отношении кишечной палочки и протеев, однако в отношении энтеробактерий и синегнойной палочки их активность составляет до 42 и 39% соответственно. Поэтому препараты этой группы не могут быть препаратами эмпирической терапии тяжелых гнойно-воспалительных процессов органов мочевыделения.
Активность цефалоспоринов I и II поколений в отношении энтеробактера и протеев также оказывается очень низкой и колеблется в пределах 15–24%, в отношении кишечной палочки — несколько выше, однако не превышает активности полусинтетических пенициллинов.
Активность цефалоспоринов III и IV поколений существенно выше, чем у пенициллинов и цефалоспоринов I и II поколений. Наиболее высокая активность отмечена в отношении кишечной палочки — от 67 (цефоперазон) до 91% (цефепим). В отношении энтеробактера активность составляет от 51 (цефтриаксон) до 70% (цефепим), также высокая активность препаратов этой группы отмечается в отношении протеев (65–69%). В отношении синегнойной палочки активность этой группы препаратов низкая (15% у цефтриаксона, 62% у цефепима). Спектр антибактериальной активности цефтазидима наиболее высокий в отношении всех актуальных грамотрицательных возбудителей осложненных инфекций (от 80 до 99%). Высокой сохраняется активность карбапенемов — от 84 до 100% (у имипенема).
Активность аминогликозидов несколько ниже, особенно в отношении энтерококков, но в отношении энтеробактерий и протея высокая активность сохраняется у амикацина.
По этой причине антибактериальная терапия ИМП у урологических больных в стационаре должна основываться на данных микробиологической диагностики возбудителя инфекции у каждого больного и его чувствительности к антибактериальным препаратам. Начальная эмпирическая антимикробная терапия урологических больных может назначаться только до получения результатов бактериологического исследования, после которого она должна быть изменена согласно антибиотикочувствительности выделенного микроорганизма.
В применении антибиотикотерапии в стационаре следует придерживаться другого принципа — от простого к мощному (минимум использования, максимум интенсивности). Спектр используемых групп антибактериальных препаратов здесь значительно расширен:
Важной в работе детского уролога является периоперационная антибиотикопрофилактика (пре-, интра- и постоперационная). Конечно, не следует пренебрегать влиянием других факторов, снижающих вероятность развития инфекции (сокращение сроков пребывания в стационаре, качество обработки инструментария, катетеров, использование закрытых систем для отведения мочи, обучение персонала).
Основные исследования показывают, что послеоперационные осложнения предотвращаются в том случае, если высокая концентрация антибактериального препарата в сыворотке крови (и в тканях) создана к началу оперативного вмешательства. В клинической практике оптимальное время для антибиотикопрофилактики — 30–60 мин до начала операции (при условии внутривенного введения антибиотика), т. е. в начале анестезиологических мероприятий. Отмечен значительный рост частоты возникновения послеоперационных инфекций, если профилактическая доза антибиотика была назначена не в пределах 1 ч до проведения операции. Любой антибактериальный препарат, введенный после закрытия операционной раны, не повлияет на вероятность развития осложнений.
Таким образом, однократное введение адекватного антибактериального препарата в целях профилактики не менее эффективно, чем многократное. Только при длительном оперативном вмешательстве (более 3 ч) требуется дополнительная доза. Антибиотикопрофилактика не может продолжаться более 24 ч, так как в этом случае применение антибиотика рассматривается уже как терапия, а не как профилактика.
Идеальный антибиотик, в том числе и для периоперационной профилактики, должен быть высокоэффективен, хорошо переноситься больными, обладать невысокой токсичностью. Его антибактериальный спектр должен включать вероятную микрофлору. Для пациентов, длительно находящихся в стационаре до проведения оперативного вмешательства, необходимо принимать во внимание спектр нозокомиальных микроорганизмов с учетом их антибиотикочувствительности.
Для антибиотикопрофилактики при урологических операциях желательно использовать препараты, создающие высокую концентрацию в моче. Многие антибиотики отвечают этим требованиям и могут использоваться, например цефалоспорины II поколения и ингибиторозащищенные пенициллины. Аминогликозиды должны быть зарезервированы для пациентов, входящих в группы риска или с аллергией на b-лактамы. Цефалоспорины III и IV поколений, ингибиторозащищенные аминопенициллины и карбапенемы должны использоваться в единичных случаях, когда место операции обсеменено мультирезистентными нозокомиальными микроорганизмами. Все-таки желательно, чтобы назначение этих препаратов было ограничено лечением инфекций с тяжелым клиническим течением.
Существуют общие принципы антибактериальной терапии ИМП у детей, которые включают в себя следующие правила.
При фебрильном течении ИМП начинать терапию следует с парентерального антибиотика широкого спектра (ингибиторозащищенные пенициллины, цефалоспорины II, III поколений, аминогликозиды).
Необходимо учитывать чувствительность микрофлоры мочи.
Длительность лечения пиелонефрита составляет 14 дней, цистита — 7 дней.
У детей с пузырно-мочеточниковым рефлюксом антимикробная профилактика должна быть длительной.
При бессимптомной бактериурии антибактериальная терапия не показана.
В понятие «рациональная антибиотикотерапия» должен входить не только правильный выбор препарата, но и выбор его введения. Необходимо стремиться к щадящим и в то же время наиболее эффективным методам назначения антибактериальных препаратов. При использовании ступенчатой терапии, которая заключается в смене парентерального использования антибиотика на пероральный, после нормализации температуры, врач должен помнить о следующем.
Ниже представлены антибактериальные препараты в зависимости от пути их введения.
Препараты для перорального лечения ИМП.
• II поколения: цефуроксим;
• III поколения: цефиксим, цефтибутен, цефподоксим.
Препараты для парентерального лечения ИМП.
• II поколения: цефуроксим (Цефурабол).
• III поколения: цефотаксим, цефтриаксон, цефтазидим.
• IV поколения: цефепим (Максипим).
Несмотря на наличие современных антибиотиков и химиотерапевтических препаратов, позволяющих быстро и эффективно справляться с инфекцией и уменьшать частоту рецидивов путем назначения на длительный период препаратов в низких профилактических дозах, лечение рецидивов ИМП все еще представляет собой довольно сложную задачу. Это обусловлено:
Как известно, до 30% девочек имеют рецидив ИМП в течение 1 года, 50% — в течение 5 лет. У мальчиков до 1 года рецидивы встречаются в 15–20%, старше 1 года — рецидивов меньше.
Перечислим показания к антибиотикопрофилактике.
а) пузырно-мочеточниковый рефлюкс;
Длительность антибиотикопрофилактики чаще всего определяется индивидуально. Отмена препарата осуществляется при отсутствии обострений за время профилактики, но при возникновении обострения после отмены требуется назначение нового курса.
В последнее время на отечественном рынке появился новый препарат для профилактики рецидивов ИМП. Этот препарат представляет собой лиофилизированный белковый экстракт, полученный путем фракционирования щелочного гидролизата некоторых штаммов E. coli и носит название Уро-Ваксом. Проведенные испытания подтвердили его высокую эффективность с отсутствием выраженных побочных явлений, что возлагает надежду на его широкое использование.
Важное место в лечении больных с ИМП занимает диспансерное наблюдение, которое заключается в следующем.
Литература
С. Н. Зоркин, доктор медицинских наук, профессор
НЦЗД РАМН, Москва
Что такое острый цистит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Колесников Д. Л., хирурга со стажем в 13 лет.
Определение болезни. Причины заболевания
Острым циститом ( Acute cystitis) болеют преимущественно женщины. Это связано с анатомо-физиологическим строением женского организма — у женщин короткая уретра, наружное отверстие уретры расположено ближе к прямой кишке, чем у мужчин. Половина женщин в мире в течение жизни имели, по крайней мере однократно, эпизод цистита [12][19]. В России ежегодно регистрируется более 30 млн новых случаев цистита [12][19]. Чаще заболеванием страдают женщины в возрасте от 25 до 30 лет или старше 55 лет [1][6].
Острый цистит – это состояние, прежде всего возникающее у небеременных женщин пременопаузального возраста, не имеющих анатомических и функциональных нарушений мочевыводящих путей, а также на фоне полного здоровья [12][19]. У женщин пожилого возраста мочеполовые симптомы необязательно обусловлены циститом.
Существуют редкие неинфекционные формы острого цистита, связанные с физическими воздействиями. Например ионизирующее излучение при прохождении лучевой терапии часто становится причиной острого лучевого цистита.
Основные симптомы:
При типичном развитии острого цистита общее самочувствие сохраняется на удовлетворительном уровне, многие пациенты продолжают вести обычную повседневную жизнь.
В большинстве случаев к развитию острого цистита приводит жизнедеятельность бактерий:
Существует небольшая группа циститов, развивающихся после применения медицинских препаратов. Типичный пример возникновения острого цистита — возникающий после внутрипузырного введения вакцины БЦЖ (живые микобактерии вакцинного штамма бацилл Кальмета-Герена) в мочевой пузырь при иммунотерапии неинвазивного рака мочевого пузыря.
Провоцирующими факторами для возникновения острого цистита являются:
У мужчин острый цистит развивается редко и обычно является осложнением другого заболевания, например уретрита или простатита, а также следствием аденомы простаты.
Симптомы острого цистита
Появление симптомов острого цистита носит внезапный характер, заболевание может развиться за несколько часов. Часто пациенты отмечают наличие провоцирующего фактора, например общего переохлаждения или сексуальной активности. Если в течение шести месяцев происходит два и более острых эпизода, то в таких случаях говорят о рецидивирующем цистите.
Наиболее частые проявления острого цистита:
Часто у молодых женщин симптомы острого цистита могут быть связаны с половым актом, появлением нового полового партнёра, использованием спермицидов, наличием камней в почках или аномалий мочевыводящих путей, сахарного диабета и др. [12] [19]
Патогенез острого цистита
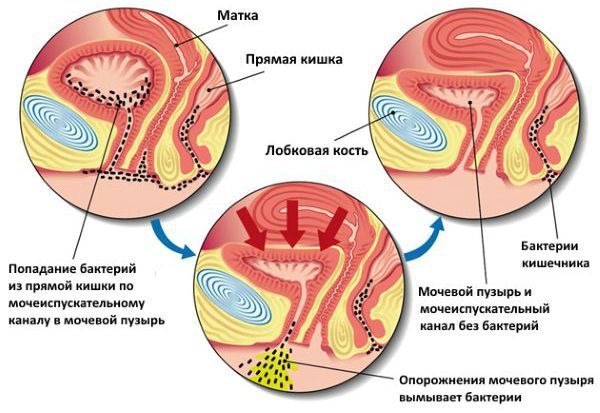
Проникновение патогенных микроорганизмов в мочевой пузырь возможно следующими путями:
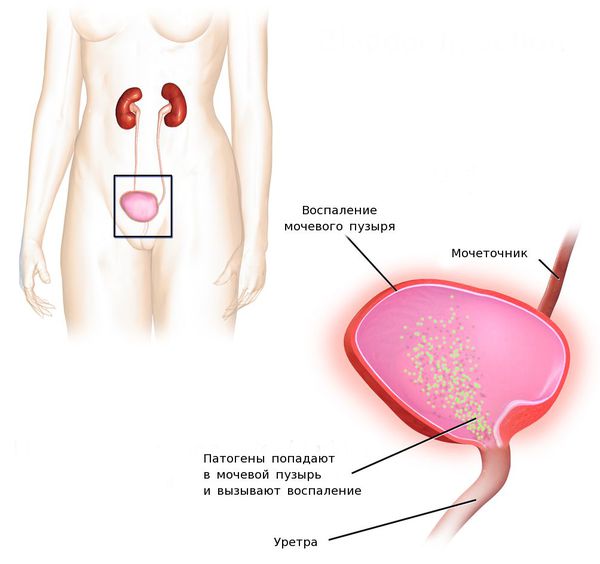
После попадания уропатогенов на слизистую мочевого пузыря происходит их фиксация и «противостояние» возбудителя защитным клеткам слизистой оболочки органа. Фиксация уропатогенов к слизистой оболочке осуществляется за счёт так называемых адгезинов — ворсинок, среди которых наиболее изучены тип 1, Р и S. Тип 1 — это маннозо-чувствительный тип. В дальнейшем зафиксированные уропатогены на слизистой оболочке мочевого пузыря начинают формировать над собой защитную биоплёнку. Благодаря биоплёнкам уропатогены могут оставаться достаточно долго неуязвимыми и периодически вызывать обострения цистита [12][18][19][20].
В мочевом пузыре появляются признаки воспалительного процесса — боль в связи с раздражением болевых рецепторов в подслизистом слое, отёк и покраснение слизистой, локальное повышение температуры в мочевом пузыре и нарушение его функций. При проникновении бактерий в подслизистый слой возможно разрушение микроциркуляторного русла с развитием геморрагического цистита, при котором кровь из повреждённых мелких сосудов изливается внутрь мочевого пузыря, из-за чего в моче появляются примеси крови.
Классификация и стадии развития острого цистита
По этиологии выделяют:
По течению воспалительного процесса делят:
По характеру морфологических изменений:
С учётом развития осложнения острый цисит подразделяют на:
Также выделяют внебольничный и внутрибольничный цистит. Внутрибольничный цистит отличается наличием устойчивых бактерий к тем или иным антибиотикам [12][19].
Осложнения острого цистита
К основным осложнениям острого цистита относятся: острый пиелонефрит, хронический цистит и гематурия.
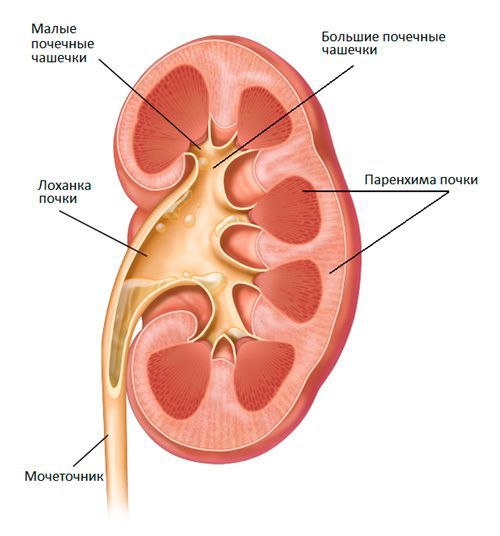
Острый пиелонефрит — это воспаление почек, обусловленное инфекционным агентом с поражением паренхимы, чашечно-лоханочного комплекса и волокнистой соединительной ткани почки.
Хронический цистит — клиническая картина при обострении соответствует острому циститу, но симптомы менее выражены, температура зачастую не поднимается выше 37,5 °С. Нередко при хроническом цистите не удаётся выявить взаимосвязь с инфекционным агентом, поэтому антибактериальная терапия нужна не всегда.
Гематурия (геморрагический цистит). При проникновении бактерий в более глубокий слой (подслизистый) происходит разрушение микроциркуляторного русла, которое проявляется микрокровоизлияниями в слизистой оболочке. Гематурия при остром цистите протекает относительно доброкачественно и редко приводит к тяжёлым последствиям, таким как анемия, коллапс и шок. Более злокачественное течение гематурия приобретает у лиц, принимающих препараты, препятствующие тромбообразованию.
При обширном поражении подслизистого слоя возможно развитие грозного осложнения — тампонады мочевого пузыря массивным сгустком крови. При заболевании просвет мочевого пузыря заполняется сгустками, вследствие чего повышается давление внутри мочевого пузыря, в мочеточниках и почках. Часто проявляется задержкой и отсутствием самостоятельного мочеиспускания с резкими болями над лоном. Осложнение требует незамедлительной госпитализации в хирургический стационар, так как может привести к острой почечной недостаточности.
Диагностика острого цистита
При неосложнённом течении болезни для постановки диагноза достаточно осмотра у врача-уролога, наличия вышеописанных жалоб и общего анализа мочи.
При остром цистите в общем анализе мочи обнаруживаются лейкоциты, бактерии, белок. Анализ мочи может быть выполнен как при помощи лабораторного анализатора, так и при помощи тест-полосок (положительный тест на нитриты и лейкоцитарную эстеразу свидетельствует о цистите).
Если в течение четырёх недель симптомы острого неосложненного цистита не прошли, несмотря на проводимое лечение, или прошли, но вернулись через две недели, то показано выполнение посева мочи с определением чувствительности к антибиотикам[12][19].
На посев сдаётся средняя порция утренней мочи и желательно сразу её отправить на анализ, если это невозможно, то мочу желательно до отправки хранить при температуре от +2 до +8.
В национальных российских клинических рекомендациях также рекомендовано выполнить бактериологическое исследование влагалищного содержимого и анализ на инфекции, передаваемые половым путём.
В последнее время для диагностики рецидивного цистита (при условии отсутствия роста на обычном посеве) применяют анализ на микробиом при помощи техники расширенного количественного посева мочи и генного секвенирования [20]. Раньше общепринято было считать, что моча стерильна, однако это не так. Моча не стерильна. Следует помнить, что часто бактерии в моче можно не обнаружить, ведь порой бактерии могут проникать внутрь клеток слизистого слоя мочевого пузыря с формированием защитных пленок [12][19].
Если возможности оценить микробиом нет, а посев оказался «чистым», но при этом присутствуют клинические симптомы цистита, то мочу можно отправить на посев для исключения Ureaplasma urealyticum или Mycoplasma hominis [12][19].
Осмотр в кресле у пациенток с рецидивной формой цистита является обязательной частью: исключаются влагалищная эктопия и/или гипермобильность наружного отверстия уретры, выделение из наружного отверстия уретры, наличие воспаления около уретральных желез, оценивается состояние слизистой влагалища или его выпадения и т. д. Вероятность инфицирования значительно возрастает при влагалищной эктопии и/или гипермобильности наружного отверстия уретры.
Влагалищная эктопия — расположение наружного отверстия уретры на границе или на передней стенке влагалища.
Гипермобильность — повышенная подвижность наружного отверстия и дистального отдела уретры у женщин в связи с наличием уретрогименальных спаек. При каждом половом акте происходит смещение наружного отверстия уретры во влагалище, ввиду чего осуществляется непрерывный ретроградный заброс микрофлоры влагалища в уретру, которая в свою очередь является постоянным источником инфицирования нижних мочевыводящих путей. Эта разновидность цистита получила название посткоитальный цистит.
Ультразвуковое исследование почек и мочевого пузыря выполняется всем пациенткам с рецидивной формой цистита, учитывая безопасность метода и потенциальную полезность.
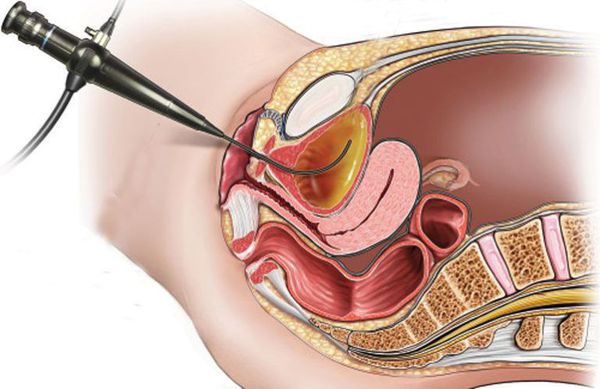
Цистоскопию рекомендовано выполнять при отсутствии эффекта от проводимой терапии, с частыми рецидивами, связанным с бактериальной инфекцией и/или при наличии предрасполагающих факторов риска (аномалии мочевых путей, камни, опухоли). Цистоскопия представляет собой эндоскопическое исследование, которое выполняется цистоскопом, введённым в уретру, позволяющее осмотреть слизистую мочевого пузыря.
Лечение острого цистита
Алгоритм лечения острого цистита:
Если цистит носит рецидивный характер, то антибиотик выбирается по результатам посева мочи.
Этиологическое лечение (направленное на устранение причины и условий развития болезни)
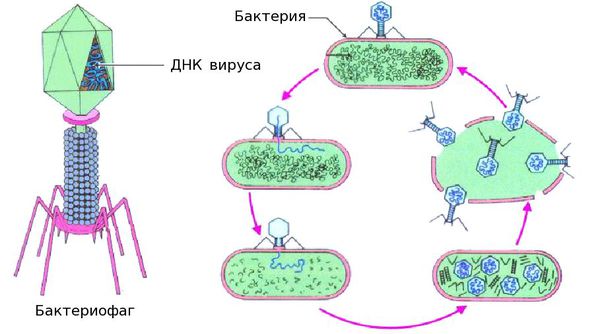
При рецидивах острого цистита в последнее время всё чаще используют препараты бактериофагов — лекарства на основе вирусов, избирательно, словно снайперским огнём, уничтожающих бактерии. Чаще всего бактериофаги размножаются внутри бактерий и вызывают их распад на фрагменты.
У пациенток с рецидивирующим циститом, который имеет прямую зависимость с половым актом (посткоитальный цистит) и при наличии глубоко расположенного наружного отверстия уретры используется хирургическое лечение. Операция, направленная на перемещение (транспозицию) уретры имеет высокий процент успеха.
Патогенетическое лечение (направленное на устранение или подавление механизмов развития болезни)
Заместительная гормональная терапия. В постменопаузальном периоде у женщин резко снижается уровень эстрогенов. Эстрогены являются одним из факторов защиты слизистой мочевого пузыря, при снижении ослабляются защитные механизмы слизистой. Возможно введение через уретру или через влагалище гормональных препаратов, содержащих эстрогены.
Если причиной острого цистита является обструктивная уропатия (затруднённое отхождение мочи, связанное с сужением просвета уретры), то после купирования острого периода и ликвидации инфекционного агента проводится хирургическая коррекция — установка цистостомы (специальной дренажной трубки), пластика уретры и т. д.
Симптоматическое лечение (уменьшающее проявления болезни)
НПВС (нестероидные противовоспалительные средства) — большая группа лекарственных средств, обладают обезболивающим, жаропонижающим и противовоспалительным эффектами, уменьшают боль, лихорадку и воспаление. Наиболее известные представители НПВС: аспирин, парацетамол, ибупрофен, диклофенак.
Феназопиридин — данный препарат, попадая с мочой в мочевой пузырь, воздействует на слизистую оболочку нижних мочевых путей, оказывая местное действие. Это способствует уменьшению боли над лоном, жжения и снижению частоты мочеиспускания. Эффект появляется быстро, в считанные часы.
Прогноз. Профилактика
Профилактика заключается:
На сегодняшний день рекомендации по использованию различных препаратов таких как: клюква, влагалищные эстрогены, пробиотики в виде влагалищных свечей, метенамин (Уротропин), D-Манноза, внутрипузырное введение гиалуроновой кислоты и хондроитина сульфата с целью восстановления поверхностного защитного слоя слизистой мочевого пузыря могут иметь положительный эффект, однако их использование имеет слабо доказанный эффект.