Real world evidence что это
Оценить на практике

В 2016 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) впервые приняло акт, регулирующий это направление. Сегодня термины Real World Data (RWD) и Real World Evidence (RWE) являются привычными как для здравоохранения, так и для фармацевтических отраслей многих стран мира. В последние годы это направление развивается и в РФ.
Данные рутинной практики
Еще несколько лет назад медицинская карта была единственным источником информации. Сегодня данные рутинной практики (RWD) можно собрать не только в рамках системы здравоохранения, но и вне ее. Это данные, предоставляемые пациентом (приложения смартфонов); данные в открытых информационных источниках (социальные сети и форумы); а также данные с медицинских и других носимых устройств (глюкометры, тонометры, фитнес-браслеты и др.). Применение искусственного интеллекта позволяет получить данные из интернета (социальные форумы и социальные сети): симптомы заболеваний, лекарственная терапия, диагностика.
Подобное разнообразие источников и типов данных привело к развитию числа научных исследований рутинной практики (ИРП). Наиболее распространенным, уже сформировавшимся и привычным большинству из нас дизайном таких исследований являются неинтервенционные (наблюдательные) исследования. Результатом проведения исследований рутинной практики, в свою очередь, и является Real World Evidence (RWE) или совокупность доказательств рутинной практики.
Сейчас понятие RWD не имеет сложившегося, устойчивого перевода на русский язык, что не влияет на суть и огромную растущую роль данных для здравоохранения и фармотрасли.
Исследования рутинной практики (ИРП)
Классические клинические исследования (КИ) являются частью системы исследований. КИ жестко регулируются во всем мире и в России, для них есть четкие требования к разработке, проведению и получению результатов. Вместе с тем КИ имеют ряд ограничений: отсутствие возможности сформулировать ряд научных задач, ответы на которые есть только в рутинной практике (приверженность терапии, редко встречающиеся нежелательные реакции и т.п.); ограниченная популяция исследования, размер выборки, недостаточный для проведения субанализов и др.
Важным фактором реализации являются скорость проведения исследования и возможность более быстрого получения результатов. Так, в условиях пандемии COVID-19 именно результаты, полученные на основании ИРП, помогли предоставить миру первые научные данные о заболевании и его лечении.
Применение данных и исследований рутинной практики
Новые технологии раскрывают огромные возможности для применения данных рутинной практики: разработка лекарственных средств (ЛС), клинические исследования, исследования рутинной практики (не только наблюдательные и фармакоэкономические), системы поддержки принятия врачебных решений, программы поддержки пациентов, программы скрининга и иные проекты на основе цифровых технологий.
Следующие шаги
Сегодня отсутствует единая нормативно-правовая база для ИРП. Спонсоры проводят подобные исследования, как правило, в соответствии с внутренними системами требований и процессов (системами менеджмента качества). Многие компании ориентируются на часть положений, применимых к КИ, в частности при разработке протоколов исследований, этической экспертизы, анализе данных, написании отчетов.
Необходимы изменения в нормативных актах: проведение ИРП, персональные данные, оценка технологий здравоохранения и т.д.
Ключевыми факторами для принятия ИРП регуляторными органами и агентствами по оценке медицинских технологий являются качество исходных данных и технологий, а также использование правильных методов для получения доказательств на основании этих данных. В связи с этим необходимы действия, направленные на формирование единых унифицированных требований и процессов планирования и проведения ИРП. Такой подход обеспечит единый стандарт качества исследований рутинной практики.
Для успешной реализации поставленных задач важна совместная работа регуляторных органов, государственных и частных учреждений здравоохранения, врачей-исследователей, профессиональных сообществ, биофармкомпаний и пациентов.
Кирилл Тверской, медицинский директор компании Pfizer в России и Беларуси:
— Направление RWЕ стремительно набирает популярность. RWE предоставляют полезную информацию, которая может помочь заполнить пробелы в знаниях о том, как ЛС используются в медицинских учреждениях. RWE помогает лучше понять реальную эффективность и безопасность ЛС, в то время как практикующие врачи могут использовать их в сочетании с результатами КИ для принятия повседневных решений о лечении пациентов. Более того, RWE оценивается регуляторами многих стран с точки зрения их потенциального использования для уточнения регистрационной информации.
Юнона Хомицкая, медицинский директор компании «Сервье»:
Олег Розенсон, медицинский директор компании Merck Biopharma в России и странах СНГ:
Данные Реальной Клинической Практики (Real World Data) в онкологии: ЧАСТЬ 1
Автор: Овчинников Дмитрий Александрович, кандидат биологических наук, эксперт в фармразработке
Создание новых лекарственных средств (ЛС) в эру доказательной медицины покоится на 4 столпах: фармацевтическая разработка, доклинические исследования, контролируемые рандомизированные клинические исследования (РКИ) и регистрация в уполномоченном органе, включающая анализ и оценку всех полученных данных и процесса производства. Первые шаги к пониманию важности всех этих элементов были сделаны в прошлом веке, но эта дорога не была простой. На этом пути хватало трагических поворотов (сульфаниламидная 1 или талидомидовая 2 трагедии) и преступлений (незаконные эксперименты нацистских врачей 3 ), но общими усилиями врачей, ученых, пациентов и общественных деятелей удалось создать разумную систему контроля за созданием новых ЛС и оценки их риска/пользы, а затем описать ее в документах Международной конференции по Гармонизации (ICH), так называемых GxP руководствах и их национальных аналогах.
Однако со временем стали видны проблемы и недостатки классических клинических исследований (КИ). Выделим 3 наиболее важных, хотя сложностей больше.
Хотя идеального решения этих вопросов пока не найдено, развитие науки и технологий указали один из возможных путей – это анализ Данных Реальной Клинической Практики (ДРКП) или Real World Data.
Давайте сначала разберемся, что такое ДРКП, откуда они берутся, какие проблемы призваны решить, коснемся проблем и ограничений ДРКП, а затем во второй части посмотрим на первые успехи этого подхода, который уже показал свой потенциал во многих странах мира.
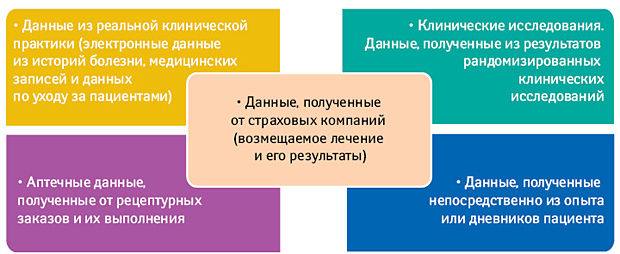
ДРКП можно определить как данные, полученные в рутинной клинической практике при применении ЛС у пациентов. Источниками ДРКП являются:
• Данные с носимых устройств, фиксирующих состояние пациента (фитнес-трекеры, инсулиновые датчики, мобильные телефоны и т. д.);
• Дневники пациентов и аналогичные записи самооценки состояния;
• Результаты лечения по оценке пациента (Patient-oriented Outcome).
Особое значение в последнее время приобретают данные, полученные из социальных сетей, и так называемые Результаты лечения по оценке пациента. Это совершенно новый подход к изучению эффектов ЛС, основанный на самостоятельной оценке пациентами результатов лечения. Это логичное продолжение концепции по оценке качества жизни – Quality of Life (QoL), получившей очень ограниченное использование в российской практике, но пользующейся большим спросом на Западе.
С появлением компьютерных систем ведения медицинских записей объём ДРКП стал лавинообразно нарастать, и сейчас ведущие базы данных уже обладают сотнями миллионов уникальных пациентских записей. Появившиеся новые статистические методы анализа, технологии Data Sciences (наука о данных) и нейросетевое программирование привели к созданию инструментов для обработки и анализа таких массивов данных, чтобы выявить закономерности, тренды и важные факторы, предсказывающие успех/неуспех лечения.
Почему ДРКП так популярны?
Помимо моды на все новое, которая иногда захлестывает и ученых, ДРКП обладают несколькими свойствами, делающими их потенциально важным инструментом в разработке и оценке ЛС.
Для появления большинства ДРКП — в отличие от КИ — не нужно писать протоколы (в случае наблюдательных исследований предварительное одобрение Протокола все же необходимо), одобрять их в регуляторном органе и давать пациентам препараты бесплатно. Повседневная медицинская деятельность сама будет генерировать ДРКП при условии установки систем электронных медицинских записей и интеграции лабораторного комплекса. Процессы цифровизации медицины идут самостоятельно и не ложатся тяжким грузом на бюджет исследования.
Сбор данных с носимых устройств или из аптечных систем также не требуют расходов. Владельцы данных могут продавать их для анализа, но расходы на приобретение такой базы все равно будут не сопоставимы с расходами на включение 1 пациента в РКИ.
Так как ДРКП генерируются самопроизвольно и содержат истории пациентов с самыми разнообразными заболеваниями и состояниями, то для ответа на любой научный вопрос достаточно лишь получить доступ к базе данных, иметь алгоритм обработки данных и хорошие вычислительные мощности. Таким образом, ответ может быть получен в течение считанных дней (при условии наличия базы данных).
Особое значение это приобретает для оценки каких-либо отдаленных эффектов (профилактика возникновения заболевания или рецидива, истинная выживаемость вместо пятилетней). В ходе РКИ изучение таких эффектов – очень долгое и дорогое удовольствие, и это вынуждает изучать суррогатные конечные точки. Лучшие из баз ДРКП на сегодняшний день уже охватывают более 10 лет наблюдения, это позволяет оперативно оценивать длительные эффекты терапии. При этом сбор информации продолжается, и скоро глубина баз данных достигнет продолжительности человеческой жизни.
В базе данных ДРКП будет регистрироваться медицинская информация от любых пациентов с самыми разными заболеваниями, поэтому одну и ту же базу (при условии значительного размера) можно использовать для изучения разных препаратов или болезней снова и снова.
Универсальность данных помогает решать и другую проблему РКИ – узкий спектр оценки. При написании протокола автору приходится формулировать гипотезу об эффекте препарата, и в зависимости от нее фиксировать небольшое количество конечных точек исследования (например, выживаемость или снижение какого-то биологического маркера), по которым будет оцениваться эффективность ЛС. Но препарат может влиять на выбранные конечные точки незначительно, в то же время существенно улучшая какие-то другие терапевтически важные и значимые параметры (другие маркеры, время до прогрессии и т. д.). Анализируя ДРКП, можно оценить изменения практически любого количества конечных точек и увидеть действия ЛС во всей полноте.
Наиболее содержательным и трудно разрешимым возражением против РКИ является тот факт, что в них включают только «идеализированных пациентов», прошедших сквозь сито критериев включения и исключения. Это позволяет лучше проследить эффекты применения препарата на относительно небольшой популяции, но в реальной практике как эффективность, так и безопасность ЛС могут сильно отличаться. Пациенты в реальной практике болеют многими заболеваниями, принимают множество препаратов и БАДов, а уровень их приверженности лечению и частота наблюдений сильно варьируют. Все это приводит к разнице между эффективностью и безопасностью препаратов, показанными в ходе РКИ и в реальной практике. Особенно важно, что ДРКП позволяют получить данные от особых пациентских групп (детей, беременных женщин и т. д.), включение которых в РКИ затруднено.
Разница между реальной практикой и результатами РКИ стала приобретать особое значение с выходом на рынок сверхдорогих ЛС стоимостью в сотни тысяч долларов США для лечения рака или орфанных заболеваний. Если заявленная эффективность сильно выше реальной, то фармакоэкономические модели, положенные в основу согласованной цены, неверны, и система здравоохранения существенно переплачивает. Экономика здравоохранения — один из основных «заказчиков» исследований ДРКП в настоящее время.
Проблемы и ограничения.
Безусловно, анализ ДРКП имеет свои ограничения, но многие из них могут быть устранены общими усилиями ученых, регуляторов и медицинского сообщества.
Хотя отдельные примеры использования ДРКП прослеживаются с середины прошлого века, систематический сбор баз данных начался недавно. Глубина наблюдения приближается в настоящее время к 10 годам, а количество записей для лучших баз данных уже превышает 100 млн. С учетом неполноты записей, разных стандартов ведения и лечения пациентов, сбор достаточной для анализа единообразной выборки остается непростой задачей. Эта проблема, безусловно, будет преодолена со временем, сейчас и FDA, и EMA рекомендуют объединять несколько разных баз данных для формирования гомогенной выборки нужного размера.
Права доступа даже к анонимизированной медицинской информации сильно отличаются в разных странах мира, это препятствует объединению баз и проведению международных исследований. Многие из баз данных были сформированы без надлежащего согласия/уведомления пациентов или способом, который не признан на территории других стран, что требует от заказчика исследования особой аккуратности при выборе источников данных. Трансграничная передача такой информации контролируется специальными и очень запутанными законами как в США и Европе, так и в РФ. Здесь необходимо запустить процесс по гармонизации условий получения согласия на сбор, хранение и передачу информации из баз ДРКП аналогичный тому, который был сделан для КИ в рамках ICH.
Аналогично, отсутствует консенсус о приемлемых и правильных алгоритмах/подходах к нормированию баз данных, их анализу и методам представления результатов. Хотя работа по формализации этой области уже начата как регуляторами, так и научным сообществом, требуется ускорить работу в этом направлении. Классические статистические подходы, используемые для анализа РКИ, малоприменимы для анализа ДРКП и должны быть существенно переработаны с учетом гетерогенности данных, их неполноты, потенциального задвоения данных и разнообразия оцениваемых переменных.
Низкий уровень доверия к результатам анализа ДРКП среди экспертов и регуляторов сдерживает развитие этого подхода, который может органично дополнить имеющиеся инструменты по оценке профиля эффективности и безопасности ЛС. С этой проблемой помогут справится новые исследования по сопоставимости данных РКИ и ДРКП, включение анализа ДРКП в регуляторные документы по примеру рамочной программы FDA 6 и популяризация подхода в экспертном сообществе (через обучение и распространение информации об успехах и ограничениях нового метода).
Список использованной литературы:
Доказательства из реального мира ( RWE ) в медицине означают доказательства, полученные из данных из реального мира (RWD), которые представляют собой данные наблюдений, полученные вне контекста рандомизированных контролируемых испытаний (РКИ) и полученные в ходе рутинной клинической практики. Для оценки результатов лечения пациентов и обеспечения того, чтобы пациенты получали подходящее для них лечение, необходимо использовать данные из реального мира. RWE генерируется путем анализа данных, которые хранятся в электронных медицинских картах (EHR), базах данных медицинских заявлений или выставления счетов, реестрах, данных, генерируемых пациентами, мобильных устройствах и т. Д. Он может быть получен из ретроспективных или проспективных наблюдательных исследований и наблюдательных реестров. В США Закон о лечении 21 века требовал от FDA расширения роли реальных доказательств.
Фактические данные из реального мира вступают в игру, когда клинические испытания не могут реально учесть всю популяцию пациентов с конкретным заболеванием. Пациенты, страдающие сопутствующими заболеваниями или принадлежащие к отдаленному географическому региону или возрастным ограничениям, которые не участвовали в каких-либо клинических испытаниях, могут не реагировать на рассматриваемое лечение, как ожидалось. RWE дает ответы на эти проблемы, а также анализирует действие лекарств за более длительный период времени. Фармацевтические компании и плательщики медицинского страхования изучают RWE, чтобы понять, как пациенты могут оказывать надлежащую помощь соответствующим людям, а также минимизировать свои собственные финансовые риски путем инвестирования в лекарства, которые работают для пациентов.
СОДЕРЖАНИЕ
Качество данных
Пригодность по назначению
Точно так же, чтобы иметь достаточное качество данных, данные реального мира должны соответствовать назначению. Ресурс RWD может быть пригоден для ответа на одни вопросы, но не на другие. Например, набор данных, в котором отсутствуют связи между матерью и ребенком, может не подходить для изучения лекарственного риска для плода, но может использоваться для вопросов о безопасности лекарств у пациентов, принимающих лечение эпилепсии (только для пациента; не включая безопасность для плода). Поскольку качество данных можно оценить вне конкретной цели (на общем уровне), соответствие цели оценивается отдельно от качества данных и не входит в понятие качества данных.
Real-World Evidence: новый виток в обеспечении достоверных данных о лекарственных средствах
Для выведения нового препарата на рынок требуется в среднем 10 лет и 2 млрд дол. США. С таким количеством заболеваний и состояний, для которых все еще не разработано эффективного лечения, например болезнь Альцгеймера, которая затрагивает более 5 млн американцев, необходимость ускорить появление новых, более эффективных методик лечения и лекарственных средств является очевидной.
Использование регуляторными и профильными органами здравоохранения фактических данных доказательств, или real-world evidence (RWE), отражающих практический опыт пациентов в реальных ситуациях, в дополнение к использованию данных, полученных из обычных рандомизированных контролируемых исследований, даст возможность улучшить доступ к безопасному и эффективному лечению для населения.
Но, что более важно, процесс одобрения, основанный на RWE, который поддерживает самые высокие стандарты безопасности, но при этом позволяет быстрее выводить на рынок новые лекарства, поможет сотням тысяч людей, которые ждут своего лечения, в том числе и новых препаратов.
Оцифровка существующих данных и значительное увеличение количества электронных данных, полученных в ходе рутинной помощи работниками сферы здравоохранения или непосредственно самими пациентами, создают беспрецедентную возможность для модернизации и расширения данных клинических исследований, улучшения процесса постмаркетингового мониторинга лекарственных средств.
Как препараты попадают на рынок?
Процесс выведения лекарственного средства на рынок является достаточно длительным, комплексным и сложным ( табл. 1 ). При этом клинические исследования — наиболее критический, дорогостоящий и трудоемкий этап процесса разработки препаратов, на который уходит в среднем около 7 лет и 1,6 млрд дол. ( табл. 2 ). Решение об окончательном одобрении препарата в значительной степени основывается на данных клинических испытаний.
| Таблица 1 | Современный процесс разработки лекарств |
| Этап | Описание действий |
| Доклиническая фаза | Спонсор разрабатывает (покупает или лицензирует) новое лекарственное соединение и проводит исследования на животных для оценки его токсичности.Спонсор подает заявку на проведение клинических исследований нового лекарственного средства, основанную на результатах первоначального тестирования, и разрабатывает план тестирования на людях. FDA рассматривает заявку на предмет того, подвергают ли предполагаемые клинические исследования человека неоправданной угрозе причинения вреда |
| Клинические исследования | Обычно препараты проходят 3 этапа клинических исследований:• Исследования I фазы являются первыми исследованиями применения нового препарата человеком. Этот этап призван обеспечить более глубокое понимание безопасности препарата, включая побочные эффекты, связанные с его дозой.• Исследования II фазы оценивают эффективность препарата для конкретного терапевтического применения у пациентов. При этом продолжается оценка безопасности лекарственного средства. Основная цель — получить предварительные данные о том, работает ли препарат у людей с определенным заболеванием или состоянием.• Исследования III фазы включают относительно большое число пациентов и предназначены для сбора достаточной информации о безопасности и эффективности препарата для удовлетворения требований FDA по адекватной оценке соотношения польза/риск, а также для подготовки информации для маркировки лекарства |
| Рассмотрение регистрационного досье | • После проведения клинических исследований спонсор подает в FDA на рассмотрение регистрационное досье, которое включает данные, полученные в результате всех исследований (на животных и на людях), а также информацию о том, как лекарственное средство ведет себя в организме и как оно производится.• FDA рассматривает маркировку лекарственного средства и обеспечивает наличие соответствующей информации, которая предоставляется к сведению медицинских работников и потребителей.• FDA инспектирует объекты, на которых будет производиться лекарственное средство.• FDA либо одобряет заявку, или выдает ответное письмо |
| Постмаркетинговая деятельность | • После одобрения препарата начинается IV фаза — постмаркетинговые исследования, по результатам которых спонсор обязан представлять периодические обновления в FDA.• FDA также установлена постоянная система постмаркетинговых наблюдений за препаратом для выявления серьезных, неожиданных побочных эффектов и принятия соответствующих мер в случае необходимости |
| Таблица 2 | Среднее время и стоимость процесса выведения препарата на рынок |
| Факторы | Доклиническое изучение | Клинические исследования | Рассмотрение FDA | Постмаркетинговыеисследования | ||
| Фаза I | Фаза II | Фаза III | ||||
| Время, годы | 1 | 1,65 | 2,53 | 2,56 | 1,33 | Бессрочно |
| Общая средняя продолжительность клинических исследований — 6,74 | ||||||
| Стоимость,дол. | 182 млн | 375 млн | 542 млн | 689 млн | 129 млн | 312 млн |
| Общая средняя стоимость клинических исследований — 1,6 млрд | ||||||
Исследователи из США в течение более 50 лет проводили клинические исследования для одобрения Управлением по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) одинаковым образом. Эти клинические исследования в значительной степени основаны на рандомизированных клинических исследованиях, которые, как правило, являются плацебо-контролируемыми, двойными слепыми, в которых пациенты распределены по группам, но ни пациент, ни исследователь не знают, что принимает пациент — плацебо или лекарственное средство. Такой тип исследований является золотым стандартом клинических исследований, однако имеет некоторые ограничения.
Плотно контролируемая природа рандомизированных клинических исследований позволяет получить убедительные доказательства эффективности и безопасности использования лекарственного средства, но только в относительно небольших и узко определенных популяциях, что ограничивает данные об их применения у более широкого круга пациентов. Часто в данных клинических исследований отсутствует информация о применении препарата у пациентов со множественными сопутствующими заболеваниями, с сопутствующим приемом других препаратов, а также различных рас и этнических групп, возраста и т.д.
То есть из-за ограниченности количества пациентов, включенных в исследование, невозможно получить полную картину того, как препарат поведет себя в реальных условиях. Например, исследование для нового противодиабетического препарата обычно не включает пациентов, у которых также выявлены другие заболевания, так что исследователи могут оценить влияние лекарственного средства только на целевое состояние, а не на сопутствующие виды патологии. Однако у многих пациентов с сахарным диабетом очень часто отмечают и другие заболевания, такие как сердечно-сосудистые, например. По большей части клинические исследования не могут продемонстрировать, будет ли препарат влиять на этих пациентов по-разному или как он способен взаимодействовать с другими лекарственными средствами, которые может принимать пациент.
Поскольку невозможно предсказать все эффекты препарата во время клинических исследований, FDA создало систему постмаркетинговой безопасности для выявления серьезных непредвиденных нежелательных явлений и принятия мер в случае необходимости.
Однако даже учитывая постмаркетинговые исследования, в эру перехода к индивидуализированной медицине, когда принимаются во внимание индивидуальные генетические особенности каждого пациента, данные рандомизированных клинических исследований не могут обеспечить полный объем необходимой информации о применении препарата.
Многие эксперты согласны с тем, что RWE, используемые в сочетании с протоколами клинических исследований, могут помочь устранить некоторые из этих ограничений.
RWE: новая возможность для улучшения процесса
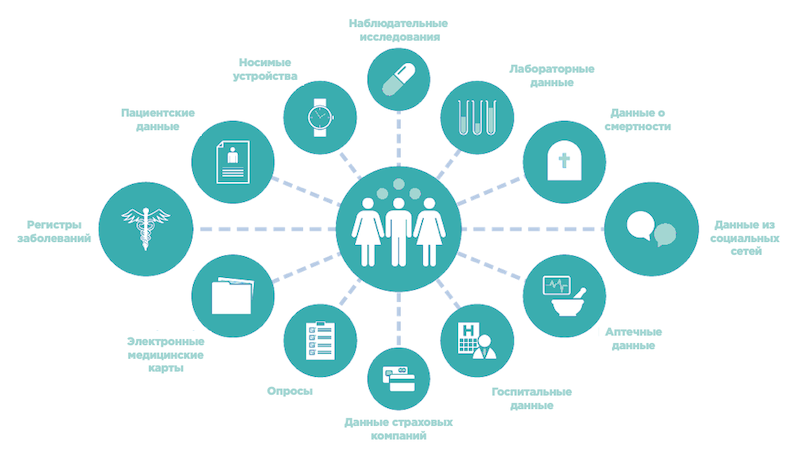
Данные, полученные из источников за пределами рандомизированных клинических исследований, отражающие фактический опыт пациентов, часто называются реальными данными (real-world data — RWD). RWE получают из источников RWD, таких как электронные медицинские записи, лабораторные информационные системы, аптечные и радиологические системы, системы административных требований и реестры ( рис. 1 ). Также источниками получения RWD являются данные, полученные от пациентов, собранные ими на домашних и портативных устройствах мониторинга, а также из сетей обмена информацией, социальных сетей и мобильных приложений.
Значительное увеличение использования электронных медицинских записей в клинических условиях в сочетании с резким увеличением числа лиц, записывающих медицинскую информацию с помощью устройств и приложений для обмена информацией, создает беспрецедентные объемы данных, которые могут быть полезны и использоваться при принятии регуляторных решений. Около 83% врачей и 84% лечебных учреждений сегодня используют какой-либо тип электронных медицинских записей, создавая каждый день невероятное количество клинических данных, которые сегодня не используются.
Кроме того, 7 из 10 взрослых американцев говорят, что они отслеживают по крайней мере один индикатор состояния здоровья для себя или для кого-то другого ежедневно в домашних условиях. 58% владельцев смартфонов в США имеют на телефоне приложение для фитнеса или здоровья, и около 65% этих людей открывают приложение по крайней мере 1 раз в день. Многие из таких приложений подключаются к носимым устройствам, которые отслеживают активность и фиксируют важные показатели состояния здоровья.
Все они являются источниками потенциально полезных данных о состоянии здоровья, которые могут дополнять данные, полученные в результате рандомизированных клинических исследований.
Обзор real-world data
Реальные данные сегодня уже используются для поддержки целого ряда инициатив по улучшению здоровья и медицинского обслуживания.
FDA уже использует RWD в постмаркетинговом надзоре за фармацевтическим рынком. Однако использование реальных данных менее распространено при получении доказательств в ходе клинических исследований и в качестве аргументов для предоставления разрешения на выведение препарата на рынок.
Несмотря на то что использование RWD при сборе доказательств эффективности до выхода препарата на рынок не запрещено законом в США, оно не распространено широко из-за отсутствия ясности в отношении требований к доказательствам, связанным с их использованием, и устоявшимися представлениями о том, что только рандомизированные клинические исследования являются достаточной базой для одобрения препарата FDA.
Использование прагматических рандомизированных клинических исследований — один из способов начать накопление опыта с использованием RWD в рамках клинических исследований. Прагматические клинические исследования — это исследования, которые проводятся в местах, где осуществляется обычный уход за пациентами, например в клиниках, больницах, домах престарелых и других медицинских учреждениях, и в которые включаются разнообразные репрезентативные группы населения с многочисленными гетерогенными показателями.
Преимущества Real-World Evidence
RWЕ имеют массу перспективных сфер применения ( рис. 2 ), в том числе и на этапе проведения клинических исследований препарата. Так, RWD могут ускорить процесс создания гипотез для информирования о разработке клинических исследований и дают возможность идентифицировать подгруппы с более высоким соотношением риск/польза в качестве целевой аудитории.
Также данные RWD могут способствовать более эффективному и целенаправленному набору пациентов для участия в клинических исследованиях. Мониторинг процесса исследований в режиме реального времени может помочь спонсорам быстрее выявить проблемы безопасности и применения препарата, требующие принятия мер, чтобы избежать развития нежелательных явлений и возникновения ненужных задержек.
Использование RWD может улучшить обобщаемость исследований путем увеличения числа рандомизированных клинических исследований с помощью данных более широкой, более разнообразной группы пациентов в различных условиях практики, нежели те, которые доступны в настоящее время. RWD могут сделать исследования и их результаты более релевантными для пациентов и предоставить информацию о долгосрочных результатах.
Наконец, более раннее генерирование данных об эффективности лекарственного средства может помочь быстрее допускать препарат на рынок, а также формировать решение относительно его стоимости и уровня возмещения, что является очень важным в рамках государственных программ по обеспечению населения надлежащей медицинской помощью.
RWE также предоставляют значительные возможности для совершенствования постмаркетинговой деятельности, сокращая время и затраты на проведение IV фазы исследований, за счет более эффективных и своевременных методов сбора информации. RWE могут также повысить эффективность исследований, подтверждающих клиническую пользу применения лекарственных средств, одобренных в рамках ускоренных программ FDA.
Интеграция RWE в процесс разработки лекарственных средств
Интеграция RWE в современный процесс разработки лекарственных средств является очень важным и выгодным процессом, однако требует повышения уверенности в типах доказательств, которые используются, и обстоятельств, при которых это будет происходить. Улучшение качества данных и изменений в политике обмена информацией сделает использование RWE более доступным и позволит значительно упростить и удешевить современные производственные процессы.
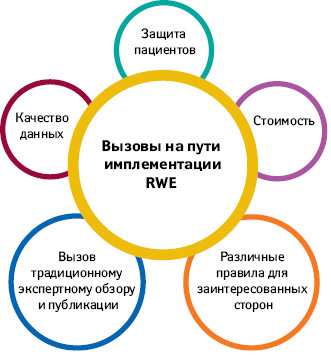
Проблемы, которые стоят на пути интеграции
Существует ряд трудных, но преодолимых вызовов с имплементацией RWE ( рис. 3 ), в том числе отсутствие полноты данных для клинических исследований, отсутствие принятых стандартов для обеспечения эффективной интероперабельности и использования данных в разных системах, отсутствие согласия в отношении методов точного сопоставления групп пациентов, а также отсутствие прослеживаемости данных или информации об их происхождении. В настоящее время ведется работа по решению многих из этих проблем, но потребуются дополнительные меры для поддержки создания и использования RWE.
В частности, необходимо преодолеть вызовы в следующих областях:
Вывод
RWE бросают вызов традиционной парадигме, в которой единственные авторитетные медицинские данные генерируются с помощью проспективных рандомизированных клинических исследований, которые подтверждаются публикацией в научных журналах и получили экспертную оценку.
Увеличение объема имеющихся электронных данных в сочетании с научными достижениями, приводящими к персонализированным и более сложным схемам лечения, требуют нового, модернизированного подхода как в разработке лекарственных средств, так и в принятии решений относительно их допуска на рынок. И именно RWE могут сыграть значительную роль в модернизации этих процессов и обеспечить безопасным и эффективным лекарственным средствам более быстрое и экономичное выведение на рынок. Использование RWE не только улучшит глобальную конкурентоспособность, но, что более важно, поможет сотням тысяч пациентов, которые ждут лечения.
Для того чтобы заложить основу для новой эры точной медицины, потребуются адаптивные подходы к принятию нормативных решений. По мере того, как медицина становится более персонализированной и узконаправленной, традиционные масштабные рандомизированные клинические исследования постепенно утрачивают свою актуальность.
Новые подходы будут необходимы для обеспечения безопасности и эффективности лечения и для защиты здоровья пациента.
Коментарі до цього матеріалу відсутні. Прокоментуйте першим