синдром протея код по мкб
Другие уточненные синдромы врожденных аномалий, не классифицированные в других рубриках
14-16 октября, Алматы, «Атакент»
150 участников из 10 стран. Новинки рынка стоматологии. Цены от производителей
Общая информация
Краткое описание
Протокол «Другие уточненные синдромы врожденных аномалий, не классифицированных в других рубриках»
Код по МКБ-10: Q87.8
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
1. Умственная отсталость.
2. Легкая умственная отсталость.
3. Умеренная умственная отсталость.
4. Тяжелая умственная отсталость.
5. Глубокая умственная отсталость.
Диагностика
Диагностические критерии
Жалобы и анамнез: задержка в психоречевом развитии, снижение мышления, памяти, внимания, зрения, слуха, ожирение, расторможенность, врожденные пороки развития со стороны органов зрения, почек, опорно-двигательного аппарата; отягощенная наследственность, перинатальная патология.
Физикальное обследование
Лабораторные исследования: общий анализ крови и мочи, кал на яйца глист, кариотип.
Инструментальные исследования
1. Электроэнцефалография (ЭЭГ): на ЭЭГ задержка формирования возрастной корковой ритмики, диффузные изменения электрогенеза головного мозга.
3. Компьютерная томография головного мозга (КТ).
Показания для консультации специалистов:
Синдром Протея
Синдром Протея – это редкая врожденная патология, проявляющаяся аномальным ростом отдельных частей тела. Обычно выявляется увеличение участка головы, руки или ноги. Частичная гипертрофия сочетается с повышенной вероятностью развития тромбозов и тромбоэмболий, образования опухолей различной структуры и локализации. Диагноз выставляется на основании результатов осмотра, данных рентгенографии, КТ, МРТ, ангиографии, допплерографии. Радикальное лечение не разработано. Применяются ортопедические приспособления, по показаниям осуществляются операции для улучшения функций конечности, облегчения дыхания и приема пищи, выполняется хирургическое удаление неоплазий.
МКБ-10
Общие сведения
Синдром Протея (парциальный гигантизм) – очень редкое врожденное заболевание. В литературе упоминается примерно 200 случаев данной патологии, при этом специалисты не исключают, что некоторые пациенты могли страдать другими болезнями со сходной симптоматикой. Первое описание синдрома было представлено в 1979 году, однако широкую известность он получил после публикации работы немецкого педиатра Видемана в 1983 году. Название также было предложено Видеманом по ассоциации с древнегреческим богом Протеем, способным к изменению внешнего облика. Заболевание оказывает выраженное негативное влияние на качество жизни больных, как из-за внешнего обезображивания, так и вследствие нарушений функций пораженных частей тела. Нередко становится причиной ранней смерти из-за высокой вероятности развития опухолей и склонности к тромбозам.
Причины
Причиной развития заболевания является соматический мозаицизм, предположительно обусловленный случайной мутацией доминантного гена. Некоторые специалисты подвергают сомнению случайный характер мутации, опираясь на информацию о выявлении нескольких случаев легких признаков синдрома у родителей больных. Существуют исследования, согласно которым патология обусловлена мутацией гена PTEN, расположенного в локусе 10q X хромосомы. Вместе с тем, исследователи указывают, что мутации данного гена обнаруживаются всего у 20% пациентов с синдромом Протея и определяются при некоторых других заболеваниях, характеризующихся повышенной вероятностью образования злокачественных неоплазий. Таким образом, генетическая основа болезни пока окончательно не установлена.
Патогенез
В результате мутации в отдельных частях тела образуется три вида клеток – нормальные, гипер- и атрофические. На измененном участке в процесс вовлекаются кожные покровы, костная, мышечная и жировая ткань, лимфатические и кровеносные сосуды, что вызывает деформацию, увеличение длины и объема конечности или части головы, изменения сосудов. Поскольку дефектный ген является супрессором опухолей, наличие мутации резко повышает вероятность появления новообразований.
Симптомы
При рождении признаки заболевания отсутствуют. Патологические проявления возникают в раннем детском возрасте. Клиническая картина полиморфная. Характерными симптомами являются аномальное увеличение одной или нескольких конечностей, макроцефалия, сосудистые аномалии (мальформации, варикозное расширение вен). У некоторых больных выявляются офтальмологические нарушения: экзофтальм, косоглазие, миопия. При патологическом росте нижней челюсти формируется прогения. Возможно разрастание кожи в области подошв. В числе возможных вариантов патологии в литературных источниках упоминается изолированное увеличение селезенки или пальцев рук, атрофия зрительного нерва и пигментная дегенерация сетчатки в сочетании с множественными менингиомами.
Увеличение нижних конечностей влечет за собой нарушение опоры и движений. Пациенты вынуждены пользоваться ортопедической обувью и специальными приспособлениями (тростью, костылями, инвалидной коляской). При увеличении верхних конечностей наблюдаются трудности в процессе самообслуживания. Из-за деформации частей головы возникают грубые косметические дефекты, могут отмечаться затруднения при дыхании и приеме пищи. Существует высокая вероятность развития новообразований различной локализации и гистологической структуры: гамартом, липом, лимфангиом, гемангиом, аденом слюнных желез, менингиом и других.
Осложнения
Типичным признаком болезни Протея является возникновение злокачественных опухолей, существенно сокращающих продолжительность жизни больных. Другими опасными для жизни последствиями заболевания считаются осложнения сосудистых патологий. Отмечается повышенный риск тромбоза глубоких вен. Описаны случаи развития тромбоэмболии легочной артерии. Из-за увеличения и разницы в длине нижних конечностей возрастает нагрузка на суставы и позвоночник, формируется искривление позвоночного столба. Обнаруживаются вторичные артрозы, остеохондроз. Более чем у половины пациентов выявляется умственная отсталость, обусловленная сдавлением нервных тканей увеличенными костями черепа. Возможны судороги, неврологические расстройства.
Диагностика
Из-за незначительной распространенности, сходства синдрома Протея с некоторыми другими врожденными заболеваниями постановка диагноза может представлять значительные затруднения. В процессе диагностического поиска принимают участие специалисты в области онкологии, травматологии и ортопедии, сосудистой хирургии и пр. В качестве основных критериев рассматривают гемигипертрофию, сосудистые аномалии и склонность к образованию опухолей. План обследования включает:
При нарушениях со стороны органа зрения назначается офтальмологическое обследование, при умственной отсталости применяются тесты для определения уровня интеллекта, когнитивных способностей. При судорожном синдроме, расстройствах деятельности центральной и периферической нервной системы показана консультация невролога. Заболевание дифференцируют с врожденным липоматозом и синдромами Клиппеля-Треноне-Вебера, Маффучи, Баннайана-Зоннана, при которых также выявляются опухоли, частичная гипертрофия и патология сосудов.
Лечение синдрома Протея
Патогенетическая терапия не разработана, лечение только симптоматическое. По показаниям осуществляют ортопедическую коррекцию с использованием специальной обуви, ортезов, корсетов при вторичных изменениях позвоночника. Назначают медикаментозную терапию для профилактики тромбозов. Из-за вовлечения различных органов и систем оперативные лечебные мероприятия проводятся разными специалистами, в том числе – ортопедами, онкологами, нейрохирургами, вертебрологами, сосудистыми хирургами, хирургами-косметологами, челюстно-лицевыми хирургами и т. д. Можно выделить следующие группы операций при синдроме Протея:
Прогноз и профилактика
Синдром Протея является инвалидизирующим заболеванием, негативно влияет на продолжительность жизни пациентов. По данным исследований, многие больные погибают в детстве или молодом возрасте. Причинами летального исхода становятся злокачественные неоплазии, ТЭЛА, тромбозы крупных сосудов. Профилактические мероприятия не разработаны из-за врожденного характера патологии и недостаточной изученности этиологии болезни. Пациентам, страдающим данным заболеванием, необходимо регулярно проходить обследование для оценки состояния свертывающей системы крови, раннего выявления новообразований.
Синдромы врожденных аномалий, вовлекающих преимущественно конечности
14-16 октября, Алматы, «Атакент»
150 участников из 10 стран. Новинки рынка стоматологии. Цены от производителей
Общая информация
Краткое описание
Протокол «Синдромы врожденных аномалий, вовлекающих преимущественно конечности»
Код по МКБ:
— Отсуствия (недорозвития) ногтей, надколенника
— Сиреномиелии (сращение нижних конечностей)
— Тромбоцитопения с отсутствием лучевой кости (TAR-синдром)
Q87.4 синдром Марфана
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
1. Умственная отсталость.
2. Легкая умственная отсталость.
3. Умеренная умственная отсталость.
4. Тяжелая умственная отсталость.
5. Глубокая умственная отсталость.
Диагностика
Диагностические критерии
Жалобы и анамнез: задержка в психоречевом развитии, снижение мышления, памяти, внимания, расторможенность, врожденные пороки развития конечностей.
Физикальное обследование
Лабораторные исследования: общий анализ крови и мочи.
Инструментальные исследования:
1. Электроэнцефалография (ЭЭГ): на ЭЭГ задержка формирования возрастной корковой ритмики, диффузные изменения электрогенеза.
2. Электромиография (ЭМГ).
3. Компьютерная томография головного мозга (КТ).
Показания для консультации специалистов:
Синдром протея код по мкб
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Москва, Россия
Кафедра оториноларингологии РМАПО
Кафедра оториноларингологии Российской медицинской академии последипломного образования, Москва
Синдром Протея в практике оториноларинголога: клинический случай
Журнал: Вестник оториноларингологии. 2020;85(2): 45-48
Стожкова И. В., Пчеленок Е. В., Косяков С. Я. Синдром Протея в практике оториноларинголога: клинический случай. Вестник оториноларингологии. 2020;85(2):45-48. https://doi.org/10.17116/otorino20208502145
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Москва, Россия
Описано редкое клиническое наблюдение пациента в возрасте 18 лет с хроническим левосторонним средним отитом на фоне синдрома Протея. К этому возрасту пациент перенес большое количество операций по поводу удаления лимфангиом, гемлимфангиом, ангиокератом тела, а также несколько санирующих операций на левом ухе. Обзор отечественной и зарубежной литературы показал, что этот случай можно считать уникальным.
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Москва, Россия
Кафедра оториноларингологии РМАПО
Кафедра оториноларингологии Российской медицинской академии последипломного образования, Москва
Синдром Протея (СП) — это редкое врожденное заболевание, которое характеризуется пороками развития и чрезмерным разрастанием различных тканей, нарушающим пропорциональность и симметричность тела. Впервые синдром был описан в 1979 г., однако из-за небольшой встречаемости в популяции он до сих пор не до конца изучен (по данным различных авторов, частота встречаемости колеблется в пределах 1:10 6 —1:10 7 человек) [1, 2].
Новорожденные обычно не имеют признаков заболевания, а заметным состояние становится в возрасте 6—18 мес. С возрастом происходит увеличение объемов пораженных областей (характерен мозаицизм роста), что приводит к прогрессированию тяжести состояния [3].
Чаще всего в процесс вовлекается кожа, костная и соединительная ткань. В зарубежной литературе описаны случаи вовлечения в процесс лор-органов, в частности односторонняя гипертрофия небной миндалины [4]. Мы же столкнулись с изменениями, на фоне которых развился хронический левосторонний средний отит. Приводим описание данного клинического наблюдения.
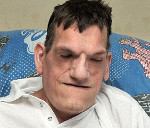
Пациент М., 18 лет, с установленным диагнозом «синдром Протея» обратился в клинику с жалобами на слизисто-гнойные выделения из левого уха.
Анамнез проявлений СП начинается с детского возраста. Первую операцию пациент перенес в 2001 г. в возрасте 1 года — произведено удаление лимфангиомы правого бедра, грыжесечение слева. Затем в течение 2002 г. дважды этапно иссекали лимфангиому правой половины туловища, в 2003 г. удалена гемлимфангиома в правой паховой и лонной областях. В 2008 г. в возрасте 8 лет пациент перенес удаление ангиокератомы правого бедра, аналогичная операция произведена и в 2014 г.
В 2012—2013 гг. в возрасте 12 и 13 лет соответственно пациент перенес 2 санирующие операции на левом ухе по поводу холестеатомы полости среднего уха (операции проводились в Израиле). Затем в возрасте 15 лет ему было выполнено очередное санирующее хирургическое вмешательство: тимпанопластика на левом ухе, септопластика, подслизистая вазотомия и задненижняя конхотомия нижних носовых раковин. В ходе санирующей операции проведено моделирование полости, оставшейся от предыдущих операций (рис. 1), плохо контролируемой из-за оставленных костных выступов. В течение 3 лет после операции при динамическом амбулаторном контроле отмечалось стабильное удовлетворительное состояние контролируемой послеоперационной полости. Однако в начале 2017 г. отмечено резкое разрастание соединительной ткани и костей черепа слева, что привело к полной костно-рубцовой облитерации просвета наружного слухового прохода (НСП) (рис. 2).

В аксиальной проекции визуализируется заполненная мягкотканным содержимым полость, оставшаяся после предыдущих оперативных вмешательств (отмечена стрелкой).

а — 3D-моделирование черепа с резким разрастанием костей слева; б — КТ левой височной кости в аксиальной проекции. Стрелкой указан костно-рубцовый стеноз НСП.
При внешнем осмотре отмечены асимметрия тела, особенно справа, деформация грудной клетки, диспропорциональность нижних конечностей, увеличение пропорции головы относительно туловища, а также изменения костей черепа (слева — выраженная сочетанная деформация челюстей, массивная гиперплазия скулового отростка верхней челюсти и ветви нижней челюсти). Во время общения с врачом пациент принимал такое положение, чтобы придерживать голову рукой, одновременно немного прикрывая деформированную часть лица.
При осмотре в левом НСП визуализируется полная облитерация просвета костной и рубцовой тканями (рис. 3a на цвет. вклейке). При проведении компьютерной томографии (КТ) височных костей слева отчетливо видны деформация костных структур, аномалии их развития и строения, разрастание костной ткани в просвет НСП и послеоперационная полость, затемненная мягкотканным образованием (предположительно, холестеатомными массами). Был поставлен диагноз «Хронический левосторонний средний отит. Состояние после санирующих операций на левом ухе от 2012, 2013, 2015 гг. Костно-рубцовая атрезия левого наружного слухового прохода. Холестеатома слева».
Пациенту было рекомендовано плановое хирургическое лечение, в связи с чем 13.11.2018 он был госпитализирован в лор-отделение ЦКБ гражданской авиации.
При поступлении общее состояние пациента было удовлетворительным. В лор-статусе отмечалось состояние после септопластики, подслизистой вазотомии и задненижней конхотомии нижних носовых раковин, сопряженное с аномалиями костного строения лицевой части черепа слева, а также полная костно-рубцовая атрезия левого НСП. Особое внимание при подготовке к операции уделили общему состоянию, так как пациент отнесен к группе повышенного риска осложнений (в частности, риска тромбоза и тромбоэмболии). Все показатели анализов крови и мочи соответствовали референсным значениям нормы. Пациент был консультирован терапевтом, сосудистым хирургом, челюстно-лицевым хирургом — противопоказаний к оперативному вмешательству не обнаружено. В качестве венозных тромбоэмболических осложнений была показана эластичная компрессия ног. Специфической фармакологической подготовки в предоперационном периоде не требовалось.
14.11.2018 под эндотрахеальным наркозом была выполнена операция по моделированию НСП с дальнейшей ревизией послеоперационной полости эндауральным доступом. Под контролем микроскопа после инфильтрационной анестезии выполнили межхрящевой разрез, на рану наложены 2 ранорасширителя во взаимоперпендикулярных плоскостях. Далее выполнили циркулярный разрез по передней стенке латеральнее рубцово-костного образования с 10 до 2 часов, после чего отсепаровали кожный лоскут при помощи микрораспатора. После удаления рубцовой ткани произведены продление циркулярного разреза до 7 часов и дальнейшая отсепаровка кожного лоскута. Моделирование передней стенки НСП было приостановлено в связи с близостью разросшихся мыщелкового отростка и головки нижней челюсти и возможностью повреждения височно-нижнечелюстного сустава. В ходе операции нами была использована высокоскоростная бормашина (Karl Storz, Германия) с фрезами различного диаметра. При постепенном высверливании костной атрезии верхней и задней стенок появился доступ в полость, оставшуюся от предыдущих операций, полностью заполненную холестеатомными массами. Произведена санация полости. Отсепарованный кожный лоскут расправлен, смоделирован под новые размеры НСП и уложен на его стенки (см. рис. 3б на цвет. вклейке). Лоскут фиксирован полосками медицинского силикона. Слуховой проход полностью затампонирован гемостатическими материалами: полосками Surgicel Ethicon, Johnson&Johnson и губкой Spiggle&Theis Medizin technic GmbH. При тампонировании губку пропитывали антибактериальными каплями, содержащими норфлоксацин (Нормакс).

а — вид до операции; б — вид санированной полости и смоделированного НСП.
Послеоперационный период протекал без особенностей. В первые сутки после операции была удалена марлевая турунда из преддверия НСП. В течение пребывания пациента в стационаре ежедневно дважды в день проводили туалет ушной раковины и НСП. Установленные гемостатические материалы позволяли избежать скопления кровяных сгустков в раннем послеоперационном периоде. Для предотвращения бактериального инфицирования раны проводили импрегнацию тампонады каплями Нормакс. Пациент быстро реабилитировался после оперативного вмешательства, вернулся к обычному образу жизни. Из-за повышенного риска осложнений, а также невозможности самостоятельного тщательного ухода за послеоперационной раной пациент находился под динамическим контролем в условиях стационара лор-отделения ЦКБ гражданской авиации в течение 17 дней (проводился мониторинг показателей крови, ежедневный туалет послеоперационной области), а затем был выписан на долечивание под амбулаторным наблюдением. В течение всего времени проводился тщательный уход за послеоперационной областью.
Через 3 нед после операции гемостатические материалы и полоски медицинского силикона были удалены. При осмотре: НСП проходим, полость контролируема во всех отделах, полностью эпителизирована.
Обсуждение
СП — чрезвычайно редкое, сложное заболевание, характеризующееся пятнистым или мозаичным постнатальным разрастанием различных тканей организма. Было установлено, что степень выраженности СП варьирует у разных людей и обычно в процесс вовлечены кожа, костная и соединительная ткань, жировая клетчатка, центральная нервная система, глаза, селезенка, тимус и толстая кишка [5]. Проявления, как правило, асимметричны, и местоположение проявлений значительно различается у пациентов. Все проявления можно разделить на 4 основные категории, а именно: опухоли мягких тканей, сосудистые аномалии, макродактилии и гистопатологические характеристики [6].
Точная причина возникновения СП остается полностью неизученной. Установлено, что соматический мозаицизм, лежащий в основе заболевания, развивается из определенных постзиготических мутаций. В частности, развитие СП связывают с мутациями, вызывающими дисфункцию пути фосфоинозитид-3-киназы (PI3K) — AKT (мутации фосфатазы и гомолога тензина (PTEN) и AKT1) [7]. Также следует отметить, что конститутивная активация фосфорилирования аномальной AKT1 лежит в основе онкопредрасположенности у этих пациентов [7].
Однако было установлено, что мутации PTEN и клинические характеристики, такие как сегментарное разрастание, липоматоз, артериовенозные мальформации и эпидермальные невусы, встречаются не только у пациентов с СП. Данные изменения также встречаются при синдромах Коудена и SOLAMEN (segmental overgrowth, lipomatosis, arteriovenous malformation and epidermal nevi /сегментарное разрастание, липоматоз, артериовенозные мальформации и эпидермальные невусы), что позволяет объединить эти 3 синдрома в один класс расстройств [8].
Еще одна особенность СП заключается в том, что избыточный рост после начала прогрессирования обычно происходит пугающе быстрыми темпами. Большинство пациентов с СП рождаются без значительной асимметрии, разрастание же тканей начинается в возрасте от 6 до 18 мес. Скорость чрезмерного роста такова, что пораженные части тела быстро становятся непропорциональными [2, 3].
Нарушение регуляции жировой ткани является одной из отличительных черт СП. В зарубежной литературе приводятся случаи как чрезмерного роста, так и атрофии жировых тканей. Многие пациенты с подтвержденным СП имели значительное локальное разрастание жировой ткани в области живота или конечностей одновременно с липоатрофией в других областях тела, чаще всего в грудной клетке [2].
Еще одним аспектом течения СП является психосоциальное воздействие на непосредственного носителя, его родственников и окружающих [2]. Патология является редким, иногда быстро прогрессирующим заболеванием, во многих случаях приводящим к социальной стигматизации. Наблюдаемый нами пациент живет в полной семье, имеет здорового брата, является студентом, таким образом, он интегрирован в общественную жизнь.
Данный клинический случай в практике врача-оториноларинголога можно считать довольно редким, поскольку лор-органы не так часто вовлекаются в процесс разрастания. Проведение хирургического лечения, как правило, осложняется отсутствием четких ориентиров из-за измененной анатомии, а также возможностью рецидива при продолжающемся росте тканей.
Авторы заявляют об отсутствии конфликта интересов.