Sodium dichromate что это
Дихромат натрия
| Дихромат натрия | |
 | |
 | |
| Общие | |
|---|---|
| Традиционные названия | динатриевая соль дихромовой кислоты, динатрий дихромат(VI) |
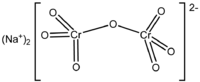
| Химическая формула | Na2Cr2O7 |
| Физические свойства | |
| Состояние (ст. усл.) | красные до оранжевых гигроскопичные кристаллы |
| Молярная масса | (ангидрид) 261.968 г/моль |
(дигидрат) около 100 °C
Дихрома́т на́трия (бихромат натрия, натриевый хромпик) — неорганическое химическое соединение, натриевая соль дихромовой кислоты. Существует дигидрат дихромата натрия( Na2Cr2O7·2H2O) и безводная соль.
Полупродукт в производстве хрома, практически вся хромовая руда перерабатывается в дихромат натрия.
Содержание
Свойства
Химические
С точки зрения реакционной способности и внешнего вида дихромат натрия и дихромат калия очень похожи. Соль натрия, однако, в двадцать раз лучше растворяется в воде, чем соль калия (49 г/л при 0 °C) и ее эквивалентная масса также меньше — поэтому она является наиболее часто используемым веществом.
Схожестью хромовой кислоты и дихромата натрия является их общее свойство — они являются окислителями. По отношению к калийной соли, основным преимуществом бихромата натрия является его большая растворимость в воде и в полярных растворителях, например таких как уксусная кислота.
В области органического синтеза это соединение окисляет бензилы и аллильную группу C—H соединений до карбонильных производных. Так, например, 2,4,6-тринитротолуол окисляется до соответствующих карбоновых солей. Кроме того, 2,3-диметинаптален (англ. 2,3-dimethylnaphthalene ) окисляется в присутствии Na2Cr2O7 до 2,3-напталендикарбоксилиновой кислоты (англ. 2,3-naphthalenedicarboxylic acid ).
Получение
Дихромат натрия образуется в больших масштабах из руд содержащих оксид хрома(III).
Сначала руду сплавляют, как правило, с карбонатом натрия при температуре около 1000 °C в присутствии воздуха (источник кислорода):
Использование
Используют при дублении кож и в электрических элементах.
Опасность применения
Как и все соединения шестивалентного хрома, дихромат натрия считается опасным. Кроме того, он известный канцероген. Вещество очень токсично для водных организмов, может вызвать долговременные изменения в водной экосистеме.
См. также
Ссылки
Полезное
Смотреть что такое «Дихромат натрия» в других словарях:
Дихромат аммония — Дихромат аммония … Википедия
Дихромат лития — Общие Систематическое наименование Дихромат лития Традиционные названия Бихромат лития; хромовокислый литий Химическая формула Li2Cr2O7 Физические свойства … Википедия
Дихромат рубидия — Общие Систематическое наименование Дихромат рубидия Традиционные названия Бихромат рубидия; двухромовокислый рубидий Химическая формула Rb2Cr2O7 Физические свойства … Википедия
Дихромат калия — У этого термина существуют и другие значения, см. хромпик. Дихромат калия … Википедия
Натрия фосфаты — Известны следующие фосфаты натрия: Дигидрофосфат натрия NaH2PO4 Гидрофосфат натрия Na2HPO4 Ортофосфат натрия Na3PO4 Применение Употребляются для буферных растворов различного назначения, как эмульгаторы в пищевой промышленности … Википедия
натрия дихромат — natrio dichromatas statusas T sritis chemija formulė Na₂Cr₂O₇ atitikmenys: angl. sodium dichromate rus. натрий двухромовокислый; натрия бихромат; натрия дихромат ryšiai: sinonimas – dinatrio μ okso( )heksaoksodichromatas … Chemijos terminų aiškinamasis žodynas
натрия бихромат — natrio dichromatas statusas T sritis chemija formulė Na₂Cr₂O₇ atitikmenys: angl. sodium dichromate rus. натрий двухромовокислый; натрия бихромат; натрия дихромат ryšiai: sinonimas – dinatrio μ okso( )heksaoksodichromatas … Chemijos terminų aiškinamasis žodynas
НАТРИЯ ХРОМАТ — Na2CrO4, желтые кристаллы; до 423 °С устойчива орторомбич. модификация ( а =0,717 нм, b= =0,924 нм, с= 0,588 нм, z =4, пространств. группа Pnmb), выше 423°С гексагональная; DH перехода 9,62 кДж/моль; т. пл. 794°С; плотн. 2,72 г/см 3;… … Химическая энциклопедия
Гексагидроксохромат (III) натрия — Общие Систематическое наименование Гексагидроксохромат (III) натрия Традиционные названия Гексагидроксохромит (III) натрия Химическая формула Na3[Сr(OH)6] Физические свойства … Википедия
Хромат натрия — Хромат натрия … Википедия
Дихромат натрия
298,00 г / моль (дигидрат)
СОДЕРЖАНИЕ
Производство [ править ]
Эта стадия растворяет хром и позволяет экстрагировать его в горячую воду. На этом этапе другие компоненты руды, такие как соединения алюминия и железа, плохо растворимы. Подкисление полученного водного экстракта серной кислотой или диоксидом углерода дает дихромат:
Дихромат выделяют кристаллизацией в виде дигидрата. Таким образом ежегодно производятся многие миллионы килограммов бихромата натрия.
Поскольку хром (VI) токсичен, особенно в виде пыли, на такие предприятия действуют строгие правила. Например, сточные воды таких нефтеперерабатывающих заводов обрабатываются восстановителями для возврата любого хрома (VI) в хром (III), который менее опасен для окружающей среды. [1] Известно множество гидратов этой соли, от декагидрата при температуре ниже 19,5 ° C (CAS № 13517-17-4 ) до гекса-, тетра- и дигидратов. При температуре выше 62 ° C эти соли самопроизвольно теряют воду с образованием безводного материала. Он кристаллизуется при температуре от 30 до 35 градусов по Цельсию.
Реакции [ править ]
Вторичные спирты окисляются до соответствующего кетона, например ментол до ментона ; [5] дигидрохолестерин в холестанон: [6]
По сравнению с калиевой солью, основным преимуществом дихромата натрия является его большая растворимость в воде и полярных растворителях, таких как уксусная кислота.
Безопасность [ править ]
Дихромат натрия
| Дихромат натрия | |
|---|---|
 | |
| Традиционные названия | динатриевая соль дихромовой кислоты, динатрий дихромат (VI) |
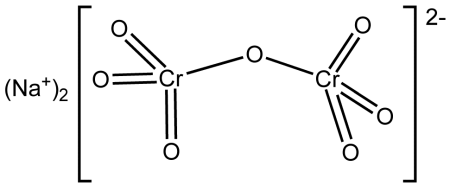
| Хим. формула | Na2Cr2O7 |
| Состояние | красные до оранжевых гигроскопичные кристаллы |
| Молярная масса | |
| Т. разл. | 400 °C |
| Энтальпия образования | −1962 кДж/моль |
| Растворимость в воде | (при 20 °C) 236 г/100 мл |
| Растворимость в остальных веществах | растворим в спирте |
| ГОСТ | ГОСТ 2651-78 |
| Рег. номер CAS | |
| Рег. номер EC | 234-190-3 |
| RTECS | HX7750000 (ангидрид, дигидрат) |
| ChEBI | 39483 |
| Номер ООН | 3288 |
| ChemSpider | 23723 |
| ЛД50 | 50 мг/кг |
| Токсичность |    |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Дихромат натрия (бихромат натрия, натриевый хромпик) — неорганическое химическое соединение, натриевая соль дихромовой кислоты. Существует дигидрат дихромата натрия (Na2Cr2O7·2H2O) и безводная соль.
Полупродукт в производстве хрома, практически вся хромовая руда перерабатывается в дихромат натрия.
Следует учитывать, что дихромат натрия очень токсичен.
Содержание
Свойства
Химические
С точки зрения реакционной способности и внешнего вида дихромат натрия и дихромат калия очень похожи. Соль натрия, однако, в двадцать раз лучше растворяется в воде, чем соль калия (49 г/л при 0 °C) и её эквивалентная масса также меньше — поэтому она является наиболее часто используемым веществом.
Схожестью хромовой кислоты и дихромата натрия является их общее свойство — они являются сильными окислителями. По отношению к калийной соли, основным преимуществом дихромата натрия является его большая растворимость в воде и в полярных растворителях, например таких как уксусная кислота.
В области органического синтеза это соединение окисляет бензилы и аллильную группу C—H соединений до карбонильных производных. Так, например, 2,4,6-тринитротолуол окисляется до соответствующих карбоновых солей. Кроме того, 2,3-диметилнафталин (англ. 2,3-dimethylnaphthalene ) окисляется в присутствии Na2Cr2O7 до 2,3-нафтилдикарбоновой кислоты (англ. 2,3-naphthalenedicarboxylic acid ).
Получение
Дихромат натрия образуется в больших масштабах из руд, содержащих оксид хрома III.
Сначала руду сплавляют, как правило, с карбонатом натрия при температуре около 1000 °C в присутствии воздуха (источник кислорода):
Использование
Используют при дублении кож и в электрических элементах, как компонент биозащитных составов для древесины.
Опасность применения
Как и все соединения шестивалентного хрома, дихромат натрия очень токсичен. Кроме того, он известный канцероген. Вещество очень токсично для водных организмов, может вызвать долговременные изменения в водной экосистеме.
Натрий двухромовокислый — основное сырье для производства хрома
Натрий двухромовокислый — неорганическое соединение, 
Получают бихромат натрия обработкой природного сырья — руды, содержащей окись хрома (III). В процессе производства руду сплавляют с карбонатом натрия, а потом полученное соединение хрома очищают от примесей, содержавшихся в руде. Следующий этап — окисление до соединения хрома (VI) с помощью водного раствора серной кислоты или двуокиси углерода.
Свойства
С точки зрения химии — сильный окислитель. Химические свойства сходны со свойствами калиевого хромпика, но натриевый хромпик гораздо лучше растворяется в воде. Взаимодействует с толуолом и его производными, со многими углеводородами.
 |  |  |
| Костюм «Л-1» с хранением | Натрий двухромовокислый (бихромат натрия) | Перчатки «Неотоп» химостойкие (Ansell) (9,5-10) |
Меры предосторожности
Как и все производные хрома (VI), натрий двухромовокислый очень ядовит как для людей, так и для окружающей среды. Обладает канцерогенным действием, мутаген, влияет на функцию воспроизводства. Особенно опасен для беременных, так как может нанести вред будущему ребенку. Пожаро- и взрывоопасен. Относится к 1-му классу опасности для человека. Вдыхание или проглатывание пыли или аэрозолей вещества вызывают тяжелые отравления, поражение органов дыхания и пищеварения, кожи. Воздействие на кожу или слизистые глаз может привести к химическим ожогам и плохо заживающим язвам.
Пострадавшего от контакта с бихроматом натрия следует вынести на свежий воздух, промыть место поражения, переодеть и тепло укрыть. Дать пить много воды или молока. Вызвать скорую помощь. Вызвать рвоту. Потом дать смесь из молока и яиц, жженую магнезию или активированный уголь.
На производствах, имеющих дело с натриевым хромпиком, следует предоставить работникам средства защиты от токсичной пыли или капель раствора (спецодежда, маслобензостойкие перчатки, защитные очки, противопылевые и противоаэрозольные респираторы/маски). К работе с веществом разрешается допускать только после прохождения инструктажа. Само рабочее помещение должно быть оборудовано принудительной вентиляцией, места пыления — местной вентиляцией; оборудование следует загерметизировать, пыль необходимо регулярно убирать.
Остатки реактива и тару из-под него утилизируют по правилам для опасных отходов. Требуется исключить его попадание в окружающую среду. Очистке должны подвергаться сточные воды и воздух, содержащий пыль и аэрозоли.
Хранят дихромат натрия в прохладных, сухих помещениях, отдельно от горючих материалов и сильных окислителей, вдали от источников тепла, открытого огня, потенциальных источников искр. Емкости для хранения (стальные барабаны, многослойные мешки) должны закрываться герметично.
Применение
• Сырье в химпроме для производства хрома и его производных. Большая часть добываемой хромовой руды перерабатывается в бихромат натрия, так как он является промежуточным продуктом между стадией хромовой руды и чистым хромом.
• Для изготовления минеральных пигментов, катализаторов, пассивирующих составов, антифризов для двигателей.
• В кожевенном деле для дубления кож и мехов.
• В текстильпроме для протравы тканей перед окраской.
• При изготовлении деталей электрических устройств.
• Входит в состав средств для защиты древесины от микроорганизмов и паразитов.
• Для очистки реактивов, ацетилена.
298,00 г / моль (дигидрат)
СОДЕРЖАНИЕ
Производство
Эта стадия растворяет хром и позволяет экстрагировать его в горячую воду. На этом этапе другие компоненты руды, такие как соединения алюминия и железа, плохо растворимы. Подкисление полученного водного экстракта серной кислотой или диоксидом углерода дает дихромат:
Дихромат выделяют кристаллизацией в виде дигидрата. Таким образом, ежегодно производятся многие миллионы килограммов бихромата натрия.
Поскольку хром (VI) токсичен, особенно в виде пыли, на такие предприятия действуют строгие правила. Например, сточные воды таких нефтеперерабатывающих заводов обрабатываются восстановителями для возврата любого хрома (VI) в хром (III), который менее опасен для окружающей среды. Известны различные гидраты этой соли, от декагидрата при температуре ниже 19,5 ° C (CAS # 13517-17-4 ) до гекса-, тетра- и дигидратов. При температуре выше 62 ° C эти соли самопроизвольно теряют воду с образованием безводного материала. Он кристаллизуется при температуре от 30 до 35 градусов по Цельсию.
Реакции
В области органического синтеза это соединение окисляет бензильные и аллильные связи C-H до карбонильных производных. Например, 2,4,6-тринитротолуол окисляется до соответствующей карбоновой кислоты. Аналогичным образом 2,3-диметилнафталин окисляется Na 2 Cr 2 O 7 до 2,3-нафталиндикарбоновой кислоты.
Вторичные спирты окисляются до соответствующего кетона, например ментол до ментона ; дигидрохолестерин в холестанон:
По сравнению с калиевой солью, основным преимуществом дихромата натрия является его большая растворимость в воде и полярных растворителях, таких как уксусная кислота.
Безопасность
- не удается продолжить выполнение кода поскольку система не обнаружила mfc110u dll
- Как выглядят щенки той терьера








