Streptococcus bovis что это такое
Стрептококки группы D
Рубрика МКБ-10: B95.2
Содержание
Определение и общие сведения [ править ]
Стрептококковые инфекции группы D
Из стрептококков группы D наиболее патогенен для человека Streptococcus bovis. Вызванный им эндокардит часто встречается на фоне новообразований желудочно-кишечного тракта – аденоматозного полипоза и рака толстой кишки. При тщательном обследовании новообразования желудочно-кишечного тракта обнаруживают у 60% больных.
Этиология и патогенез [ править ]
Клинические проявления [ править ]
Стрептококки группы D: Диагностика [ править ]
Желчно-эскулиновый тест используют для дифференциации Streptococcus bovis (группа D), которые растут на желчно-эскулинновом агаре. При росте на среде образуется темно-коричневые или черные пятна. Для постановки теста изучаемую культуру засевают на агаровую среду, содержащую 40% желчи, 0,1 % эскулина, 0,05% цитрата железа. Посевы инкубируют в течение 24-48 ч при 37 °C.
Дифференциальный диагноз [ править ]
Стрептококки группы D: Лечение [ править ]
Streptococcus bovis, как и другие представители группы D, не относящиеся к энтерококкам, чувствителен к пенициллинам. При инфекциях, вызванных Streptococcus bovis, достаточно монотерапии бензилпенициллином.
Профилактика [ править ]
Прочее [ править ]
К энтерококковой инфекции предрасполагают пожилой возраст, тяжелые заболевания, нарушения барьерной функции кожи и слизистых, подавление нормальной микрофлоры антибиотиками. Энтерококки часто вызывают инфекции мочевых путей, особенно у больных, получавших антибиотикотерапию и подвергавшихся инструментальным исследованиям мочевых путей. Инфекционный эндокардит, в том числе протезированных клапанов, в 10–20% случаев имеет энтерококковую этиологию. Обычно это подострый эндокардит, но возможен и острый, с быстрым разрушением клапанов. Энтерококки нередко высевают из желчи. Они служат причиной инфекционных осложнений операций на желчных путях и абсцессов печени. Энтерококки часто обнаруживают и при смешанных инфекциях – абсцессах брюшной полости, вызванных кишечной микрофлорой, инфицированных операционных ранах брюшной стенки, диабетической стопе. Такие смешанные инфекции часто излечиваются антимикробными препаратами, неактивными в отношении энтерококков. Однако, если энтерококки выделены из крови или преобладают в посеве из очага инфекции, необходимо использовать препараты, к которым они чувствительны.
Бензилпенициллин и ампициллин в концентрациях, создаваемых в крови и других тканях, практически не оказывают бактерицидного действия на энтерококки. При тяжелых энтерококковых инфекциях рекомендуется сочетать какой–либо из этих препаратов с аминогликозидом, поскольку in vitro эта комбинация обладает синергичным бактерицидным действием. Ампициллин достигает достаточно высоких концентраций в моче, поэтому его используют для монотерапии неосложненных инфекций мочевых путей. При остальных энтерококковых инфекциях к нему добавляют гентамицин (при нормальной функции почек – 1 мг/кг каждые 8 ч). При аллергии к пенициллинам ампициллин заменяют ванкомицином, назначая его также в сочетании с аминогликозидом. Цефалоспорины в отношении энтерококков неактивны.
При тяжелых энтерококковых инфекциях определяют чувствительность возбудителя и на ее основании выбирают схему антимикробной терапии. Большинство штаммов энтерококков устойчиво к стрептомицину. Не имея данных о чувствительности энтерококков, этот препарат при энтерококковой инфекции не используют. Распространена среди энтерококков и устойчивость к гентамицину (МПК более 2000 мкг/мл). Однако устойчивые к гентамицину штаммы энтерококков могут оказаться чувствительными к другим аминогликозидам, в том числе к стрептомицину. Если возбудитель устойчив ко всем аминогликозидам, может оказаться успешной монотерапия бензилпенициллином или ампициллином. Эндокардит, вызванный устойчивыми ко всем аминогликозидам энтерококками, рекомендуется лечить большими дозами ампициллина (12 г/сут) в течение как минимум 6 нед.
Развитие устойчивости энтерококков к пенициллинам опосредуется двумя различными механизмами. У многих штаммов Enterococcus faecalis описана устойчивость к бензилпенициллину и ампициллину за счет образования β–лактамаз. Так как энтерококки не всегда образуют β–лактамазы в количествах, достаточных для обнаружения их общепринятыми методами, при определении чувствительности выделенного штамма к антибиотикам нужно использовать пробу с нитроцефином (хромогенным цефалоспорином) или иную специальную методику. Если выделенный штамм энтерококков образует β–лактамазы, инфекцию лечат ванкомицином, ампициллином/сульбактамом, амоксициллином/клавуланатом или имипенемом/циластатином в сочетании с гентамицином.
Второй механизм не имеет ничего общего с образованием β–лактамаз и, по–видимому, представляет собой изменение структуры пенициллинсвязывающих белков. Данный тип устойчивости свойственен штаммам Enterococcus faecium. Эта бактерия вообще проявляет большую устойчивость к β–лактамным антибиотикам, чем Enterococcus faecalis. Умеренно устойчивые штаммы Enterococcus faecium (МПК бензилпенициллина и ампициллина в пределах 16–64 мкг/мл) in vivo могут оказаться чувствительными к высоким дозам этих препаратов в сочетании с гентамицином. На устойчивые штаммы Enterococcus faecium (МПК > 200 мкг/мл) не действуют никакие β–лактамные антибиотики, в том числе имипенем/циластатин. Если инфекция вызвана подобным возбудителем, назначают ванкомицин в сочетании с гентамицином.
Энтерококковые инфекции, устойчивые к ванкомицину
Энтерококки, устойчивые к ванкомицину, были впервые выделены у больных в 80–х гг. Сейчас они встречаются довольно часто.
Известны три типа устойчивости к ванкомицину; штаммы энтерококков, которым они свойственны, имеют фенотипы VanA, VanB и VanC. Для фенотипа VanA характерна устойчивость как к ванкомицину, так и к тейкопланину – еще одному гликопептиду. Для фенотипов VanB и VanC характерны устойчивость к ванкомицину и чувствительность к тейкопланину, но VanB обладает способностью приобретать устойчивость к тейкопланину во время лечения. Рекомендаций по лечению инфекций, вызванных устойчивыми и к ванкомицину, и к β–лактамным антибиотикам штаммами энтерококков, не существует. Иногда эффективны сочетания ципрофлоксацина с рифампицином и гентамицином, ампициллина с ванкомицином (особенно если in vitro они обладают синергичным бактериостатическим действием), а также хлорамфеникол и тетрациклин (если штамм чувствителен к ним in vitro).
Зеленящие стрептококки
Темой сегодняшнего разговора будет группа зеленящих стрептококков – наименование не очень легитимное, но прочно вошедшее в практику. Под наименованием «Зеленящие стрептококки или S.viridans» прячется целая группа микроорганизмов, относящихся к альфа-зеленящим стрептококкам семейства Streptococcaceae.
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой сегодняшнего разговора будет группа зеленящих стрептококков – наименование не очень легитимное, но прочно вошедшее в практику, как и обзывательство антибактериальной терапии – антибиотикотерапией, а кто мы такие, чтобы отменять традиции.
Под наименованием «Зеленящие стрептококки или S.viridans» прячется целая группа микроорганизмов, относящихся к альфа-зеленящим стрептококкам семейства Streptococcaceae. Эта группа является очень важным компонентом в составе нормально микрофлоры полости рта, слизистых оболочек дыхательных путей, пищеварительного тракта и половых органов. Поэтому обнаружив следующих ее представителей (S.gordonii, S.oralis, S. mutants, S.sanguis и S.salivarius) в посеве из полости рта, не надо немедленно начинать это лечить – этим вы только навредите организму, выбив из его состава важный компонент его нормальной микрофлоры.
Рассмотрим основных представителей семейства, на которых больше всего шансов наткнуться в антибиотикограммах.
Диагностические аспекты
Освоив вышеприведенный материал, мы видим, что только обнаружение данных микроорганизмов в стерильных средах может указывать на них как на потенциальных возбудителей. Почему все-таки потенциальных? Да потому, что в 80% случаев это может оказаться банальной контаминацией в связи с несоблюдением техники забора материала (все мы дышим, и если материал забирается с нарушением правил асептики и антисептики и без использования закрытых систем, то налететь в пробирку может много чего и не только из наших рта и носов). Таким образом, посевы нужно повторять.
Обнаружение этого же зоопарка в местах естественного его обитания не говорит нам практически ничего, если только пациент совсем не следит за полостью рта, и тогда ему можно настоятельно рекомендовать посещение стоматолога.
Аспекты антибактериальной терапии
Группа зеленящих стрептококков природно резистентна к тетрациклинам, макролидам и клиндомицину (до 50% штаммов), к биссептолу резистентно более 75%. Таким образом об этих группах мы даже не вспоминаем.
Само лечение должно быть комплексным и часто в сочетании с хирургическим. Выбор конкретных препаратов будет зависеть от локализации процесса, тяжести состояния пациента и выделенного возбудителя
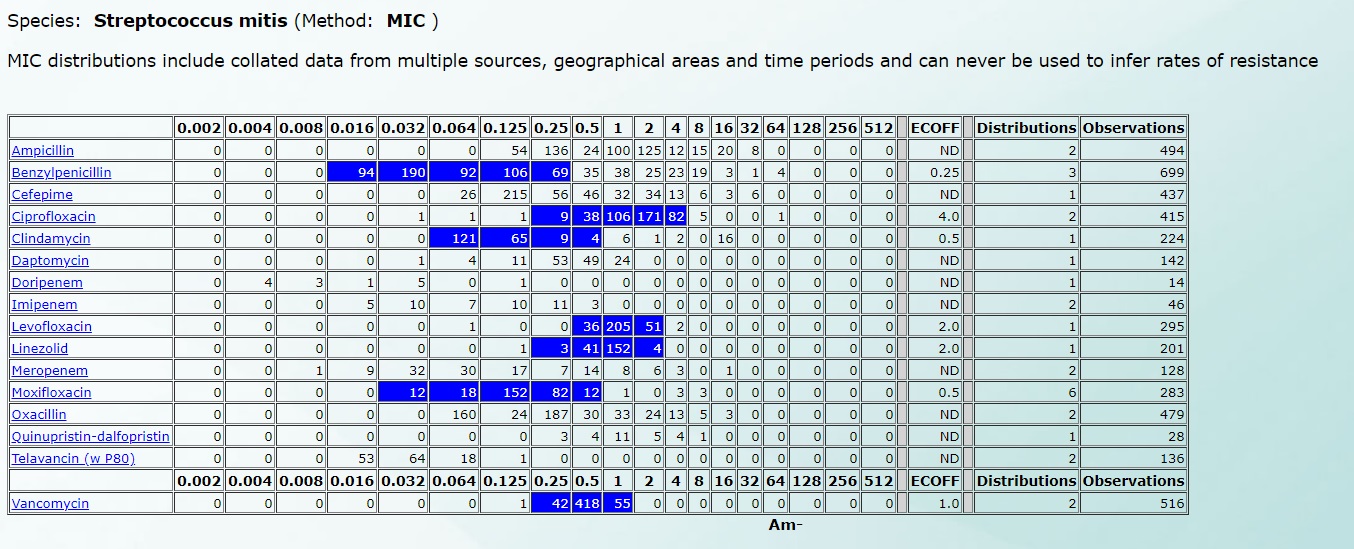
Например, чувствительность Streptococcus mitis будет выглядеть так (нажмите на картинку для увеличения):
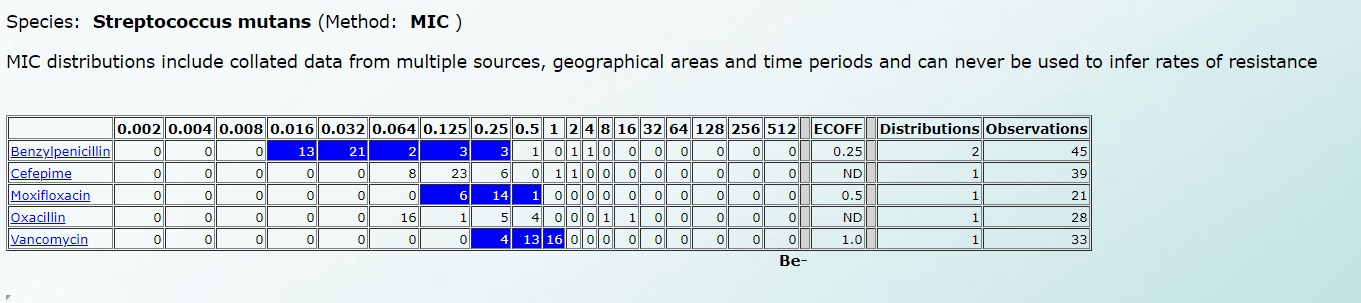
А чувствительность к Streptococcus mutans – вот так (нажмите на картинку для увеличения):
Подробнее все рассмотреть можно по этой ссылке, ведь именно на этой базе данных работают автоматические и полуавтоматические анализаторы в микробиологических лабораториях.
Препаратами выбора будут являться:
Как и в случае с любым стрептококком, крайне важно соблюдать длительность лечения, и она должна быть не менее 10-14 дней. Исключение составляет бактериальный эндокардит, там сроки лечения как минимум удваиваются.
В заключение хотелось бы сказать, что как ни прискорбно это сознавать, но недоступность, в первую очередь финансовая, адекватной стоматологической помощи вновь привела к всплеску заболеваний связанных с неблагополучием в полости рта, таким образом, мы вновь вынуждены вспоминать, что инфекционный эндокардит – это не только болезнь наркоманов и лиц со сниженным иммунным статусом, но и тех, у кого недостаточно средств на хорошего стоматолога, а потому и нам не лишне иногда осматривать полость рта у пациентов с инфекциями кровотока или абсцессами в головном мозге или печени.
Роль стрептококка в возникновении новообразований
Проблема онкологических заболеваний является приоритетной для современного общества. По причине смерти онкологические заболевания занимают третье место после болезней сердечнососудистой системы и травм. По данным ВОЗ, ежегодно регистрируют более 6 млн. вновь заболевших людей онкологическими заболеваниями
На протяжении 90-х годов ежегодно от рака в мире умирало 8 млн человек. По прогнозам ВОЗ с 1999 года по 2020 год заболеваемость онкологическими заболеваниями и смертность возрастут в 2 раза: с 10 до 20 млн. новых случаев и с 6 до 12 млн. регистрируемых смертей [1].
Рак — это более 100 различных разновидностей этой болезни, поражающих почти все ткани организма, но при этом у всех его видов есть общие черты.
В соответствии с современной полиэтиологической теорией при развитии разных видов новообразований выделяют следующие причины опухолевой трансформации клеток:
Особенность полиэтиологической теории в том, что само воздействие внешних канцерогенных факторов не вызывает развития новообразования. Для возникновения опухоли необходимо наличие и внутренних причин: генетической предрасположенности и определённого состояния иммунной и нейрогуморальной систем.
Прорывом в изучении онкологических заболеваний в последние годы стало открытие взаимосвязи между наличием определенных видов микробов и развитием рака в организме человека, других животных или в тканях растений.
Наличие бактерий Streptococcus gallolyticus gallolyticus [SGG] (новое название S. Bovis) и Heliobacter pylori обнаружили практически во всех опухолях прямой кишки и желудка человека. На корнях растений часто появляются опухоли благодаря их заражению микробами Agrobacterium tumefaciens и десятком других бактерий [2].
Большинство типов рака толстой кишки, как правило, вызваны инфекцией, находящейся в бактериях, живущих в организме коров. На протяжении многих десятилетий было известно, что иногда в опухолях при данном виде рака обнаруживается Streptococcus gallolyticus gallolyticus (SGG). Однако недавнее исследование показало, что данный тип бактерий напрямую вызывает рост опухоли в организме лабораторных мышей, сообщает New Scientist.
Ранее развитие рака толстой кишки, являющегося третьим по степени распространенности, например, в Великобритании, связывали с диетическим фактором: чрезмерное употребление в пищу красного переработанного мяса или недостаток клетчатки. Однако исследователям не давал покоя один вопрос: играют ли бактерии SGG какую-либо роль при росте опухоли?
Чтобы проверить это, ученая И Сюй (Yi Xu) и команда исследователей из Научного центра здоровья в Техасе заразили лабораторных мышей, склонных к раку толстой кишки, бактерией SGG. В результате, размер опухоли у этих мышей в два раза превышал размер опухолей у других лабораторных моделей, которых заразили другими бактериями.
Ученые также обнаружили, что клетки рака толстой кишки, взятые у людей и выращенные в чашке Петри, размножались быстрее в присутствии SGG. «Каким-то образом бактерия стимулирует выработку веществ, необходимых для размножения клеток», — поделилась И Сюй.
А когда команда проанализировала образцы опухолей, взятых у людей, страдающих от рака толстой кишки, исследователи выявили, что в 74% случаев присутствовала бактерия SGG, а в 26% — в огромных количествах.
До сих пор неизвестно, ответственна ли бактерия за проявление мутации, вызывающей рост опухоли, однако, по словам И Сюй SGG способна ускорить рост уже существующих небольших новообразований. В своем следующем исследовании ученая планирует заразить бактерией мышей, не склонных к развитию рака толстой кишки. Если удастся подтвердить роль бактерии в образовании опухолей, то в будущем рак толстой кишки можно будет лечить при помощи антибиотиков, или вообще создать от него вакцину.
Считается, что от 2% до 8% здоровых людей являются носителями SGG. Пока точно неизвестно, как происходит заражение, однако бактерия может поражать организм коров. Исследования показали, что риск заражения в сельской местности в 6 раз выше, чем в городской среде.
SGG иногда вызывает инфекцию сердечного клапана (инфекционный эндокардит), поэтому врачи часто рекомендуют пациентам проверяться на наличие рака толстой кишки. Ранее одно из исследований показало, что у половины людей, страдающих от инфекционного эндокардита, имелся не диагностированный рак толстой кишки [3,4].
Что же представляет собой стрептококк?
Стрептококк (лат. Streptococcus) – это бактерия шарообразной или яйцеподобной формы, принадлежащая к семейству Стрептококковые (Streptococcaceae). Из-за этой формы они и получили свое название.
Стрептококки являются анаэробными паразитами не только человека, но и животных. Местом обитания и размножения стрептококковой инфекции являются органы дыхания, желудочно-кишечного тракта и мочеполовой системы мужчин и женщин, может находиться на коже. Преобладающее же количество бактерий стрептококка обычно оседает в носу, ротовой полости, горле и толстом кишечнике.
В природе, данный вид бактерий также существует в земле, на поверхности растений, грибов.
Стрептококк представляет собой типичные клетки, диаметр которых составляет менее 1 мкм, располагающиеся попарно или цепочками, образуя вытянутую палочку с утолщениями и утончениями, по форме напоминающую бусинки, нанизанные на цепочку.
Стрептококковые клетки образуют капсулу, и способны легко превратиться в L-форму. Бактерии неподвижны, за исключением штаммов группы D. Активное размножение происходит при контакте с частичками крови, асцитической жидкости или углеводами. Благоприятная температура для нормальной жизнедеятельности инфекции +37°С, кислотно-щелочной баланс (рН) – 7,2-7,4. Живут стрептококки преимущественно колониями, образуя как бы сероватый налет. Перерабатывают (ферментируют) углеводы, образовывая кислоту, расщепляют аргинин и серин (аминокислоты), в питательной среде синтезируют такие внеклеточные вещества, как — стрептокиназа, стрептодорназа, стрептолизины, бактериоцины и лейкоцидин [5].
Стрептококковая инфекция является условно-патогенной микрофлорой, — она практически всегда присутствует в организме человека и не несет в себе какую-либо опасность, поскольку ее количество и пребывание в человеке контролирует иммунная система.
Streptococcus gallolyticus gallolyticus SGG (S. Bovis) – неподвижная, неспорообразующая, грамположительная бактерия молочной кислоты, которая растёт как пары или цепи кокков. Это — член стрептококков группы D Лэнсефилда,
Главный портал входа для человеческой инфекции S. bovis бактериемия является желудочно-кишечным трактом, но в некоторых случаях вход через мочевые пути, гепатобилиарное дерево или ротоглотку.
Учитывая, что в развитых странах наблюдается тенденция к замедлению роста заболеваемости и снижение смертности от новообразований (как за счет профилактики, так и за счет улучшения ранней диагностики и лечения), то понятно, что основной прирост придется на развивающиеся страны, к которым относится и Беларусь. К сожалению, в Беларуси следует ожидать серьезное увеличение, как заболеваемости, так и смертности от рака. Это прогноз, подтверждаемый данными об основных причинах возникновения злокачественных опухолей.
Литература
Главная картинка взята с сайта по ссылке.

© Галина Леферд, научный сотрудник лаборатории радиоэкологии
Стрептококки группы А (за исключением S. pyogenes), C, D, F и G
В этой статье мы поговорим о более сложных темах на примерах тех представителей микробного мира, которые в большинстве случаев являются нашими добрыми соседями и очень редко, при очень специфических условиях, вызывают заболевания. Но так как лаборатории, особенно оснащенные автоматизированными системами детекции, все это определяют и буквально вываливают на врачей, ориентироваться и в этом море информации все-таки необходимо.
Автор: Трубачева Е.С., врач – клинический фармаколог
Почему за исключением S. pyogenes? Да потому что данного возбудителя мы рассмотрели в отдельной статье. Кроме того, мы уже говорим практически на одном языке, а потому можем себе позволить поговорить о более сложных темах на примерах тех представителей микробного мира, которые в большинстве случаев являются нашими добрыми соседями и очень редко, при очень специфических условиях, вызывают заболевания. Но так как лаборатории, особенно оснащенные автоматизированными системами детекции, все это определяют и буквально вываливают на врачей, ориентироваться и в этом море информации все-таки необходимо.
Микробиологические аспекты
Для начала разберемся с классификациями, чтобы понимать принципы разнесения стрептококков по группам. Так сложилось, что для классификации стрептококков используются их фенотипические характеристики, а именно характеристики по гемолитическим свойствам:
Собственно, почему кровь? Дело в том, что стрептококки крайне требовательны к питательным средам и к условиям, в которых их растят. И чтобы они выросли, в питательные среды (в основном, жидкие) необходимо или добавлять мясной экстракт, или использовать коммерческие питательные среды с добавлением крови барана, или 5%-й кровяной агар — и все это с большим количеством дополнительных компонентов. Для определения характера гемолиза традиционно используется среда с 5%-й дефибринированной кровью барана.
Подобное разделение по группам и типам гемолиза является решающим для деления стрептококков, имеющих медицинское значение, позволяя разделить патогенные и условно-патогенные микроорганизмы. Про патогенные мы уже поговорили ранее, теперь будем вести разговор о более обширной группе условно-патогенных представителей и начнем со стрептококков групп A, C, D и F, оставив для отдельного разговора группу В и единственного ее представителя — S. agalactiae.
Основными характеристиками представителей этих групп является то, что все они:
Еще одним общим, и, что главное, клинически значимым свойством является то, что стрептококки могут вырабатывать внеклеточные вещества, которые обладают антигенной активностью и играют важную роль в развитии стрептококковых инфекций. Подробнее с характеристикой таких веществ можно ознакомиться в книге «Иммунология» А. Ройта (так как там все описано чрезвычайно просто и наглядно, чего никак не хватает нашим авторам), здесь же мы кратко укажем основных из них:
Кроме того, стрептококки имеют такой фактор патогенности, как М-протеин, который нарушает фагоцитарную активность путем маскировки рецепторов для комплемента, что очень затрудняет борьбу с этими возбудителями.
Помимо всего прочего стрептококки довольно активно умеют отбиваться от факторов внешней среды. Например, в условиях глубокой заморозки они способны сохранять жизнеспособность в течение нескольких лет, в биологических жидкостях и их высушенных каплях — несколько месяцев. Нагревание их тоже не особо впечатляет: для их гибели требуется нагревание до 56-70 °C и от 30 минут до 1 часа экспозиции (в зависимости от групповой принадлежности). Рассеянный солнечный свет и температура комфорта человека в 18–24 градуса обеспечивает им длительную и беспроблемную жизнь. Даже лабораторные дезсредства могут справиться с ними только через 20 минут. А что там нам обещает реклама всяких «домашних» антибактериальных бытовых химий? Вот-вот — смешно, ничего кроме очередного вида устойчивости для такой мирно-соседствующей микрофлоры там не выйдет, а потом, не приведи чего, все это «счастье» приедет в наши стационары, если «сосед» вздумает вызвать какое-то заболевание. И это повод поговорить об этих соседях более подробно.
Клинические аспекты
1. Streptococcus dysgalactiae — объединяет двух представителей Streptococcus dysgalactiae subsp. dysgalactiae и Streptococcus dysgalactiae subsp. equisimilis. Первый живет на животных (и вызывает маститы у коров, на человеке в качестве возбудителя пока не ловили), второй на человеке — в верхних дыхательных путях и влагалище — и может быть причиной менингита, септических артритов и инфекций кожи (при условии наличия соответствующей симптоматики и в отсутствии других вероятных возбудителей).
2. Стрептококки группы Anginosus (S. anginosus, S. constellatus, S. intermedius) относятся к представителям нормальной флоры человека. Обрести зубы и стать возбудителями инфекции их могут заставить травмы, оперативные вмешательства, сахарный диабет, онкологические заболевания и иммунодефициты различной этиологии. Сами по себе на человека не бросаются и обнаружение оных вне клинической картины истребления не требует.
S.anginosus — в норме обитает в полости рта, верхних дыхательных путях и влагалище. При патологии может быть высеян из урогенитальной и желудочно-кишечной локализаций.
S. constellatus — в норме живет в верхних дыхательных путях и ЖКТ. При патологических процессах могут быть обнаружены где угодно.
S. intermedius — в норме обитает в полости рта и верхних дыхательных путях. При патологических процессах в основном высевается из мозга, из крови при эндокардитах и из печеночных абсцессов (проще говоря оттуда, где в норме все должно быть стерильно).
3. S. equi клинического значения не имеет, так как является зоонозом и вызывает ветеринарные проблемы у коров, лошадей, морских свинок, овец и коз. Иногда — при употреблении зараженных молочных продуктов — может быть обнаружен у людей, больных нефритом.
4. S. canis, как понятно из названия, выделяют от собак. У людей могут вызывать инфекции мягких тканей, пневмонии, сепсис, остеомиелит.
5. S. iniae — обнаруживается у дельфинов и рыб. А также у людей, занятых на обработке замороженной рыбы. Крайне редко вызывает заболевание (описаны всего несколько случаев), хорошо лечится бета-лактамами и макролидами.
6. И несколько чисто зоонозных представителей, не имеющих медицинского значения, но иногда сеющихся с людей, которые за этими животными ухаживают или лечат:
Как мы увидели, в большинстве своем перечисленные возбудители относятся к нормальной микрофлоре верхних дыхательных путей, кожи, ЖКТ и урогенитального тракта, а чтобы они вызвали заболевание, во внутреннюю среду организма должно проникнуть очень большое количество оных, при этом иммунная система должна быть подавлена тем или иным образом. Чаще всего такую роль играют медицинские вмешательства (инъекции, операции, катетеризация сосудов, гемодиализ и т. п.) на фоне тяжелых основных или сопутствующих заболеваний. Тогда стрептококки способны вызвать инфекции кожи и мягких тканей, верхних дыхательных путей, эндокардиты и сепсис, инфекции урогенитального тракта, при этом строгой локализации процесса соответствующим возбудителем уже не будет, а будет инфекция, связанная с медицинским вмешательством.
Что делать?
Как можно раньше провести бактериологическую диагностику и главным в ней будет правильная техника взятия биологического материала, чтобы точно исключить его контаминацию ни в чем не повинными мирными соседями, просмотрев истинного возбудителя. Техника взятия материала и правила транспортировки в лабораторию подробно расписаны здесь.
Чем лечить?
Этот вопрос мы можем задать только тогда, когда точно понимаем, что именно вышеуказанные зверушки являются возбудителями и никто за ними не прячется. Хорошая новость в том, что стрептококки до сих пор сохранили высокую чувствительность к бета-лактамам вообще и к пенициллинам в частности, то есть лечить их дешево. Плохая новость в том, что фактически утеряна чувствительность к макролидам, и поэтому они не могут быть препаратами выбора — это обязательно надо учитывать при назначении стартовой терапии.
Кроме того, стрептококки продолжают демонстрировать высокую чувствительность к ванкомицину, но в виду неоднозначности самого препарата в плане безопасности его применения, им тоже не следует злоупотреблять и включать его в схему лечения только в случае наличия аллергии к пенициллиновому ряду.
Итак, мы закончили краткое рассмотрение представителей стрептококков групп A, C, D, F и G, и нам осталось рассмотреть только одного представителя из группы В, а именно S.agalactiae, чем мы и займемся в следующей статье.