V t const что за формула
V t const что за формула
| Законы идеальных газов |   |
| В XVII – XIX веках были сформулированы опытные законы идеальных газов. Кратко напомним их. Изопроцессы идеального газа – процессы, при которых один из параметров остаётся неизменным. 1. Изохорический процесс. Закон Шарля. V = const. Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа при этом изохорическом процессе подчиняется закону Шарля: При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т = const. График изохорического процесса на РV-диаграмме называется изохорой. Полезно знать график изохорического процесса на РТ— и VT-диаграммах (рис. 1.6). Уравнение изохоры: Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака: При постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const. График изобарического процесса на VT-диаграмме называется изобарой. Полезно знать графики изобарического процесса на РV— и РT-диаграммах (рис. 1.8). Изотермическим процессом называется процесс, протекающий при постоянной температуре Т. Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта: При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const. График изотермического процесса на РV-диаграмме называется изотермой. Полезно знать графики изотермического процесса на VT— и РT-диаграммах (рис. 1.10). Адиабатический процесс – термодинамический процесс, происходящий без теплообмена с окружающей средой. 5. Политропический процесс. Процесс, при котором теплоёмкость газа остаётся постоянной. Политропический процесс – общий случай всех перечисленных выше процессов. 6. Закон Авогадро. При одинаковых давлениях и одинаковых температурах, в равных объёмах различных идеальных газов содержится одинаковое число молекул. В одном моле различных веществ содержится NA=6,02·10 23 молекул (число Авогадро). 7. Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных давлений Р, входящих в неё газов: При В соответствии с законами Бойля – Мариотта (1.4.5) и Гей-Люссака (1.4.3) можно сделать заключение, что для данной массы газа Уравнение Клапейрона-МенделееваЧто такое уравнение Клапейрона-МенделееваИдеальный газ — это газ, в котором пренебрегают взаимодействием молекул газа между собой. Идеальными считают разреженные газы. Особенно близкими к идеальным считают гелий и водород. Идеальный газ — это упрощенная математическая модель, которая широко применяется для описания свойств и поведения реальных газов при атмосферном давлении и комнатной температуре. Давление, объем и температура — это основные параметры состояния системы, и они связаны друг с другом. Соотношение, при котором определяется данная связь, называется уравнением состояния данного газа. Существует эквивалентная макроскопическая формулировка идеального газа — это такой газ, который одновременно будет подчиняться закону Бойля-Мариотта и Гей-Люссака, то есть: В представленном выше уравнении состоянии газа под const подразумевается количество молей. Свойства классического и квазиклассического идеального газа описываются уравнением состояния идеального газа, которое называется уравнением Менделеева-Клапейрона, ниже представлена формула Менделеева-Клапейрона. Таким образом давление и объем прямо пропорциональны количеству молей и температуре. Также уравнение Клапейрона-Менделеева можно записать в ином виде: Какое значение имеет универсальная газовая постояннаяУниверсальная газовая постоянная (R) — это величина, которая является константой, численно равная работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 K. Постоянную Больцмана используют в формулах, описывающих изучаемое явление или поведение рассматриваемого объекта с микроскопической точки зрения, тогда как универсальная газовая постоянная более удобна при расчетах, касающихся макроскопических систем, когда число частиц задано в молях. Связь с другими законами состояния идеального газаС помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса и один трех макропараметров (давление, температура или объем) — остаются неизменными. Количественные зависимости между двумя параметрами газа при фиксированном третьем параметре называют газовыми законами, которые связывают эти параметры. Изопроцессы — это термодинамические процессы, во время протекания которых количество вещества и один из макропараметров состояния: давление, объем, температура или энтропия — остается неизменным. В зависимости от того, какой параметр остается неизменным различают разные процессы, которые выражаются законами, являющимися следствием уравнения состояния газа: Изотермический процесс (T=const)Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим. Для поддержания температуры газа постоянной необходимо, чтобы он мог обмениваться теплотой с большой системой — термостатом. Им может служить атмосферный воздух, если температура его заметно не меняется на протяжении всего процесса. Согласно уравнению Клапейрона-Менделеева, в любом состоянии с неизменной температурой произведение давления газа на объем одно и то же, то есть постоянно: Этот закон был открыт экспериментально английским ученым Бойлем и несколько позднее французским ученым Мариоттом. Именно поэтому он называется закон Бойля-Мариотта. Закон Бойля-Мариотта справедлив для любых газов, а также для смеси газов (например, для воздуха). Зависимость давления газа от объема при постоянной температуре изображается графической кривой — изотермой. Изотерма для различных температур представлена в координатах pV на рис.1. и представляет собой гиперболу. Рис.1. Изотерма в pV — координатах. Изохорный процесс (V=const)Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным. Из уравнения состояния следует, что отношение давлений газа данной массы при постоянно объеме равно отношению его абсолютных температур: Газовый закон был установлен экспериментально в 1787 г. французским физиком Ж. Шарлем и носит название закона Шарля: давление данной массы газа при постоянном объеме прямо пропорционально абсолютной температуре. Так, если в качестве одного из состояний газа выбрать состояние газа при нормальных условиях, тогда p = p 0 T T 0 = p 0 γ T Коэффициент γ называют температурным коэффициентом давления газа. Он одинаков для всех газов. Зависимость давления газа от температуры при постоянном объеме изображается графически прямой, которая называется изохорой (Рис.2). Рис.2 Изображение изохоры в pT-координатах. Изобарный процесс (p=const)Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным. Из уравнения Клапейрона-Менделеева вытекает, что отношение объемов газа данной массы при постоянном давлении равно отношению его абсолютных температур. Если в качестве второго состояния газа выбрать состояние при нормальных условиях (нормальном атмосферном давлении, температуре таяния льда) следует: V = V 0 T T 0 = V 0 α T Этот газовый закон был установлен экспериментально в 1802 г французским ученым Гей-Люссаком. Закон Гей-Люссака: объем данной массы газа при постоянном давлении прямо пропорционален абсолютной температуре. Коэффициент α называют температурным коэффициентом объемного расширения газов. Зависимость объема газа от температуры при постоянном давлении изображается графической прямой, которая называется изобарой (Рис.3). Рис. 3. Изобара в VT-координатах. Использование универсального уравнения для решения задачиВ реальности проводятся различные физико-химические процессы. Рассмотрим каким образом уравнение состояния идеального газа и законы, связанные с ним находят применение для решения физических и химических задач. Так как в уравнении даны объем и температура — два из трех макроскопических параметров, а третий (давление) нужно определить, то мы можем использовать уравнение Клапейрона-Менделеева: p V = n R T = m M R T Не забываем перевести температуру в Кельвины: T = t + 273 = 27 + 273 = 300 K Молярная масса кислорода известна из таблицы Менделеева: Выразим из уравнения состояния давления и поставим все имеющиеся данные: Используем уравнение Менделеева-Клапейрона, из которого выражаем объем кислорода, который нужно найти: p = n R T V = m R T M V Молярная масса кислорода предполагается равной: M ( O 2 ) = 2 * 16 = 32 г / м 3 Не забываем перевести температуру в Кельвины: T = t + 273 = 20 + 273 = 293 K Переводим давление: p = 15680000 Па Выражаем из уравнения Клапейрона-Менделеева объем и подставляем значения, данные в условиях задачи: Согласно уравнению Менделеева-Клапейрона: p = n R T V = m R T M V Плотность — это величина, характеризующая массу некоторого объема и находится по формуле: ρ = m V и л и V = m ρ Тогда p m ρ = n R T = m R T M Откуда выражаем плотность газа: Для водорода эта формула запишется следующим образом: ρ H 2 = p M H 2 R T По условию задачи водород и любой другой газ находятся при одинаковых условиях, откуда следует, что: ρ H 2 M H 2 = p R T Поставим последнее выражение в выражение для плотности любого газа: Молярная масса водорода, исходя из таблицы Менделеева равна 2 г/моль и тогда. Молекулярная масса численно равная молярной и представляет собой массу молекулы в атомных единицах, поэтому в дальнейшем мы совершили переход к молекулярной массе. Рассмотрим несколько задач на законы, связанные с уравнение Клапейрона-Менделеева, то есть на изотермические, изохорные, изобарные процессы. При уменьшении давления газа в 2,5 раза его объем увеличился на 12 л. Какой объем занимал газ в начальном состоянии, если температура на протяжении всего процесса оставалась постоянной? По условию задачи температура в ходе всего процесса оставалась постоянной, откуда следует, что у нас изотермический процесс, и мы можем воспользоваться для решения законом Бойля-Мариотта. Откуда можем найти начальный объем: Ответ: первоначальный объем газа был равен 8 л. Газ находится в баллоне при температуре 400 К. До какой температуры нужно нагреть газ, чтобы его давление увеличилось в 1,5 раза? Так как нагревание газа по условиям данной задачи происходит при постоянном объеме, значит перед нами изохорный процесс. При изохорном процессе: При 27°C объем газа равен 600 мл. Какой объем займет газ при 57°C, если давление будет оставаться постоянным? Так как давление по условию остается постоянным, то можем использовать закон Гей-Люссака. V_2 – искомый объем Для правильного расчета необходимо перевести температуры из Цельсий в Кельвины: T 1 = 273 + 27 = 300 K T 2 = 273 + 57 = 330 K V 2 = ( 600 * 330 ) / 300 = 660 м л Так как по условию задания давления газа не изменяется, значит перед нами изобарный процесс. Для решения воспользуемся законом Гей-Люссака: Перейдем к абсолютной температуре: T 1 = 1150 + 273 = 1423 K T 2 = 200 + 273 = 473 K Масса газа: m = ρ 1 V 1 = ρ 2 V 2 Использование этих формул приводит к следующему: V t const что за формулагде NА — число Авогадро, k — постоянная Больцмана. Такие процессы называют изопроцессами. Законы, описывающие изопроцессы, были открыты задолго до теоретического вывода уравнения состояния идеального газа. V= const => p/T = const — закон Шарля Сначала найдем, сколько альфа-частиц (то есть атомов гелия) образовалось за один год. Обозначим это число как N атомов: N = 3,7·10 10 · 0,5 г · 60 сек · 60 мин · 24 час · 365 дней = 5,83·10 17 атомов. Запишем уравнение Клапейрона-Менделеева PV = nRT и заметим, что число молей гелия n = N/NA. Отсюда: В начале XX века этот способ определения постоянной Авогадро был самым точным. Но почему так долго (в течение года) длился эксперимент? Дело в том, что радий добывается очень трудно. При его малом количестве (0,5 г) радиоактивный распад этого элемента дает очень мало гелия. А чем меньше газа в замкнутом сосуде, тем меньшее он создаст давление и тем большей будет ошибка измерения. Понятно, что ощутимое количество гелия может образоваться из радия только за достаточно долгое время. Объединенный газовый закон и изопроцессытеория по физике 🧲 молекулярная физика, МКТ, газовые законыОбъединенный газовый закон был открыт экспериментально. Он также является следствием основного уравнения состояния идеального газа. Согласно ему: При постоянной массе газа и его неизменной молярной массе отношение произведения давления на объем к его абсолютной температуре остается величиной постоянной: Объединенный газовый закон применительно к изопроцессамОбъединенный газовый закон объединяет три независимых газовых закона: Бойля — Мариотта, Шарля и Гей-Люссака. Газовые законы действуют в частных случаях — изопроцессах. Изопроцессы — термодинамические процессы, во время которых количество вещества и один из параметров состояния: давление, объём, температура или энтропия — остаётся неизменным. Изотермический процесс. Закон Бойля — Мариотта.Изотермический процесс — термодинамический процесс, происходящий в системе при постоянной температуре и массе: Для изотермического процесса действует закон Бойля — Мариотта: Закон Бойля — Мариотта Для газа данной массы произведение газа на его объем постоянно, если температура газа не меняется. Изохорный процесс. Закон Шарля.Изохорный процесс — термодинамический процесс, происходящий в системе при постоянном объеме и массе: Для изохорного процесса действует закон Шарля: Для газа данной массы отношение давления к температуре постоянно, если объем не меняется. Изобарный процесс. Закон Гей-Люссака.Изобарный процесс — термодинамический процесс, происходящий в системе при постоянном давлении и массе: Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется. Пример №1. Идеальный газ изобарно нагревают так, что его температура изменяется на ∆T = 240 К, а давление — в 1,6 раза. Масса газа постоянна. Найдите начальную температуру газа по шкале Кельвина. Так как газ нагревают, то: Запишем закон Шарля применительно к данному случаю: Сделаем некоторые преобразования и вычислим начальную температуру: Подсказки к задачам на газовые законы
|

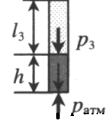
 , давление смеси газов:
, давление смеси газов:





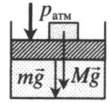
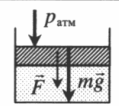
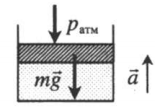
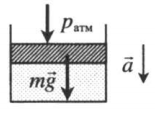
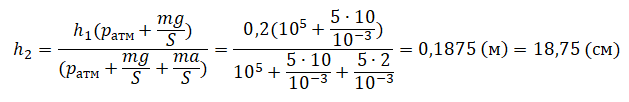
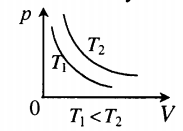
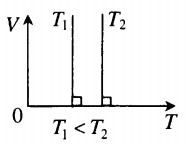
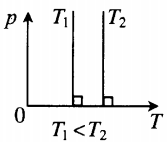
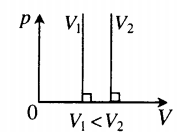
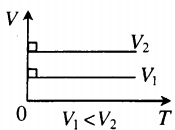
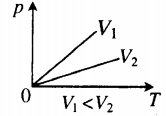
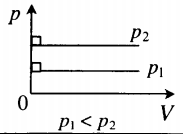
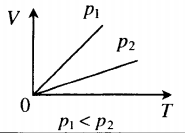

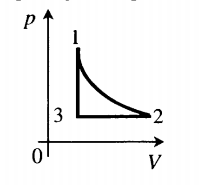
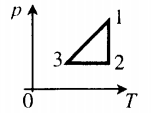
 На графике представлена зависимость объёма постоянного количества молей одноатомного идеального газа от средней кинетической энергии теплового движения молекул газа. Опишите, как изменяются температура и давление газа в процессах 1−2 и 2−3. Укажите, какие закономерности Вы использовали для объяснения.
На графике представлена зависимость объёма постоянного количества молей одноатомного идеального газа от средней кинетической энергии теплового движения молекул газа. Опишите, как изменяются температура и давление газа в процессах 1−2 и 2−3. Укажите, какие закономерности Вы использовали для объяснения.