Zno что это за оксид
Zno что это за оксид
Окси́д ци́нка (окись цинка, цинковые белила) — химическое соединение цинка с кислородом, имеющее формулу ZnO.
Белый, желтеющий при нагревании порошок. Кристалл при комнатной температуре бесцветен.
Содержание
Свойства
Физические свойства
Оксид цинка является прямозонным полупроводником с шириной запрещённой зоны 3,36 эВ.
При нагревании вещество меняет цвет: белый при комнатной температуре, оксид цинка становится жёлтым. Объясняется это уменьшением ширины запрещенной зоны и сдвигом края в спектре поглощения из УФ-области в синюю.
Химические свойства
Кристаллические свойства
Пьезоэлектрические свойства
Нанокристаллический оксид цинка
Получение
Применение
Известно также, что оксид цинка обладает фотокаталитической активностью, что на практике используется для создания самоочищающихся поверхностей, бактерицидных покрытий для стен и потолков в больницах и пр. Для фотокаталитической очистки воды в промышленных масштабах оксид цинка в настоящее время не используется.
Кроме того, порошок оксида цинка — перспективный материал в качестве рабочей среды для порошковых лазеров. На основе оксида цинка создали светодиод голубого цвета. Тонкие пленки и иные наноструктуры на основе оксида цинка могут применяться как чувствительные газовые и биологические сенсоры.
Свойства оксида цинка обуславливают его широко применение в фармацевтической промышленности. Оксид цинка нашел широкое применение в создании абразивных зубных паст и цементов в терапевтической стоматологии, в кремах для загара и косметических процедурах, в производстве электрокабеля, искусственной кожи и резинотехнических изделий. Кроме того, применение распространено в шинной, лакокрасочной, нефтеперерабатывающей промышленностях. Оксид цинка участвует процессе производства стекла и керамики.
Влияние на человека
Слабо токсичен, ПДК в воздухе рабочих помещений — 6 мг/м³. Пыль может образовываться при обжиге изделий из латуни.
Оксид цинка, характеристика, свойства и получение, химические реакции
Оксид цинка, характеристика, свойства и получение, химические реакции.
Оксид цинка – неорганическое вещество, имеет химическую формулу ZnO.
Краткая характеристика оксида цинка:
Оксид цинка – неорганическое вещество белого цвета.
Так как валентность цинка равна двум, то оксид цинка содержит один атом кислорода и один атом цинка.
Химическая формула оксида цинка ZnO.
При нагревании желтеет. При температуре 1800 о С сублимируется.
В воде не растворяется.
Оксид цинка относится к малотоксичным веществам. Его пыль вредна для органов дыхания.
Физические свойства оксида цинка:
| Наименование параметра: | Значение: |
| Химическая формула | ZnO |
| Синонимы и названия иностранном языке | zinc oxide (англ.) |
цинковые белила (рус.)
Получение оксида цинка:
В природе встречается в виде минерала цинкита, который практически полностью состоит из оксида цинка.
Оксид цинка также получают в результате следующих химических реакций:
2Zn + О2 → 2ZnО (t > 250 o C).
Zn(OH)2 → ZnO + H2О (t = 100-250 o C).
ZnCO3 → ZnO + CO2 (t = 200-300 o C).
2ZnS + 3O2 → 2ZnO + 2SO2 (t = 800-1000 o C).
Химические свойства оксида цинка. Химические реакции оксида цинка:
Оксид цинка относится к амфотерным оксидам. Он проявляет в зависимости от условий либо основные, либо кислотные свойства.
1. реакция оксида цинка с углеродом:
ZnO + C → Zn + CO (t = 1200-1300 o C).
В результате реакции образуется цинк и оксид углерода (II). Таким образом, цинк восстанавливается из оксида цинка коксом или углем при температуре 1200-1300 o C.
2. реакция оксида цинка с оксидом кремния:
ZnО + SiО2 → ZnSiО3 (t = 1200-1400 o C),
Оксид кремния является кислотным оксидом. В результате реакции в первом случае образуется соль – метасиликат цинка, во втором – ортосиликат цинка.
3. реакция оксида цинка с оксидом серы :
Оксид серы является кислотным оксидом. В результате реакции образуется соль – сульфит цинка.
4. реакция оксида цинка с оксидом бора:
В результате реакции образуется соль – борат цинка.
5. реакция оксида цинка с оксидом углерода :
ZnО + СО → Zn + CO2 (t = 700 o C).
6. реакция оксида цинка с оксидом бария :
ZnО + BaО → BaZnО2 (t = 1100 o C).
В результате реакции образуется соль – цинкат бария.
7. реакция оксида цинка с оксидом хрома :
В результате реакции образуется соль – хромат цинка.
8. реакция оксида цинка с оксидом железа:
9. реакция оксида цинка с оксидом молибдена :
В результате реакции образуется соль – молибдат цинка.
10. реакция оксида цинка с оксидом ванадия :
В результате реакции образуется соль – тетраоксованадат цинка.
11. реакция оксида цинка с оксидом марганца :
В результате реакции образуется в первом случае – оксид марганца-трицинка, во втором – оксид марганца-цинка.
12. реакция оксида цинка с оксидом вольфрама :
ZnО + WО3 → ZnWО4 (t = 600-800 o C).
В результате реакции образуется соль – вольфрамат цинка.
13. реакция оксида цинка с сульфидом цинка:
2ZnO + ZnS → 3Zn + SO2.
В результате химической реакции получается цинк и оксид цинка.
14. реакция оксида цинка с хлоридом цинка и водой:
ZnO + ZnCl2 + H2O → 2Zn(OH)Cl (t = 100-130 o C).
В результате химической реакции получается быстро (2-3 минуты) твердеющая масса – хлорид-гидроксид цинка (т.н. цинковый цемент ). Хлорид цинка – концентрированный раствор.
15. реакция оксида цинка с плавиковой кислотой:
В результате химической реакции получается соль – фторид цинка и вода.
16. реакция оксида цинка с азотной кислотой:
17. реакция оксида цинка с ортофосфорной кислотой:
Аналогично проходят реакции оксида цинка и с другими кислотами.
18. реакция оксида цинка с бромистым водородом (бромоводородом):
19. реакция оксида цинка с йодоводородом:
20. реакция оксида цинка с сероводородом:
ZnO + H2S → ZnS + H2O (t = 450-550 o C).
21. реакция оксида цинка с гидроксидом натрия :
ZnO + 2NaOH → Na2ZnO2 + H2O (t = 500-600 o C).
22. реакция оксида цинка с гидроксидом натрия и водой:
ZnO + NaOH + H2O → Na[Zn(OН)3] (t = 100 o C),
В результате химической реакции во втором случае получается тригидроксоцинкат натрия. Гидроксид натрия изначально растворен в воде. Раствор гидроксида натрия в воде 60 %. Реакция протекает при температуре 90 o C.
23. реакция оксида цинка с гидратом аммиака:
В результате реакции образуются гидроксид тетраамминцинка и вода. Гидрат аммиака – концентрированный раствор.
24. реакция оксида цинка с хлоридом аммония:
В результате реакции образуются хлорид цинка, аммиак и вода.
Применение и использование оксида цинка:
Оксид цинка применяется в качестве наполнителя, компонента или катализатора в химической, фармацевтической, резинотехнической, лакокрасочной и нефтеперерабатывающей промышленности, в производстве стекла и керамики, а также медицине.
Примечание: © Фото //www.pexels.com, //pixabay.com
оксид цинка реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида цинка
реакции с оксидом цинка
Оксид цинка (вещество)
Оксид цинка (вещество)
| Оксид цинка | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Цинка оксид |
| Химическая формула | ZnO |
| Отн. молек. масса | N а. е. м. |
| Молярная масса | 81.41 г/моль |
| Физические свойства | |
| Плотность вещества | 5.606 г/см³ |
| Состояние (ст. усл.) | твёрдое |
| Термические свойства | |
| Температура плавления | 1985 °C |
| Температура кипения | N °C |
| Температура разложения | N °C |
| Молярная теплоёмкость (ст. усл.) | N Дж/(моль·К) |
| Химические свойства | |
| pKa | N |
| Растворимость в воде | 0,16 г/100 мл |
| Классификация | |
| номер CAS | [1314-13-2] |
Окси́д ци́нка (окись цинка, цинковые белила) — химическое соединение цинка с кислородом, имеющее формулу ZnO.
Белый, желтеющий при нагревании порошок. Кристалл при комнатной температуре бесцветен.
Содержание
Свойства
Физические свойства
Оксид цинка является прямозонным полупроводником с шириной запрещённой зоны 3,36 эВ.
При нагревании вещество меняет цвет: белый при комнатной температуре, оксид цинка становится жёлтым. Объясняется это уменьшением ширины запрещенной зоны и сдвигом края в спектре поглощения из УФ-области в синюю.
Химические свойства
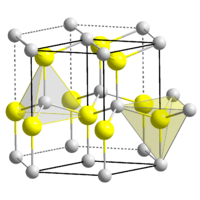
Кристаллические свойства
Пьезоэлектрические свойства
Нанокристаллический оксид цинка
Получение
Применение
Известно также, что оксид цинка обладает фотокаталитической активностью, что на практике используется для создания самоочищающихся поверхностей, бактерицидных покрытий для стен и потолков в больницах и пр. Для фотокаталитической очистки воды в промышленных масштабах оксид цинка в настоящее время не используется.
Кроме того, порошок оксида цинка — перспективный материал в качестве рабочей среды для порошковых лазеров. На основе оксида цинка создали светодиод голубого цвета. Тонкие пленки и иные наноструктуры на основе оксида цинка могут применяться как чувствительные газовые и биологические сенсоры.
Свойства оксида цинка обуславливают его широко применение в фармацевтической промышленности. Оксид цинка нашел широкое применение в создании абразивных зубных паст и цементов в терапевтической стоматологии, в кремах для загара и косметических процедурах, в производстве электрокабеля, искусственной кожи и резинотехнических изделий. Кроме того, применение распространено в шинной, лакокрасочной, нефтеперерабатывающей промышленностях. Оксид цинка участвует процессе производства стекла и керамики.
Влияние на человека
Слабо токсичен, ПДК в воздухе рабочих помещений — 6 мг/м³. Пыль может образовываться при обжиге изделий из латуни.
Оксид цинка
| Оксид цинка | ||||||
 | ||||||
 | ||||||
| Общие | ||||||
|---|---|---|---|---|---|---|
| Систематическое наименование | Цинка оксид | |||||
| Химическая формула | ZnO | |||||
| Физические свойства | ||||||
| Состояние (ст. усл.) | твердое | |||||
| Молярная масса | 81.408 г/моль | |||||
| Плотность | 5.61 г/см³ | |||||
| Термические свойства | ||||||
| Температура сублимации | 1800 °C | |||||
| Молярная теплоёмкость (ст. усл.) | 40,28 Дж/(моль·К) | |||||
| Энтальпия образования (ст. усл.) | 350.8 кДж/моль | |||||
| Оптические свойства | ||||||
| Показатель преломления | 2,015 и 2,068 | |||||
| Структура | ||||||
| Кристаллическая структура | гексагональная сингония, a = 0,32495 нм, c = 0,52069 нм, z = 2 | |||||
| Классификация | ||||||
| Рег. номер CAS | 1314-13-2 | |||||
| Рег. номер PubChem | 14806 | |||||
| Регистрационный номер EC | 215-222-5 | |||||
| ChEBI | ZH4810000 | |||||
| Безопасность | ||||||
| ПДК | в воздухе рабочей зоны 0.5 мг/м 3 в атмосферном воздухе 0.05 мг/м 3 | |||||
| Токсичность | Токсичен, при вдыхании пыли вызывает литейную лихорадку | |||||
| R-фразы | R50/53 | |||||
| S-фразы | S60, S61 | |||||
| NFPA 704 | ||||||
| Наименование параметра: | Значение: |
| Химическая формула | ZnO |
| Синонимы и названия иностранном языке | zinc oxide (англ.) |
цинковые белила (рус.)
Получение оксида цинка:
В природе встречается в виде минерала цинкита, который практически полностью состоит из оксида цинка.
Оксид цинка также получают в результате следующих химических реакций:
2Zn + О2 → 2ZnО (t > 250 o C).
Zn(OH)2 → ZnO + H2О (t = 100-250 o C).
ZnCO3 → ZnO + CO2 (t = 200-300 o C).
2ZnS + 3O2 → 2ZnO + 2SO2 (t = 800-1000 o C).
Химические свойства оксида цинка. Химические реакции оксида цинка:
Оксид цинка относится к амфотерным оксидам. Он проявляет в зависимости от условий либо основные, либо кислотные свойства.
Химические свойства оксида цинка аналогичны свойствам амфотерных оксидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида цинка с углеродом:
ZnO + C → Zn + CO (t = 1200-1300 o C).
В результате реакции образуется цинк и оксид углерода (II). Таким образом, цинк восстанавливается из оксида цинка коксом или углем при температуре 1200-1300 o C.
2. реакция оксида цинка с оксидом кремния:
ZnО + SiО2 → ZnSiО3 (t = 1200-1400 o C),
Оксид кремния является кислотным оксидом. В результате реакции в первом случае образуется соль – метасиликат цинка, во втором – ортосиликат цинка.
3. реакция оксида цинка с оксидом серы:
Оксид серы является кислотным оксидом. В результате реакции образуется соль – сульфит цинка.
4. реакция оксида цинка с оксидом бора:
В результате реакции образуется соль – борат цинка.
5. реакция оксида цинка с оксидом углерода:
ZnО + СО → Zn + CO2 (t = 700 o C).
В результате реакции образуется цинк и углекислый газ.
6. реакция оксида цинка с оксидом бария:
ZnО + BaО → BaZnО2 (t = 1100 o C).
В результате реакции образуется соль – цинкат бария.
7. реакция оксида цинка с оксидом хрома:
В результате реакции образуется соль – хромат цинка.
8. реакция оксида цинка с оксидом железа:
В результате реакции образуется оксид железа-цинка.
9. реакция оксида цинка с оксидом молибдена:
В результате реакции образуется соль – молибдат цинка.
10. реакция оксида цинка с оксидом ванадия:
В результате реакции образуется соль – тетраоксованадат цинка.
11. реакция оксида цинка с оксидом марганца:
В результате реакции образуется в первом случае – оксид марганца-трицинка, во втором – оксид марганца-цинка.
12. реакция оксида цинка с оксидом вольфрама:
ZnО + WО3 → ZnWО4 (t = 600-800 o C).
В результате реакции образуется соль – вольфрамат цинка.
13. реакция оксида цинка с сульфидом цинка:
2ZnO + ZnS → 3Zn + SO2.
В результате химической реакции получается цинк и оксид цинка.
14. реакция оксида цинка с хлоридом цинка и водой:
ZnO + ZnCl2 + H2O → 2Zn(OH)Cl (t = 100-130 o C).
В результате химической реакции получается быстро (2-3 минуты) твердеющая масса – хлорид-гидроксид цинка (т.н. цинковый цемент). Хлорид цинка – концентрированный раствор.
15. реакция оксида цинка с плавиковой кислотой:
В результате химической реакции получается соль – фторид цинка и вода.
16. реакция оксида цинка с азотной кислотой:
В результате химической реакции получается соль – нитрат цинка и вода.
17. реакция оксида цинка с ортофосфорной кислотой:
В результате химической реакции получается соль – ортофосфат цинка и вода. Ортофосфорная кислота изначально растворена в воде.
Аналогично проходят реакции оксида цинка и с другими кислотами.
18. реакция оксида цинка с бромистым водородом (бромоводородом):
В результате химической реакции получается соль – бромид цинка и вода.
19. реакция оксида цинка с йодоводородом:
В результате химической реакции получается соль – йодид цинка и вода.
20. реакция оксида цинка с сероводородом:
ZnO + H2S → ZnS + H2O (t = 450-550 o C).
В результате химической реакции получается соль – сульфид цинка и вода.
21. реакция оксида цинка с гидроксидом натрия:
ZnO + 2NaOH → Na2ZnO2 + H2O (t = 500-600 o C).
В результате химической реакции получается соль – цинкат натрия и вода.
22. реакция оксида цинка с гидроксидом натрия и водой:
ZnO + NaOH + H2O → Na[Zn(OН)3] (t = 100 o C),
В результате химической реакции в первом случае получается тригидроксоцинкат натрия. Гидроксид натрия изначально растворен в воде. Раствор гидроксида натрия в воде 40 %. Реакция протекает при кипении.
В результате химической реакции во втором случае получается тригидроксоцинкат натрия. Гидроксид натрия изначально растворен в воде. Раствор гидроксида натрия в воде 60 %. Реакция протекает при температуре 90 o C.
23. реакция оксида цинка с гидратом аммиака:
В результате реакции образуются гидроксид тетраамминцинка и вода. Гидрат аммиака – концентрированный раствор.
24. реакция оксида цинка с хлоридом аммония:
В результате реакции образуются хлорид цинка, аммиак и вода.
Применение и использование оксида цинка:
Оксид цинка применяется в качестве наполнителя, компонента или катализатора в химической, фармацевтической, резинотехнической, лакокрасочной и нефтеперерабатывающей промышленности, в производстве стекла и керамики, а также медицине.











 Na2ZnO2 + H2O ZnO + CoO
Na2ZnO2 + H2O ZnO + CoO 