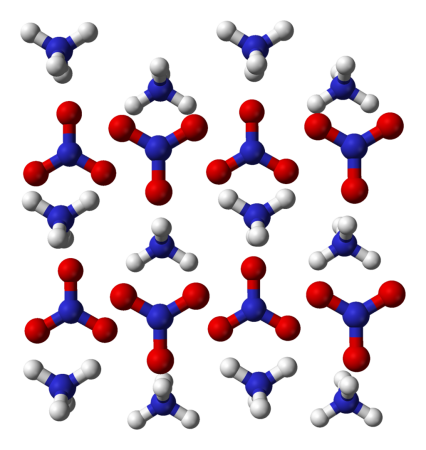
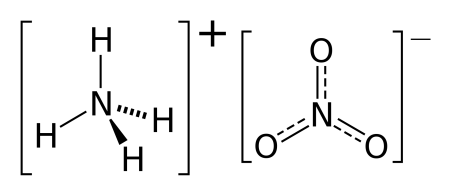Азотнокислый аммоний что это
Нитрат аммония
| Нитрат аммония | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Нитрат аммония |
| Химическая формула | NH4NO3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдый |
| Отн. молек. масса | 80,04 а. е. м. |
| Молярная масса | 80,04 г/моль |
| Плотность | 1,725 (IV модификация) г/см³ |
| Термические свойства | |
| Температура плавления | 169,6 °C |
| Температура кипения | 235 °C |
| Температура разложения | |
| Химические свойства | |
| Растворимость в воде | 20 °C — 190 г/100 мл |
| Классификация | |
| Рег. номер CAS | 6484-52-2 |
Нитра́т аммо́ния (аммонийная (аммиачная) селитра) — химическое соединение NH4NO3, соль азотной кислоты. Впервые получена Глаубером в 1659 году.
Содержание
Физические свойства
Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение вещества, а при температуре 210 °C происходит полное разложение. Температура кипения при повышенном давлении — 235 °C. Молекулярная масса 80,04 а. е. м.. Скорость детонации 2570 м/с.
Растворимость
| Температура, °C | Растворимость, г/100мл |
|---|---|
| 0 | 119 |
| 25 | 212 |
| 50 | 346 |
| 100 | 1024 |
При растворении происходит сильное поглощение тепла (аналогично нитрату калия), что значительно замедляет растворение. Поэтому для приготовления насыщенных растворов нитрата аммония применяется нагревание, при этом твёрдое вещество засыпается небольшими порциями.
Состав
Содержание элементов в нитрате аммония в массовых процентах:
Методы получения
Основной метод
В промышленном производстве используется безводный аммиак и концентрированная азотная кислота:
Реакция протекает бурно с выделением большого количества тепла. Проведение такого процесса в кустарных условиях крайне опасно (хотя в условиях большого разбавления водой нитрат аммония может быть легко получен). После образования раствора, обычно с концентрацией 83 %, лишняя вода выпаривается до состояния расплава, в котором содержание нитрата аммония составляет 95—99,5 % в зависимости от сорта готового продукта. Для использования в качестве удобрения расплав гранулируется в распылительных аппаратах, сушится, охлаждается и покрывается составами для предотвращения слёживания. Цвет гранул варьируется от белого до бесцветного. Нитрат аммония для применения в химии обычно обезвоживается, так как он очень гигроскопичен и процентное количество воды в нём (
Метод Габера
По способу Габера из азота и водорода синтезируется аммиак, часть которого окисляется до азотной кислоты и реагирует с аммиаком, в результате чего образуется нитрат аммония:
Нитрофосфатный метод
Этот способ также известен как способ Одда, названный так в честь норвежского города, в котором был разработан этот процесс. Он применяется непосредственно для получения азотных и азотно-фосфорных удобрений из широко доступного природного сырья. При этом протекают следующие процессы:
А также амфотерный метод.
Химические свойства
Реакции разложения
Термическое разложение нитрата аммония может происходить по-разному, в зависимости от температуры:
Кристаллические состояния нитрата аммония
Изменения кристаллического состояния нитрата аммония под воздействием температуры и давления меняют его физические свойства. Обычно различают следующие состояния:
| Система | Диапазон температур (°C) | Состояние | Изменение объёма (%) |
|---|---|---|---|
| — | > 169.6 | жидкость | |
| I | 169.6 — 125.2 | кубическая | +2.1 |
| II | 125.5 — 84.2 | тетрагональная | −1.3 |
| III | 84.2 — 32.3 | α-ромбическая | +3.6 |
| IV | 32.3 — −16.8 | β-ромбическая | −2.9 |
| V | ПрименениеВзрывчатые веществаНаиболее широко в промышленности и горном деле применяются смеси аммиачной селитры с различными видами углеводородных горючих материалов, других взрывчатых веществ, а также многокомпонентные смеси: УдобренияБо́льшая часть нитрата аммония используется либо непосредственно как хорошее азотное удобрение, либо как полупродукт для получения прочих удобрений. Аварии и взрывыДополнительная информацияМировое производство аммиачной селитры на 1980 год составляло 14 млн т, в пересчёте на азот. Азотнокислый аммоний что этоГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР Reagents. Ammonium nitrate. ОКП 26 2116 0020 06 Дата введения 1979-01-01 1. РАЗРАБОТАН И ВНЕСЕН Министерством химической промышленности СССР В.П.Чуб, Л.К.Хайдукова, В.К.Окунева, В.Н.Корецкая, Т.Г.Манова, Г.В.Грязнов, З.М.Ривина, Э.П.Кравчук, М.В.Перловская 2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 28.12.77 N 3095 4. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ Обозначение НТД, на который дана ссылка Номер пункта, подпункта 3.2.1, 3.3.1, 3.5, 3.11.1, 3.12a.1 3.3.1, 3.11.1, 3.12.1, 3.12a.1 3.2.1, 3.3.1, 3.11.1, 3.12.1, 3.15 5. Ограничение срока действия снято по протоколу Межгосударственного Совета по стандартизации, метрологии и сертификации (ИУС 5-6-93) 6. ПЕРЕИЗДАНИЕ (апрель 1997 г.) с Изменениями N 1, 2, утвержденными в июне 1988 г., феврале 1993 г. (ИУС 10-88, 8-93) Настоящий стандарт распространяется на азотнокислый аммоний, представляющий собой кристаллический порошок, хорошо растворимый в воде и спирте; гигроскопичен, способен слеживаться. Допускается изготовление азотнокислого аммония по ИСО 6353-3-87 (Р.44) (приложение 1) и проведение анализов по ИСО 6353-1-82 (приложение 2). (Измененная редакция, Изм. N 2). 1. ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ1.1. Азотнокислый аммоний должен быть изготовлен в соответствии с требованиями настоящего стандарта по технологическому регламенту, утвержденному в установленном порядке. 1.2. По физико-химическим показателям азотнокислый аммоний должен соответствовать нормам, указанным в таблице. Химически чистый х.ч. Чистый для анализа ч.д.а. Чистый ч. 1. Массовая доля азотнокислого аммония (NH NO ), %, не менее 2. Массовая доля нерастворимых в воде веществ, %, не более 3. Массовая доля остатка после прокаливания в виде сульфатов, %, не более 4. Массовая доля нитритов (NO ), %, не более 5. Массовая доля сульфатов (SO ), %, не более 6. Массовая доля фосфатов (РО ), %, не более 7. Массовая доля хлоридов (CI), %, не более 8. Массовая доля железа (Fe), %, не более 9. Массовая доля кальция (Са), %, не более 10. Массовая доля магния (Mg), %, не более 11. Массовая доля мышьяка (As), %, не более 12. Массовая доля тяжелых металлов, (Pb), %, не более 13. рН раствора препарата с массовой долей 5% (Измененная редакция, Изм. N 1, 2). 2. ПРАВИЛА ПРИЕМКИ2.2. Массовую долю фосфатов, магния и мышьяка изготовитель определяет в каждой 20-й партии. (Введен дополнительно, Изм. N 1). 3. МЕТОДЫ АНАЛИЗАПри взвешивании используют лабораторные весы по ГОСТ 24104 2-го класса точности с наибольшим пределом взвешивания 200 г и 3-го класса точности с наибольшими пределами взвешивания 500 г и 1 кг. Допускается применение других средств измерения с метрологическими характеристиками и оборудования с техническими характеристиками не хуже, а также реактивов по качеству не ниже указанных в настоящем стандарте. 3.1. Пробы отбирают по ГОСТ 3885. Масса средней пробы должна быть не менее 600 г. 3.1а, 3.1. (Измененная редакция, Изм. N 2). 3.2. Определение массовой доли азотнокислого аммония 3.2.1. Аппаратура, реактивы и растворы Бюретка 1(2)-2-50-0,1 по НТД. Колба Кн-2-250-34 ТХС по ГОСТ 25336. Вода дистиллированная, не содержащая углекислоты; готовят по ГОСТ 4517. Натрия гидроокись по ГОСТ 4328; раствор молярной концентрации (NaOH)=0,5 моль/дм (0,5 н.); готовят по ГОСТ 25794.1. Спирт этиловый ректификованный технический по ГОСТ 18300 высшего сорта. Фенолфталеин, спиртовой раствор с массовой долей 1%; готовят по ГОСТ 4919.1. Формалин технический по ГОСТ 1625, раствор 1:1, нейтральный; готовят по ГОСТ 4517. Хороший грунт – залог отличного урожая. Со временем земля нуждается в подпитке. Для увеличения ее плодородности применяют удобрения. Магазины предлагают широкий ассортимент удобрений. Не последнее место в этом списке занимает нитрат аммония. Аммоний азотнокислый применяется как садоводами, так и крупными аграрными хозяйствами. Основные преимущества нитрата аммония: Азот – основной действующий элемент для развития растений. Входит в состав нуклеиновых кислот, которые, в свою очередь, являются составляющими практически всех важных клеток растения (отвечающих за дупликацию материала, дыхания, синтез белка). Количество его в составе удобрения варьируется от 25 до 36%. Помимо азота, в составе содержится сера (улучшает усвоение азота), ее концентрация может колебаться от 4 до 15%. Нитрат аммония может иметь искусственное и природное происхождение. В первом случае – извлечение происходит химическим способом. При природном – извлечение осуществляется путем нейтрализации азотной кислоты. Производители выпускают удобрения с применением различных элементов в качестве добавок. Это осуществляется с целью подстроить продукт под различные типы, качества грунта. В связи с этим можно выделить несколько основных видов нитрата аммония: Аммиачная селитра: применение в садоводстве Особенности применения селитры аммиачнойПеред применением аммонийной селитры необходимо учесть тип почвы, климатические условия, вид растений.
Кислая почваДля усиления действия аммония азотнокислого и устранения временного эффекта подкисления необходимо произвести нейтрализацию удобрения. Это можно осуществить, используя удобрение с известью или доломитом, в равных соотношениях. Кислая дерново-подзолистая почваДля достижения положительного эффекта должно осуществляться либо использование нитрата аммония с известью, либо регулярная нейтрализация повышенной кислотности. Серозем, черноземКак рассчитать количество удобрения?Количество используемого нитрата аммония зависит от плодовитости почвы. Если она плодовита, то необходимо использовать в пределах 25 г/кв. м, в противном случае дозировку необходимо увеличить до 40 г/кв. м. Внесение удобрения под рассаду можно как в сухом виде (5 г на лунку), так и в растворенном (около 35 г/10 л).
Несмотря на то что нитрат аммония благоприятно влияет на растения и недорог, он имеет ряд недостатков: Хранение аммонийной селитрыХранить удобрение необходимо в герметичной упаковке, дабы азот не испарился, и удобрение не потеряло своих положительных свойств. Место для хранения должно быть сухим, хорошо проветриваемым, температура не должна превышать 30 градусов. Рядом не должны располагаться легкогорючие материалы. Следует избегать резкого перепада температуры, чтобы избежать процесса перекристаллизации. Нужно также предотвратить прямое попадание солнечных лучей (при нагревании нитрат аммония может непроизвольно взрываться). Аммоний азотнокислый (аммиачная селитра): состав, применение, нормы внесенияСвойства
210 °C. Формула: NH4NO3. Нагреваясь более t плавления, это соединение потихонечку разлагается, а при 210 °C уже наблюдается его полное разложение. Вообще терморазложение осуществляется не в одинаковой степени, все зависит от температурных параметров. При t менее 200 °C происходит превращение в совокупность продуктов реакции N2O↑ + 2H2O + Q, а при достижении показателя 350 °C (в момент детонации) происходит рассоединение на 2N2 + O2 + 4H2O. Что касается растворения в воде, то его интенсивность разная при различной температуре среды: 119 г/100 мл при 0 °C, 190 г/100 мл при 20 °C, 1024 г/100 мл при 100 °C. То есть, в целом, растворение в водной среде высокое, но чем выше t, тем оно лучше. Стоит учитывать, что растворимость сопровождается мощным теплопоглощением (по аналогии с азотнокислым калием). Это приводит к заметному торможению процесса. Следовательно, чтобы создать насыщенный раствор аммиачной селитры, необходимо прибегнуть к нагреву с постепенным засыпанием твердого материала незначительными дозами. ПолучениеСуществуют разные пром. способы синтеза данного материала. Основной из них заключается во взаимодействии безводного NH3 и концентрированной HNO3 (нитратной кислоты). Ему характерно бурное протекание и выделение при этом значительного объема тепла. Поэтому отсутствие определенных знаний и умений может привести к некой опасности. Чтобы предотвратить ее, можно брать в работу сильно разбавленные водой компоненты реакции. Так облегчается процесс получения аммонийной селитры. Когда раствор с применением указанного способа получения образуется, его концентрация, как правило, составляет 83 %. Избыток воды при этом поддается выпариванию до расплавленного состояния селитры, а в нем нитрат аммония занимает 95-99,5 % (зависимо от сорта готовой продукции). Чтобы стало возможным применение для удобрения растений, расплав поддают гранулированию с помощью спец. распылителей, после сушат, охлаждают и покрывают антислеживающими материалами. В результате гранулы либо становятся бесцветными, либо приобретают белоснежный окрас. Если же азотнокислый аммоний необходим для хим. целей, осуществляют обезвоживание, ввиду сильной гигроскопичности и практически отсутствия возможности получить процентный объем воды в нем. Есть, к тому же, способ получения данного реактива, именуемый методом Габера. Согласно ему, сочетание таких элементов, как N и H, при давлении, высокой t и катализирующем участнике процесса дает нитрид водорода, некое число которого поддается окислению, трансформируясь в HNO3. В ходе дальнейшей реакции и появляется рассматриваемый продукт. Кроме того, существуют нитрофосфатный и амфотерный методы его синтеза. СоставАзот является важнейшим питанием для зеленых насаждений. Без него невозможно полноценное развитие любых растений. Он присутствует в хлорофилле – участнике фотосинтеза. Благодаря ему по растительным тканям распространяется солнечная и белковая энергия, интенсифицирующая ростовые процессы. Но, как и другие элементы, азот должен поступать к культурам в оптимальных количествах. Его недостаток чреват уменьшением урожайности, а чрезмерные объемы – снижением качества урожая, в частности плохим влиянием на вкус плодов и минимизацией сроков хранения. Если же говорить об избыточном азотонасыщении, не исключены ростовые торможения в осенний период. Как результат – уменьшение устойчивости растений к морозам зимой. По поводу серы… Она – составная часть ферментов, также имеющих большое значение для фотосинтеза. При серодефиците насаждения ослабевают, растут медленнее, также уменьшается скорость созревания плодов. КлассификацияНитрат аммония выпускается промышленностью в разных вариантах (к примеру, фасованном и рассыпном). Практически всегда в него входят какие-то добавки. Причем, какие именно, зависит от региона применения: удобрение часто подстраивается под потребности того или иного климата. Итак, составы с добавками характеризуются суженным задействованием. Но, вместе с тем, благодаря им можно проще добиваться улучшенных результатов определенных задач, нежели с удобрениями, действующими более универсально. Выпускают также селитру марки Б, которая, в свою очередь, подразделяется на первый и второй сорта. Не вызывает сложностей в применении, хорошо хранится в условиях быта. Реализуется, как правило, в садоводческих точках продажи, расфасованной от 1 кг. Чаще всего ею удобряют комнатные цветы и рассаду. В продаже можно также встретить аммиачно-калийную, известково-аммиачную, магниевую и кальциевую селитры. Первая содержит не только азот, но и калий, вторая – дополнительно калий, кальций и магний, третья также выступает источником магния, а четвертая насыщает почву еще и кальцием. Азотнокислый аммоний: применениеВыше не раз упоминалось о двух направлениях использования данного продукта: для изготовления взрывчатых материалов и для удобрения насаждений, преимущественно сельскохозяйственных. Давайте рассмотрим каждое из них немного детальнее.
Нитрат аммония, как и мочевина, является супер подкормкой для применения весной. Начальные стадии развития растений характеризуются обильным азотопотреблением, а совокупность азот + сера отличается особо хорошим и оперативным усвоением N. Кстати, именно это по большей части объясняет вхождение в состав этого удобрения серы, ведь сама по себе она слишком уж большой питательной ценности не несет. Если говорить о присутствии других микро- и макроэлементов, то они тоже благотворно влияют на усвоение растениями азота. В чем секрет популярности аммонийной селитры среди аграриев? Не только в надлежащем питании культурных насаждений, но и в организации защиты от различных недугов, в интенсификации иммунитета и др. Она превосходно показывает себя при чрезмерной эксплуатации земельных наделов и при несоблюдении севооборота (постоянном высаживании на одном и том же участке культур, принадлежащих к одному классу). Примечательно, что нитрат аммония можно вносить на разных типах почвы. Он в этом плане отличается универсальностью. Если почвенный состав нормальный, то он при задействовании удобряющего продукта не изменяется (подкисление при оптимальном уровне рН не происходит). Если же говорить о подзолистых, кислых почвах, то наблюдается некий эффект подкисления. Чтобы его убрать, необходимо дополнительно пользоваться карбонатом кальция в соотношении 3 части мела на 4 части селитры. Тяжелые и глинистые почвы могут быть удобрены осенью или весной, почвы в тех зонах, которым характерна повышенная влажность – и осенью, и весной. Все другие регионы отлично реагируют на одну лишь весеннюю подкормку. Вносить это удобрение можно как сухим, так и растворенным. Первый вариант подходит для основной осенней либо же весенней заправки, второй – для корневой подкормки. К слову, то, что данное вещество отлично растворяется в воде, является одним из весомых его преимуществ. Нормы внесенияЧто касается последующих подкормок, то здесь нормы внесения (дозы, способы, периодичность) зависят непосредственно от самих культур: — овощи. Удобряются 5-10 г/м 2 два раза за вегетационный период: в июне, перед цветением, и в июле, когда появились завязи. Не стоит удобрять селитрой кабачки, патиссоны и тыкву, ввиду возможности скопления нитратов; Чтобы было более удобно применять это минудобрение, возьмите на заметку: 1 столовая ложка равна 17 г нитрата аммония, а один стакан вмещает примерно 170 г гранулированного продукта. Обратите внимание!Каждая подкормка аммонийной селитрой должна сопровождаться хорошим поливом. Еще важен такой момент: удобрять насаждения последний раз можно не позже, чем за 14 дней до сбора урожая. В ином случае в плодах могут накопиться нитраты, которые небезопасны для людей. Вообще, работа с аммиачной селитрой должна осуществляться с четким соблюдением предписаний инструкции. Только так можно достичь желаемых результатов и не навредить насаждениям. Напоследок хотелось бы акцентировать внимание на таком моменте, как доступность нитрата аммония. Это мега выгодный в экономическом плане агрохимикат. Его расход незначителен: при средних объемах внесения 10-20 г/м 2 на одну сотку понадобится всего 1 кг удобряющего продукта. Выгоде его использования не вредит даже тот факт, что наиболее целесообразным считается применение вместе с другими минеральными компонентами. Нитрат аммония | ||
| Систематическое наименование | Нитрат аммония | ||
| Хим. формула | NH4NO3 | ||
| Состояние | твёрдый | ||
| Молярная масса | 80,04 г/моль | ||
| Плотность | 1,725 (IV модификация) | ||
| Т. плав. | 169,6 °C | ||
| Т. кип. | 235 °C | ||
| Т. разл. | 210 °C | ||
| Растворимость в воде | 20 °C — 190 г/100 мл | ||
| ГОСТ | ГОСТ 14702-79 | ||
| Рег. номер CAS | 6484-52-2 | ||
| PubChem | 22985 | ||
| Рег. номер EINECS | 229-347-8 | ||
| SMILES | |||
| RTECS | BR9050000 | ||
| ChEBI | 63038 | ||
| ChemSpider | 21511 | ||
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |||
Нитрат аммония (аммонийная (аммиачная) селитра) — химическое соединение NH4NO3, соль азотной кислоты. Впервые получена Глаубером в 1659 году. Используется в качестве компонента взрывчатых веществ и как азотное удобрение.
Содержание
Физические свойства
Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение вещества, а при температуре 210 °C происходит полное разложение. Температура кипения при пониженном давлении — 235 °C. Молекулярная масса 80,04 а. е.м. Скорость детонации 2570 м/с.
Растворимость
Растворимость в воде:
| Температура, °C | Растворимость, г/100мл |
|---|---|
| 0 | 119 |
| 10 | 150 |
| 25 | 212 |
| 50 | 346 |
| 80 | 599 |
| 100 | 1024 |
При растворении происходит сильное поглощение тепла (аналогично нитрату калия), что значительно замедляет растворение. Поэтому для приготовления насыщенных растворов нитрата аммония применяется нагревание, при этом твёрдое вещество засыпается небольшими порциями.
Также соль растворима в аммиаке, пиридине, метаноле, этаноле.
Состав
Содержание элементов в нитрате аммония в массовых процентах:
Методы получения
Основной метод
В промышленном производстве используется безводный аммиак и концентрированная азотная кислота:
Реакция протекает бурно с выделением большого количества тепла. Проведение такого процесса в кустарных условиях крайне опасно (хотя в условиях большого разбавления водой нитрат аммония может быть легко получен). После образования раствора, обычно с концентрацией 83 %, лишняя вода выпаривается до состояния расплава, в котором содержание нитрата аммония составляет 95—99,5 % в зависимости от сорта готового продукта. Для использования в качестве удобрения расплав гранулируется в распылительных аппаратах, сушится, охлаждается и покрывается составами для предотвращения слёживания. Цвет гранул варьируется от белого до бесцветного. Нитрат аммония для применения в химии обычно обезвоживается, так как он очень гигроскопичен и процентное количество воды в нём получить практически невозможно.
Метод Габера
По способу Габера из азота и водорода синтезируется аммиак, часть которого окисляется до азотной кислоты и реагирует с аммиаком, в результате чего образуется нитрат аммония:
Нитрофосфатный метод
Этот способ также известен как способ Одда, названный так в честь норвежского города, в котором был разработан этот процесс. Он применяется непосредственно для получения азотных и азотно-фосфорных удобрений из широко доступного природного сырья. При этом протекают следующие процессы:
А также амфотерный метод.
Химические свойства
Термическое разложение нитрата аммония может происходить по-разному, в зависимости от температуры:
Кристаллические состояния нитрата аммония
Изменения кристаллического состояния нитрата аммония под воздействием температуры и давления меняют его физические свойства. Обычно различают следующие состояния:
| Система | Диапазон температур (°C) | Состояние | Изменение объёма (%) | |
|---|---|---|---|---|
| — | > 169.6 | жидкость | ||
| I | 169.6 — 125.2 | кубическая | −2.13 | |
| II | 125.5 — 84.2 | тетрагональная | −1.33 | |
| III | 84.2 — 32.3 | α-ромбическая | +0.8 | |
| IV | 32.3 — −16.8 | β-ромбическая | −3.3 | |
| V | −50 — −16.8 | тетрагональная | +1.65 | |
| VI | существует при высоких давлениях | |||
| VII | 170 | |||
| VIII | существует при высоких давлениях | |||
| IX | существует при высоких давлениях |
Фазовый переход от IV к III при 32,3 °C приносит неприятности производителям удобрений, потому как изменения плотности приводят к разрушению частиц при хранении и применении. Это особенно важно в тропических странах, где нитрат аммония испытывает циклические изменения, приводящие к разрушению гранул, слёживанию, повышенному пылению и риску возникновения взрыва.
Применение
Удобрения
Бо́льшая часть нитрата аммония используется либо непосредственно как хорошее азотное удобрение, либо как полупродукт для получения прочих удобрений. Для предотвращения создания взрывчатых веществ на основе нитрата аммония в удобрения, доступные в широкой продаже, добавляют компоненты, снижающие взрывоопасность и детонационные свойства чистого нитрата аммония, такие как мел (карбонат кальция).
В Австралии, Китае, Афганистане, Ирландии и некоторых других странах свободная продажа нитрата аммония даже в виде удобрений запрещена или ограничена. После террористического акта в Оклахома-Сити ограничения на продажу и хранение нитрата аммония были введены в некоторых штатах США.
Взрывчатые вещества
Наиболее широко в промышленности и горном деле применяются смеси аммиачной селитры с различными видами углеводородных горючих материалов, других взрывчатых веществ, а также многокомпонентные смеси:
Безопасный состав
Дополнительная информация
Мировое производство аммиачной селитры на 1980 год составляло 14 млн т, в пересчёте на азот.



 Молярная масса – 80,04 г/моль, плотность – 1,725 г/см³. Термосвойства: t плавл. – 169,6 °C, t кип. – 235 °C (при увеличенном давлении), t разл. –
Молярная масса – 80,04 г/моль, плотность – 1,725 г/см³. Термосвойства: t плавл. – 169,6 °C, t кип. – 235 °C (при увеличенном давлении), t разл. – Удобрение. Большие объемы данного реактива идут именно на нужды сельского хозяйства. Здесь он находит применение в двух ракурсах: как азотоудобрение или материал для производства удобрений-комплексов. Во избежание взрываемости, в его состав вводятся также специальные добавки, задача которых – снизить опасность взрыва и детонации чистого NH4NO3. Примером таких добавок может служить углекислый кальций, или попросту мел.
Удобрение. Большие объемы данного реактива идут именно на нужды сельского хозяйства. Здесь он находит применение в двух ракурсах: как азотоудобрение или материал для производства удобрений-комплексов. Во избежание взрываемости, в его состав вводятся также специальные добавки, задача которых – снизить опасность взрыва и детонации чистого NH4NO3. Примером таких добавок может служить углекислый кальций, или попросту мел.