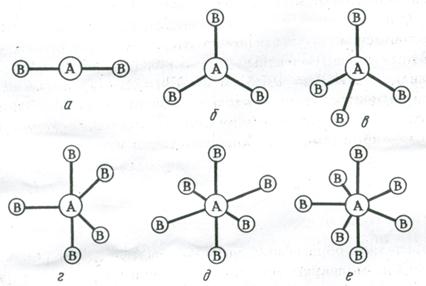
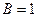Что понимают под направленностью ковалентной связи
Характеристики ковалентной связи
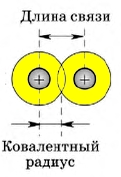
1. Длина ковалентной связи
В симметричных молекулах (H2, F2, Cl2. ) половину длины связи называют ковалентным радиусом. Зная ковалентный радиус, очень легко вычислять длину ковалентной связи в молекуле. Например, длина ковалентной связи молекулы HF = 30 + 58 = 88 пм.
2. Энергия ковалентной связи
Энергии связи некоторых молекул (кДж/моль):
3. Полярность ковалентной связи
Данная характеристика отображает расположение электронной пары двух атомов, образующих связь. Степень полярности связи зависит от величины электроотрицательности атомов, образующих связь (чем она больше, тем больше полярность связи). У более полярной ковалентной связи общая пара электронов больше смещена к более электроотрицательному атому (см. понятие электроотрицательности).
Полярность ковалентной связи оценивается количественно при помощи дипольного момента (µ), при этом система из двух равнозначных, но противоположных по знаку, зарядов, называется диполем.
Очень важно различать дипольный момент ковалентной связи (ее полярность) и дипольный момент молекулы в целом. В простых двухатомных молекулах эти два параметра равны между собой. Совсем другая картина наблюдается в сложных молекулах, в которых дипольный момент молекулы складывается из суммы векторов дипольных моментов отдельных связей.
4. Поляризуемость ковалентной связи
Поляризуемость отображает степень способности электронов смещаться под воздействием внешнего электрического поля, формируемого ионами или другими полярными молекулами.
Поляризуемость и полярность связи являются обратнозависимыми величинами: менее полярная связь больше поляризуется, и наоборот.
5. Насыщаемость ковалентной связи
6. Направленность ковалентной связи
Направленность характеризует пространственную ориентацию ковалентной связи относительно других связей молекулы. В молекулах электроны ковалентных связей и свободные пары электронов постоянно испытывают взаимное отталкивание в результате чего ковалентные связи располагаются так, что валентный угол между ними отвечает принципу наименьшего отталкивания между электронами (например, в молекуле воды валентный угол составляет 104,5°).
7. Кратность ковалентной связи
В некоторых случаях между атомами могут возникать не одна, а две (двойная связь) или три (тройная связь) общих электронных пар (так называемые кратные связи).
Как видно из таблицы, приведенной ниже, молекула азота примерно в 7 раз «крепче» молекулы фтора.
Таблица зависимости длины и прочности ковалентной связи от ее кратности:
| Молекула | F2 | O2 | N2 |
|---|---|---|---|
| Кратность связи | одинарная | двойная | тройная |
| Прочность связи (энергия), кДж/моль | 139 | 494 | 942 |
| Длина связи, пм | 141 | 121 | 109 |
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Направленность ковалентной связи
Направленность ковалентной связи это

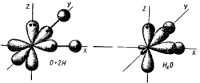
Поэтому в молекулах H2S, H2Se и Н2Те (радиусы центральных атомов в этом ряду возрастают) углы между связями последовательно снижаются, приближаясь к теоретическому смотрим рис. 2.
Аналогичное рассмотрение схемы образования молекул аммиака NH3 приводит к заключению, что они имеют пирамидальную форму, а углы между связями N—Н
Рис. 18. Образование молекулы воды.
Направленность ковалентной связи



Согласно МВС наиболее прочные химические связи возникают в направлении максимального перекрывания атомных орбиталей. Поскольку атомные орбитали имеют определённую форму, их максимальное перекрывание возможно при определённой пространственной ориентации, поэтому ковалентная связь характеризуется направленностью. Иначе говоря, направленность заключается в том, что максимальное перекрывание валентных электронных облаков взаимодействующих атомов возможно при определенной их взаимной ориентации. Направленность ковалентной связи определяет пространственную конфигурацию молекул.
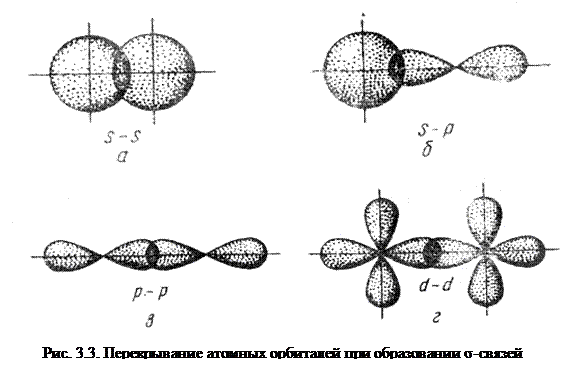
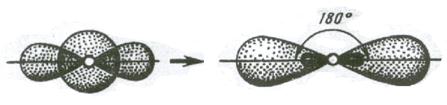
Простейший случай σ – связи наблюдается у молекулы Н2, образующейся за счет перекрывания s-орбиталей атомов водорода (s-s перекрывание, рис. 3.4). Геометрическая форма молекулы линейная.
Рассмотрим образование молекулы HCl.
Исходя из стехиометрического состава молекулы HCl и валентности водорода, равной единице, мы видим, что хлор, находясь в невозбужденном состоянии, проявляет валентность В=1 (в возбужденном состоянии хлор проявляет валентности 3, 5, 7). При образовании молекулы HCl происходит перекрывание s – орбитали атома водорода с р – орбиталью атома хлора (s – р перекрывание). Молекула имеет линейную форму (рис. 3.5). Очевидно, такие же линейные молекулы должны образовать с водородом аналоги 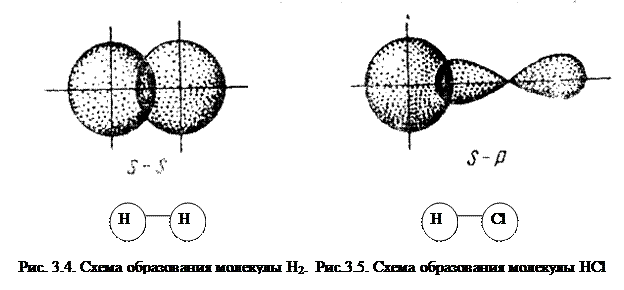
Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется π-связью. Пи-связь может образовываться при перекрывании р – р-орбиталей (рис. 3.6, a), p – d-орбиталей (рис. 3.6,б), d – d-орбиталей (рис. 3.6,в), а также f – p-, f – d- и f – f-орбиталей.
Связь, образованная перекрыванием d-орбиталей всеми четырьмя «лепестками» называется δ-связью (дельта-связью, рис. 3.7).
Соответственно, s-элементы могут образовывать только σ-связи, р-элементы – σ- и π-связи, d-элементы – σ-, π- и δ-связи, а f-элементы – σ-, π-, δ- и еще более сложные связи. В связи с меньшим перекрыванием АО прочность у π- и δ-связей ниже, чем у σ-связей.
Рис. 3.7. Направления перекрывания атомных d – орбиталей при образовании δ-связей
При наложении π-связи на σ-связь образуется двойная связь, например в молекулах кислорода, этилена, диоксида углерода.
Кратная связь изображается двумя черточками: О =О, С = С, О = С = О.
Хотя энергия π-связи меньше, чем энергия σ-связи, однако суммарная энергия двойной связи выше энергии одинарной связи, а длина двойной связи меньше длины одинарной связи.
При наложении двух π-связей на σ-связь возникает тройная связь, например в молекулах азота, ацетилена и оксида углерода. Тройная связь изображается тремя черточками: N ≡ N, ─ C ≡ C ─, C ≡ O. Энергия тройной связи выше, а длина связи ниже, чем энергии и длины простой и двойной связей.
Число связей между атомами в МВС называется кратностью связи. Примером образования кратной связи может служить молекула азота N2.
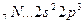

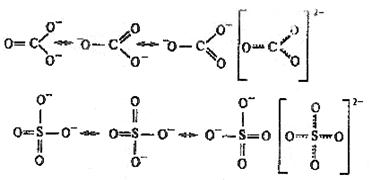
В действительности в чистом виде не существует ни та, ни другая структура, а гибридная структура, в которой π – электроны не принадлежат двум конкретным атомам, а всей молекуле в целом. Пи-связи в молекулах или ионах, у которых возможно несколько способов локализации связей между атомами, называются делокализованными связями, обозначаемыми пунктиром:
Приведенная структура называется резонансной.
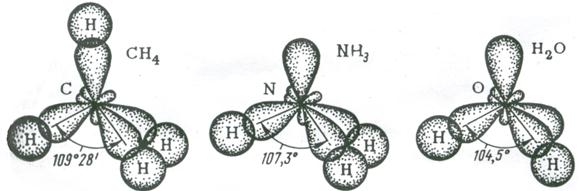
Пространственные формы молекул весьма разнообразны. Так, молекула СО2 имеет линейную структуру, молекула СН4 – тетраэдрическую, молекула NH3 – пирамидальную, воды – угловую, SO3 – треугольную.
Для объяснения пространственной конфигурации молекул используется модель (теория) гибридизации атомных орбиталей.
Гибридизация атомных орбиталей.В молекуле метана СН4 существуют четыре связи С – Н, имеющие одинаковые длины и энергии. Между тем у углерода в возбужденном состоянии имеются три р- и одна s-орбитали с неспаренными электронами, которые перекрываются s-орбиталями водорода. Исходя из этого, можно было бы ожидать, что характеристики одной из связей в молекуле метана будут отличаться от характеристик других связей. В действительности, все четыре связи в молекуле метана равноценны.
Для объяснения данного факта американский ученый Л. Полинг разработал теорию о гибридизации атомных орбиталей. Основные положения теории гибридизации АО:
1. Если у атома, вступающего в химическую связь, имеются разные АО (s-, р-, d- или f-АО), то в процессе образования химической связи происходит гибридизация (смешение) АО, т.е. из разных АО образуются одинаковые (эквивалентные) АО. Следует подчеркнуть, что гибридные АО образуются у одного атома, имеющего разные орбитали. Причем гибридизация происходит у орбиталей, имеющих близкие значения энергии.
Иначе говоря, гибридизация – выравнивание по форме и энергии АО (облаков) с образованием новых АО, одинаковых по форме и энергии. Новые облака называются гибридными, их число равно сумме АО, участвующих в гибридизации.
Следует отметить, что как физический процесс, гибридизация орбиталей не существует. Теория гибридизации АО – это удобный и наглядный прием описания сложных процессов, происходящих при образовании химических соединений.
2. Форма гибридной АО отличается от формы исходных АО (рис. 3.9). В гибридной АО электронная плотность смещается в одну сторону от ядра, поэтому при взаимодействии ее с АО другого атома происходит максимальное перекрывание, которое приводит к повышению энергии связи. Это повышение энергии связи компенсирует энергию, требуемую на образование гибридной орбитали. В результате химические связи, образованные гибридными орбиталями, прочнее, а полученная молекула более устойчива.
Пространственная конфигурация молекул. Характер гибридизации валентных орбиталей центрального атома и их пространственное расположение определяют пространственную конфигурацию (геометрическую форму) молекул:
1. Если в химическую связь вступает атом, у которого на внешней оболочке имеется s- и р – электроны, то у данного атома в процессе образования связи происходит sp – гибридизация АО (рис. 3.10).
(s+p) орбитали Две sp – орбитали
Рис. 3.10. Схема sp – гибридизации
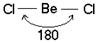
Две sp – гибридные орбитали расположены симметрично под углом 180˚, отсюда и связи, образуемые с участием электронов этих орбиталей, также располагаются под углом 180˚. Например, у атома бериллия sp – гибридизация орбиталей проявляется в молекуле BeCl2, которая вследствие этого имеет линейную форму (рис. 3.13,а)
s-p – гибридизация характерна для атомов элементов II группы периодической системы (Be, Mg, Cd, Hg и т. д.), для углерода в СО2, в органических соединениях с тройной углерод – углеродной связью.
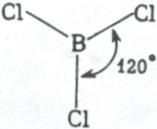
2. Если у атома, вступающего в химическую связь, на внешней оболочке имеется один s- и два p- электрона, то происходит sp 2 – гибридизация АО орбиталей этого атома (рис. 3.11).
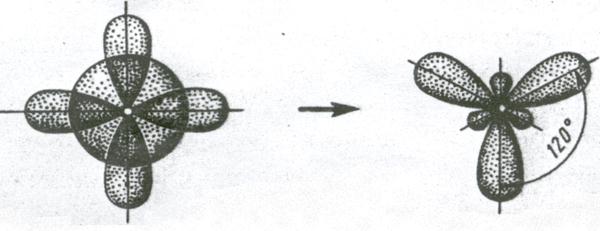
Три sp 2 – гибридные орбитали расположены под углом 120˚. Под таким же углом располагаются и связи, образованные с участием электронов этих орбиталей. Например, вследствие sp 2 – гибридизации орбиталей атома бора молекула BCl3 имеет треугольную форму (рис. 3.13, б). Распределение химических связей можно представить следующей схемой:
sp 2 – гибридизация встречается в молекулах элементов III группы периодической системы, а также в органических соединениях с двойной углерод – углеродной связью.
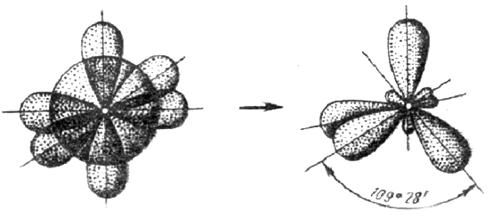
3. У атома, имеющего на внешней оболочке один s- и три р- электрона, при химическом взаимодействии происходит sp 3 – гибридизация этих АО (рис. 3.12).
(s+p+p+p) – орбитали Четыре sp 3 – орбитали
Рис. 3.12. Схема sp 3 – гибридизации
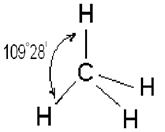
Четыре sp 3 – гибридные орбитали симметрично ориентированы в пространстве под углом 109˚28′ к четырем вершинам тетраэдра (рис. 3.13, в). Тетраэдрическое расположение связей и форма тетраэдра характерны для элементов IV группы, в том числе для многих соединений углерода, например, CH4:
4. Возможны также более сложные виды гибридизации с участием d- и f- орбиталей атомов, при которых образуются молекулы ещё более сложной конфигурации.
Рис. 3.13. Пространственное расположение связей и конфигурация молекул:
а – линейная; б – треугольная; в – тетраэдрическая; г – тригонально-бипирамидальная; д – октаэдрическая; е – пентагонально-бипирамидальная
Влияние несвязывающей электронной пары центрального атома на строение молекул. Рассмотренная выше теория гибридизации орбиталей центрального атома (обозначен в общих формулах через А) применима к большому количеству молекул и ионов. Однако для ряда молекул и ионов, особенно имеющих несимметричное строение, рассмотренных представлений оказывается недостаточно. В подобных случаях применяют теорию полной гибридизации (Джиллеспи), в которой и связывающие, и неподеленные электронные пары центрального атома подвергаются sp 3 – гибридизации. sp 3 – гибридизация центральных атомов имеет место в молекулах NH3, H2O и им подобным, образованным их электронными аналогами.
У атома азота на четыре sp 3 – гибридные орбитали приходятся пять электронов.
Рис. 3.14. Перекрывание валентных орбиталей в молекулах CH4, NH3, H2O
В представлениях теории гибридизации уменьшение валентного угла НЭН в ряду СН4 (109,5˚) – NH3 (107,3˚) – H2O (104,5˚) объясняется следующим образом. В ряду С-N-О энергетическое различие между 2s- и 2р – орбиталями увеличивается, поэтому вклад 2s-орбиталей при гибридизации с 2р-орбиталями уменьшается. Это приводит к уменьшению валентного угла и постепенному приближению его к 90˚.
Ковалентная связь
Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Позднее (1927 год) Ф.Лондон и В.Гайтлер на примере молекулы водорода дали первое описание ковалентной связи с точки зрения квантовой механики.
С учётом статистической интерпретации волновой функции М.Борна плотность вероятности нахождения связывающих электронов концентрируется в пространстве между ядрами молекулы (рис.1). В теории отталкивания электронных пар рассматриваются геометрические размеры этих пар. Так, для элементов каждого периода существует некоторый средний радиус электронной пары (Å):
0,6 для элементов вплоть до неона; 0,75 для элементов вплоть до аргона; 0,75 для элементов вплоть до криптона и 0,8 для элементов вплоть до ксенона. [3]
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер. Ковалентная связь это когда два атома делятся электронами и держатся вместе.
Содержание
Образование связи
Ковалентная связь образуется парой электронов, поделённой между двумя атомами, причём эти электроны должны занимать две устойчивые орбитали, по одной от каждого атома. [4]
В результате обобществления электроны образуют заполненный энергетический уровень. Связь образуется, если их суммарная энергия на этом уровне будет меньше, чем в первоначальном состоянии (а разница в энергии будет ни чем иным, как энергией связи).
Согласно теории молекулярных орбиталей, перекрывание двух атомных орбиталей приводит в простейшем случае к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей (разрыхляющей) МО. Обобществленные электроны располагаются на более низкой по энергии связывающей МО.
Образование связи при рекомбинации атомов
Атомы и свободные радикалы склонны к рекомбинации — образованию ковалентной связи путём обобществления двух неспаренных электронов, принадлежащих разным частицами [4]
Образование связи при рекомбинации сопровождается выделением энергии. Так, при взаимодействии атомов водорода выделяется энергия в количестве 436 кДж/моль. Этот эффект используют в технике при атомно-водородной сварке. Поток водорода пропускают через электрическую дугу, где генерируется поток атомов водорода. Атомы затем вновь соединяются на металлической поверхности, помещаемой на небольшое расстояние от дуги. Металл может быть таким путём нагрет выше 3500° C. Большим достоинством «пламени атомного водорода» является равномерность нагрева, позволяющая сваривать очень тонкие металлические детали. [5]
Однако, механизм межатомного взаимодействия долгое время оставался неизвестным. Лишь в 1930 г. Ф.Лондон ввёл понятие дисперсионное притяжение — взаимодействие между мгновенным и наведённым (индуцированными) диполями. В настоящее время силы притяжения, обусловленные взаимодействием между флуктуирующими электрическими диполями атомов и молекул носят название «Лондоновские силы».
Энергия такого взаимодействия прямо пропорциональна квадрату электронной поляризуемости α и обратно пропорциональна расстоянию между двумя атомами или молекулами в шестой степени. [6]
Образование связи по донорно-акцепторному механизму
При сближении ионов двухэлектронное облако (электронная пара) гидрид-иона притягивается к протону и в конечном счёте становится общим для обоих ядер водорода, то есть превращается в связывающую электронную пару. Частица, поставляющая электронную пару, называется донором, а частица, принимающая эту электронную пару, называется акцептором. Такой механизм образования ковалентной связи называется донорно-акцепторным. [7]
Распределение электронной плотности между ядрами в молекуле водорода одно и то же, независимо от механизма образования, поэтому называть химическую связь, полученную по донорно-акцепторному механизму, донорно-акцепторной связью не корректно.
В качестве донора электронной пары, кроме гидрид-иона, выступают соединения элементов главных подгрупп V—VII групп периодической системы элементов в низшей степени окисления элемента. Так, ещё Йоханнес Брёнстед установил, что протон не существует в растворе в свободном виде, в воде он образует катион оксония:
Протон атакует неподелённую электронную пару молекулы воды и образует устойчивый катион, существующий в водных растворах кислот. [8]
Аналогично происходит присоединение протона к молекуле аммиака с образованием комплексного катиона аммония:
Таким путём (по донорно-акцепторному механизму образования ковалентной связи) получают большой класс ониевых соединений, в состав которого входят аммониевые, оксониевые, фосфониевые, сульфониевые и другие соединения. [9]
В качестве донора электронной пары может выступать молекула водорода, которая при контакте с протоном приводит к образованию молекулярного иона водорода H3 + :
Связывающая электронная пара молекулярного иона водорода H3 + принадлежит одновременно трём протонам.
Виды ковалентной связи
Существуют три вида ковалентной химической связи, отличающихся механизмом образования:
1. Простая ковалентная связь. Для ее образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
2. Донорно-акцепторная связь. Для образования этого вида ковалентной связи оба электрона предоставляет один из атомов — донор. Второй из атомов, участвующий в образовании связи, называется акцептором. В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу.
3. Семиполярная связь.Её можно рассматривать как полярную донорно-акцепторную связь. Этот вид ковалентной связи образуется между атомом, обладающим неподелённой парой электронов (азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера). Образование семиполярной связи протекает в два этапа:
1. Перенос одного электрона от атома с неподелённой парой электронов к атому с двумя неспаренными электронами. В результате атом с неподелённой парой электронов превращается в катион-радикал (положительно заряженная частица с неспаренным электроном), а атом с двумя неспаренными электронами — в анион-радикал (отрицательно заряженная частица с неспаренным электроном). 2. Обобществление неспаренных электронов (как в случае простой ковалентной связи).
При образовании семиполярной связи атом с неподелённой парой электронов увеличивает свой формальный заряд на единицу, а атом с двумя неспаренными электронами понижает свой формальный заряд на единицу.
σ-связь и π-связь
Сигма (σ)-, пи (π)-связи — приближенное описание видов ковалентных связей в молекулах различных соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов. При образовании 
В молекуле этилена С2Н4 имеется двойная связь СН2=СН2, его электронная формула: Н:С::С:Н. Ядра всех атомов этилена расположены в одной плоскости. Три электронных облака каждого атома углерода образуют три ковалентные связи с другими атомами в одной плоскости (с углами между ними примерно 120°). Облако четвертого валентного электрона атома углерода располагается над и под плоскостью молекулы. Такие электронные облака обоих атомов углерода, частично перекрываясь выше и ниже плоскости молекулы, образуют вторую связь между атомами углерода. Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют 
В линейной молекуле ацетилена
имеются σ-связи между атомами углерода и водорода, одна σ-связь между двумя атомами углерода и две 

Все шесть атомов углерода циклической молекулы бензола С6H6 лежат в одной плоскости. Между атомами углерода в плоскости кольца действуют σ-связи; такие же связи имеются у каждого атома углерода с атомами водорода. На осуществление этих связей атомы углерода затрачивают по три электрона. Облака четвертых валентных электронов атомов углерода, имеющих форму восьмерок, расположены перпендикулярно к плоскости молекулы бензола. Каждое такое облако перекрывается одинаково с электронными облаками соседних атомов углерода. В молекуле бензола образуются не три отдельные 

Примеры веществ с ковалентной связью
Кристаллы с ковалентной связью диэлектрики или полупроводники. Типичными примерами атомных кристаллов (атомы в которых соединены между собой ковалентными (атомными) связями могут служить алмаз, германий и кремний.
Единственным известным человеку веществом с примером ковалентной связи между металлом и углеродом является цианокобаламин, известный как витамин B12.