Как выглядит бактериофаг под микроскопом
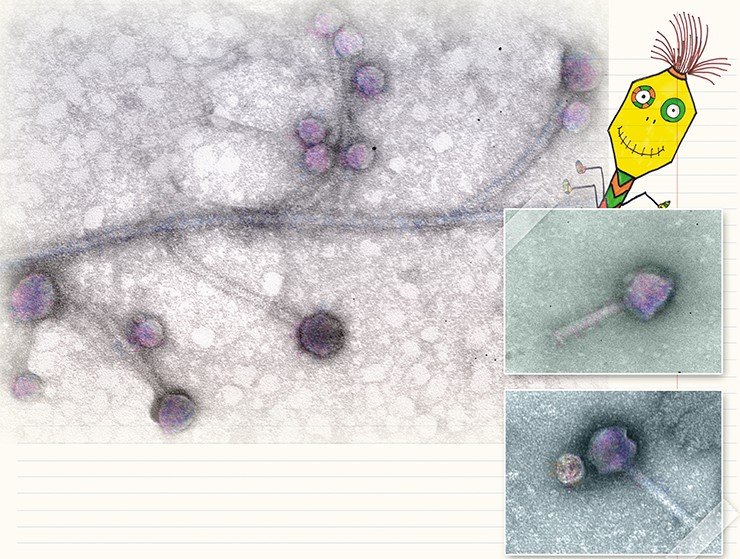
Гелиевый микроскоп показал «пир» бактериофагов
Бактериофаги (зеленые) атакуют кишечные палочки (синие)
I. J. Maasilta et al. / University of Jyvaskyla
Физики из Университета Ювяскюля использовали гелиевую микроскопию для детального исследования активности бактериофагов. В этой методике вместо сфокусированного пучка электронов (как в электронном микроскопе) используется пучок ионов гелия. Авторы получили снимки различных стадий инфицирования бактерий вирусами, а также смогли использовать микроскоп для того, чтобы делать микроскопические надрезы на бактериях. В отличие от электронной микроскопии гелиевые исследования не требуют дополнительных манипуляций с образцами, скрывающих часть деталей процесса. Исследование опубликовано в журнале Advanced Biosystems, кратко о нем сообщает Physics World. Также доступен постер авторов с описанием работы и фотографиями.
Главным ограничением для оптической микроскопии является дифракционный предел — он не позволяет сфокусировать пятно света в точку размером меньше половины длины волны. Видимый свет имеет длину волны порядка сотен нанометров, а значит увидеть с помощью обычного микроскопа вирусы и другие наноразмерные объекты практически невозможно. Для этого потребуются волны с меньшей длиной волны — например, электронные пучки (которые проявляют как волновые свойства, так и свойства характерные для частиц). Так как электрон — массивная частица, его длина волны оказывается гораздо короче, чем у света. Это свойство используется в электронных микроскопах. Роль линз в них играют магниты, искажающие траектории частиц. Сфокусированный пучок электронов попадая на поверхность выбивает из нее вторичные электроны, которые и регистрирует прибор. На основе этих данных строится картина поверхности образца.
Но и у сканирующего электронного микроскопа есть свои ограничения и недостатки. Во многих ситуациях с его помощью можно исследовать лишь проводящие объекты — поэтому образцы часто приходится покрывать тонкой пленкой металла.
Авторы новой работы использовали для визуализации биологических систем более совершенный прибор — микроскоп на ионах гелия. Гелий примерно в семь тысяч раз массивнее электрона, а значит обладает гораздо меньшей длиной волны и с его помощью можно добиться более высокого разрешения. Кроме того, с его помощью можно исследовать и не проводящие электричество объекты. Как и в обычном электронном микроскопе ионы гелия выбивают из образца вторичные электроны, которые регистрирует микроскоп. Помимо разрешения, гелиевый микроскоп позволяет добиться большей глубины резкости в изображении.
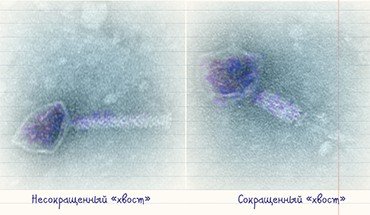
Три стадии атаки бактериофага на бактерию: a — прикрепление, b — сжатие ствола, c — выход новых вирионов
I. J. Maasilta et al. / University of Jyvaskyla
Что в голове у бактериофага

Геном фага Т4 огромен, он содержит 168 903 пар нуклеотидов — всего в 30 раз меньше, чем геном его хозяина, кишечной палочки Escherichia coli. Для сравнения, длина генома папилломавируса человека — 8000 пар нуклеотидов. Что же кодирует такая длинная ДНК бактериофага и как она вообще умещается в головку вируса?
Фаг Т4 — один из самых сложно устроенных вирусов. Он несет в своей ДНК около 300 белок-кодирующих генов, причем из них только 69 необходимы ему для выживания в стандартных условиях лаборатории. Большинство белков фага Т4 не похожи на известные белки других организмов. Но есть и такие, чьи родственники найдены у прокариот и эукариот. Функции многих белков этого вируса до сих пор не установлены, одна только головка состоит по крайней мере из 12 типов белков. Кроме белков, ДНК бактериофага кодирует несколько транспортных РНК и коротких регуляторных РНК — свойство, обычное для самостоятельных организмов, но не распространенное среди вирусов.

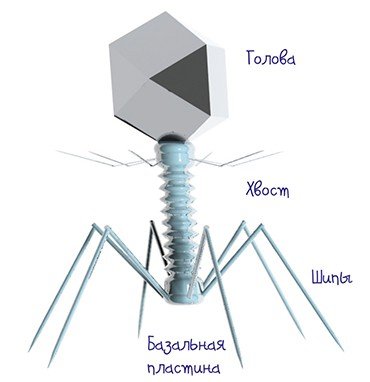
Модель бактериофага Т4, разными цветами показаны белки. От головки вируса отходит длинная трубка — белковый чехол хвоста. Снизу к чехлу прикреплена базальная пластинка с шипами (фиолетовая), от которой отходят «ножки» — фибриллярные нити, с их помощью вирус удерживается на бактерии. Когда бактериофаг закрепляется на клеточной стенке жертвы, чехол сокращается, находящийся внутри стержень пробивает стенку и впрыскивает нуклеиновую кислоту из головки внутрь клетки бактерии. Изображение с сайта prophage.blogspot.com
В ходе инфекции бактериофаг Т4 полностью переключает работу клеточных систем хозяина на свои нужды. В этом паразиту помогают собственные ферменты для синтеза нуклеотидов, репликации (удвоения) и репарации (починки от повреждений) ДНК и множество других белков. Например, у Т4 есть белок, который попадает в бактерию вместе с ДНК фага и на ранних этапах инфекции модифицирует РНК-полимеразу (основной белок транскрипции — «переписывания» генетической информации с ДНК на РНК) бактерии так, что фермент охотнее взаимодействует с ДНК вируса, чем с ДНК клетки. Это способствует синтезу белков, необходимых фагу в начале инфекции. Позже другой белок модифицирует полимеразу так, что она начинает охотнее взаимодействовать с генами фага Т4, нужными на следующем этапе. И наконец, после очередной модификации, РНК-полимераза бактерии начинает взаимодействовать с так называемыми «поздними» генами Т4.
Другой интересный пример — белок, который встраивается во внутреннюю мембрану клетки-хозяина (у кишечной палочки, как у любой уважающей себя грамотрицательной бактерии, есть две клеточные мембраны) и не дает генетической информации других бактериофагов попасть внутрь. Есть у Т4 и белки, разрезающие ДНК бактерии-хозяина и проникших в нее других бактериофагов. С ДНК Т4 эти белки они не связываются, поскольку в ее состав вместо нуклеотида цитозина входит модифицированный гидроксиметилцитозин.
Отдельного внимания заслуживают белки, необходимые для синтеза новых вирионов (вирусных частиц) и для упаковки в них ДНК. Более 40% белков фага Т4 вовлечены в сборку вириона, состоящего из головки и сокращающегося хвоста с хвостовыми нитями для прикрепления к бактерии. Вирион устроен так сложно, что у Т4 есть специальные «белки строительных лесов», создающие каркас для сборки головки и удаляющиеся из нее при созревании.
Пока точно не известно, каким образом настолько огромная молекула ДНК укладывается в вирусной головке. Зато известно, что она затаскивается внутрь действием белкового «мотора», что сопряжено с гидролизом «энергетической молекулы» — АТФ. Весь геном Т4 проталкивается в головку за пять минут.
Современная модель упаковки ДНК в головку бактериофага Т4
Ученые уже пытаются «научить» Т4 упаковывать в свою головку чужеродные нуклеиновые кислоты или белки. Предполагают, что таким образом можно доставлять молекулярные грузы в конкретные эукариотические клетки.
О криоэлектронном микросопе см. также:
Нобелевская премия по химии — 2017, «Элементы», 12.10.2017.
О бактериофагах см. также:
Бактериофаги: 100 лет на службе человечеству, «Наука из первых рук» №4, 2016.
Пожиратели бактерий, «Популярная механика» №10, 2013.
Бактериофаг, мы тебя видим!
Прошло сто лет с того времени, как английский микробиолог Ф. Туорт отметил прозрачные стекловидные пятна в колониях микрококков, где погибли бактериальные клетки. После открытия бактериофагов их исследования долгое время имели феноменологический характер из-за недостаточного развития экспериментальных методов. Ученые не имели возможности детально изучить особенности противобактериального воздействия бактериофагов, так как последние нельзя увидеть не только невооруженным глазом, но и с помощью светового микроскопа. Изучение вирусов, в том числе вирусов бактерий, вышло на принципиально новый уровень лишь с созданием и внедрением в научную практику электронного микроскопа
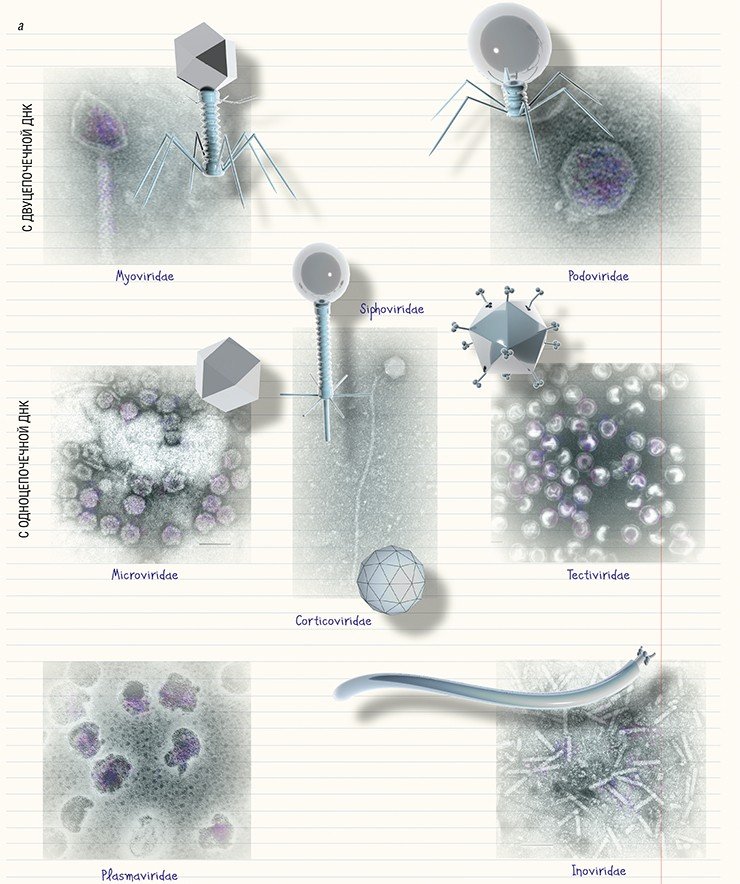
С появлением электронной микроскопии стало понятно, что бактериофаги являются даже не микро- а наноорганизмами, так как их размеры не превышают 100 нм. Также оказалось, что по своему строению они отличаются колоссальным разнообразием. Соответственно, возник вопрос об их номенклатуре. В основу первой классификации, которая была предложена еще в 1943 г., легли особенности строения фагов, установленные с помощью электронной микроскопии. Один из ее основоположников, Э. Руска, в своей общей схеме классификации вирусов выделил бактериофаги отдельно, разделив их на три типа по морфологическим характеристикам (Ackermann, 2009).
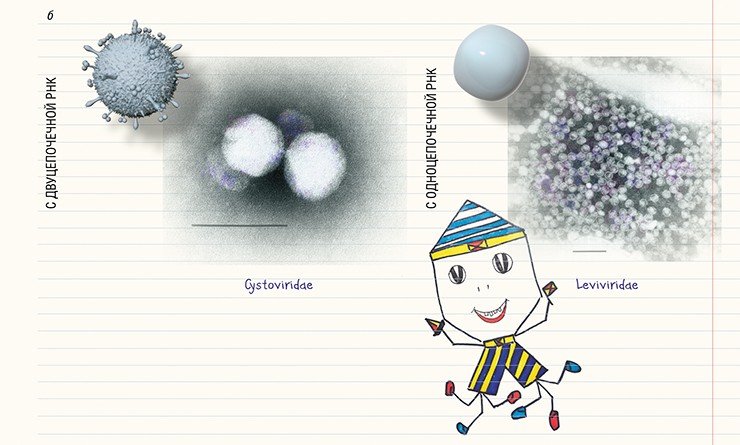
В основу современной систематики бактериофагов, созданной в 1967 г., легла классификация, включавшая шесть морфотипов. Но по мере открытия новых бактериофагов в нее включались новые семейства, роды и виды. С развитием методов молекулярной биологии появились дополнительные критерии классификации, учитывающие тип нуклеиновой кислоты и (или) композицию белков в составе фага.
Применение в исследованиях бактериофагов современных молекулярных методов, позволило выявить множество особенностей этих интересных организмов. Сами бактериофаги в свою очередь оказались для молекулярных биологов очень полезным методологическим инструментом (Brussow, 2013).
Была бы голова, а хвост будет
На сегодняшний день с помощью электронной микроскопии описано свыше 6,3 тыс. бактериофагов (Ackerman, Tiekotter, 2012; Ackermann, Prangishvili, 2012). Оказалось, что далеко не у всех бактериофагов можно четко выделить «голову» и «хвост», а что касается их наследственного материала, то наиболее часто встречаются фаги с двуцепочечной ДНК. Систематика бактериофагов очень динамична, поскольку регулярно обнаруживаются новые фаги (Ackermann, 2007).
Охота на бактерию
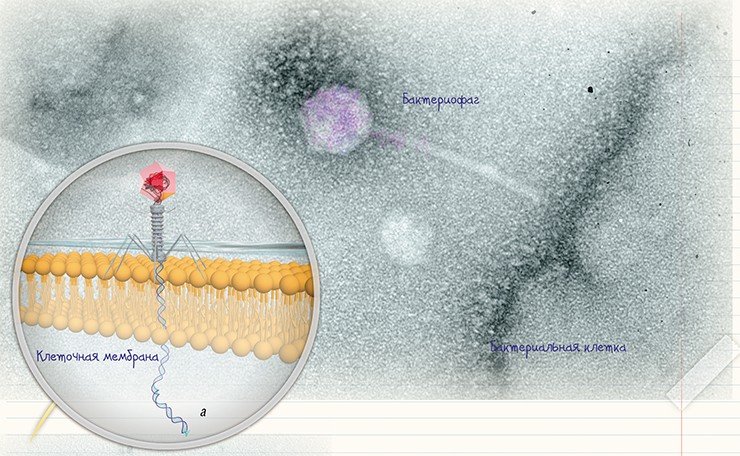
Совершенствование методов электронной микроскопии позволило визуализировать не только сами бактериофаги, но и процесс их размножения. Наиболее детально исследован процесс проникновения в клетку «хвостатых» бактериофагов, описаны молекулярные механизмы «впрыскивания» фаговой ДНК в цитоплазму бактериальной клетки (Guerrero-Ferreira, Wright, 2013).
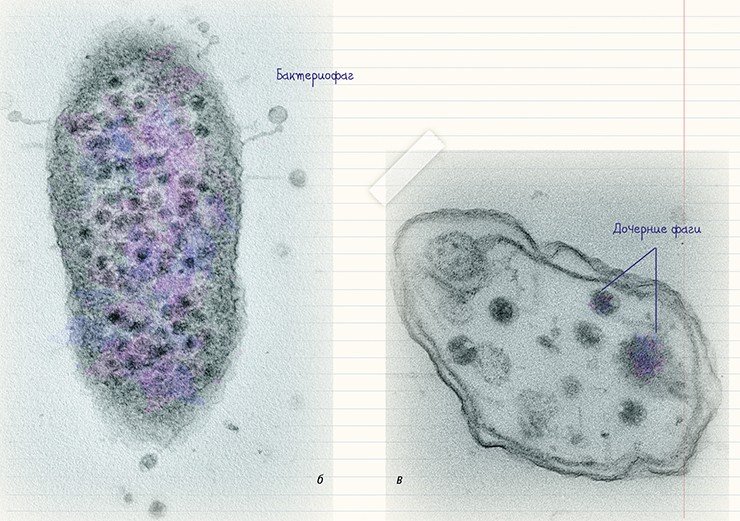
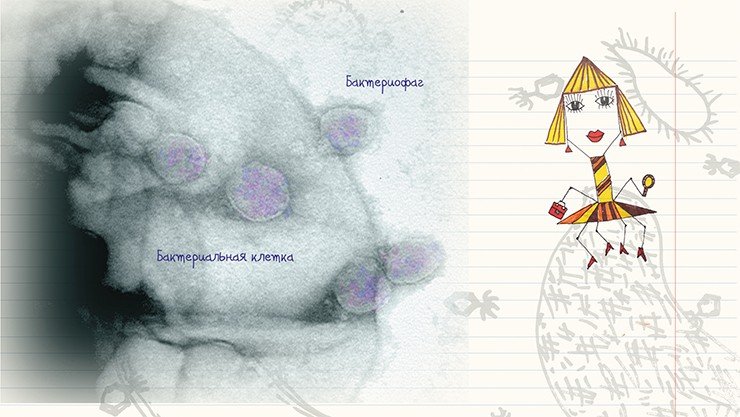
Типичное поведение бактериофага при «нападении» на бактерию можно проследить на примере лизирующего фага. Сначала фаг прикрепляется к поверхности бактерии, используя ее рецепторы в качестве «якоря». Затем его «хвост» с помощью специальных белков внедряется в бактериальную стенку – образуется «канал», по которому нуклеиновая кислота фага вбрасывается в клетку. В течение следующего получаса в клетке бактерии происходит синтез белковых и нуклеиновых компонентов фагов и сборка новых фаговых частиц. После этого клетка разрушается, освобождая зрелые вирионы.
Сочетание методов негативного контрастирования и ультратонких срезов* позволяет проследить все этапы воспроизводства бактериофагов, включая сорбцию частиц фага на поверхности бактериальных клеток, их проникновение в клетки и копирование. К сожалению, эта область исследований разработана существенно хуже, чем визуализация и идентификация бактериофагов методом негативного контрастирования. Между тем ультраструктурные характеристики каждого из этапов жизненного цикла бактериофагов могут быть полезны для адекватной оценки эффективности разрабатываемых методов фаговой терапии.
Бактериофаги, несомненно, представляют собой уникальное явление на нашей планете: с одной стороны, они просто устроены, с другой – характеризуются колоссальным разнообразием как своей морфологии, так и своих потенциальных «жертв».
Для нас эти наноорганизмы не только безопасны, но и «дружествены», так как способны убивать патогенные бактериальные клетки, не затрагивая при этом клетки высших организмов, включая человека, а также сельскохозяйственных животных или растений. Это свойство позволяет использовать бактериофаги для терапии бактериальных инфекций, следуя принципу «враг моего врага – мой друг».
Перспективность фаговой терапии определяется не только самим фактом уничтожения бактерий фагами, но и высокой специфичностью взаимодействия фаг-«хозяин». Наконец, поскольку речь идет о природном феномене, человек может воздействовать на патогенные бактерии, не применяя вредные химические агенты.
* При методе ультратонких срезов клетки заливают в особую смолу, и из получившихся твердых блоков готовят срезы толщиной 60—80 нм на ультрамикротоме с помощью стеклянного или алмазного ножа
Ackermann H. W., Prangishvili D. Prokaryote viruses studied by electron microscopy. 2012. N. 157. P. 1843—1849.
Ackermann H. W., Tiekotter K. L., Murphy’s law – if anything can go wrong, it will // Bacteriophage. 2012. N. 2:2. P. 122—129.
Bacteriophages methods and protocols / Ed. A. M. Kropinski, R. J. Clokie. Humana Press, 2009. V. 1.
Duckworth D. H. Who discovered bacteriophage? // Bacteriological reviews. 1976. V. 40. N. 4. P. 793—802.
Introduction: a short history of virology // Viruses and man: a history of interactions / Ed. M. W. Taylor. Springer, 2014. P. 1—21.
Krylov V. N. Phage therapy in therms of Bacteriophage genetics: hopes, prospects, safety, limitation // Rus. J. of genetics. 2001. V. 37. N. 7. P. 869—887.
Matsuzaki S., Rashel M., Uchiyama J., et al. Bacteriophage therapy: a revitalized therapy against bacterial infectious deseases // J. Infect. Chemother. 2005. N. 11. P. 211—219.
В публикации использованы фото авторов и рисунки Жени Власова
Бактериофаги
БАКТЕРИОФАГИ КАК АЛЬТЕРНАТИВА АНТИБИОТИКАМ В ЛЕЧЕНИИ ИНФЕКЦИЙ
Бактериофаги — вирусы бактерий, естественные микроорганизмы, которые, размножаясь внутри бактериальной клетки, ведут к ее быстрой гибели.
Из истории открытия
В 1896 году английский бактериолог Э. Ханкин, исследуя антибактериальное действие воды индийских рек, пришел к выводу о существовании агента, проходящего через бактериальные фильтры и вызывающего лизис холерных вибрионов. Российский микробиолог Н. Ф. Гамалея в 1897 году наблюдал лизис бацилл сибирской язвы. Однако первой научной публикацией о фагах стала статья английского микробиолога Ф. Туорта, в которой он в 1915 году описал инфекционное поражение стафилококков, значительно изменявшее морфологию колоний. В 1917 году канадский бактериолог Ф. Д’Эрелль независимо от Туорта сообщил об открытии вируса, «пожирающего» бактерии — бактериофага.
Интересный факт: при нанесении бактериофага на влажные слизистые он за 20 минут очищает их от определенного вида бактерий, например от стафилококка. Так быстро не работает ни один антибиотик.
Действие бактериофагов отличается от действия антибиотиков:
В лаборатории KDL предлагается 2 варианта посевов на флору с определением чувствительности выделенной культуры микроорганизма к препаратам бактериофагов и разным наборам антибиотиков в зависимости от ситуации пациента (выбирает врач), например:
Какие инфекции можно лечить бактериофагами:
Возбудителями этих инфекций могут быть такие бактерии, как золотистый стафилококк, синегнойная палочка, патогенные формы кишечной палочки, сальмонеллы, стрептококки.
В Новосибирском научном центре технологии персонализированного лечения бактериофагами в большой коллекции бактериофагов есть уникальные штаммы, способные бороться с недавно появившимися и уже получившими широкое распространение возбудителями больничных инфекций, такими как грамотрицательные бактерии Acinetobacter baumanii, Stenotrophomonas maltophilia и др.
Последние годы ознаменовались широкими исследованиями бактериофагов из-за нарастающей проблемы антибиотикорезистентности микроорганизмов, которые находят всё новые применения не только в терапии и профилактике, но и в биотехнологиях. Их очевидным практическим результатом должно стать возникновение нового мощного направления персонализированной медицины, а также создание целого спектра технологий в пищевой промышленности, ветеринарии, сельском хозяйстве и в производстве современных материалов. Мы ждем, что второе столетие исследований бактериофагов принесет не меньше открытий, чем первое.
Что такое бактериофаги
Поделиться:
Инфекционные заболевания были бичом человечества до того момента, как начали появляться антибактериальные препараты. Обычно новую эру связывают с именем Флеминга и пенициллином. Однако на десять лет раньше было сделано открытие, которое, возможно, еще пригодится всем нам в будущем.
Убить убийцу
Говорят, война — это всегда огромный скачок в развитии хирургии. На самом деле не только: военные действия нередко способствовали продвижению онкотерапии и терапии инфекционных болезней.
Читайте также:
Медицина в годы ВОВ
Во время 1-й мировой войны канадский врач Феликс Д’Эррель изучал вспышку дизентерии среди солдат-французов. Это неприятное кишечное заболевание вызывается бактериями рода Shigellа, которых легко можно выделить из стула больных.
Врач заинтересовался случаем одного солдата, который полностью выздоровел, причем раньше, чем появилось улучшение у других, кого начали лечить одновременно с ним. Взяв у него пробы стула, Д’Эррель не обнаружил бактерий — что-то загадочное убило их.
Исследователь отфильтровал свой «материал», пропустив его через фильтр с настолько мелкими порами, что через них не могла бы пройти ни одна бактерия или какие-нибудь частицы испражнений. В полученный раствор врач добавил готовую культуру бактерий, взятых от другого больного, высадил все это в чашку Петри и стал ждать.
Читайте также:
Профилактика и лечение острых кишечных инфекций
Через некоторое время начался рост бактериальной культуры, однако колонии были разорванными — словно что-то неведомое разъедало их изнутри. Взяв мазки из «пустых» областей, Д’Эррель добавил их в «хорошие», здоровые колонии шигелл — и в них тоже образовались пустоты.
Практика, обогнавшая теорию
Поскольку к этому моменту наш соотечественник Дмитрий Ивановский уже открыл вирусы, Д’Эррель предположил, что невидимый глазу убийца бактерий относится именно к ним. Понимая важность своего открытия, исследователь дал вирусам, поражающим бактерии, отдельное имя — бактериофаги.
Увидеть фагов удалось только после изобретения электронного микроскопа, а выяснить, чтó именно происходит при их контакте с бактериями, — и того позже. Поэтому в течение многих лет идея Д’Эрреля отвергалась значительной частью ученых, которым было трудно представить себе вирус, поражающий бактерию, но не причиняющий вреда человеку. К тому же опыты канадца удавалось повторить не всем и не всегда.
Однако врач, не дожидаясь никаких теоретических подтверждений своего открытия, перешел к практике. Он не мог, имея в руках лекарство, видеть умирающих людей — и принялся лечить солдат фаговым раствором. Правда, сперва Д’Эррель убедился в его безвредности традиционным для таких энтузиастов способом: сперва пил бактериофаг, затем впрыскивал себе под кожу.
Естественное против искусственного
Выяснив, что для человека бактериофаг совершенно не опасен, Д’Эррель вылечил многих пациентов, что принесло ему известность. Его исследования даже стали основой для художественного романа «Эрроусмит», позднее экранизированного Голливудом. Фаговые лекарства успешно производились и применялись — но уже в 40-х годах энтузиазм начал угасать.
Причиной этого стало открытие Флемингом пенициллина и появление большого числа антибиотиков. Врачи настороженно относились к идее лечения людей с помощью вирусов, а тут у них появилась альтернатива. Антибиотики — химические вещества, полученные искусственно, — не были живыми и казались медикам более надежными. Фармацевтические компании уловили настроения врачебного сообщества и, прекратив выпуск фагов, принялись множить антибиотики.
Бактериофаги сегодня
В наше время, когда антибиотикорезистентность является глобальной и очень опасной проблемой, бактериофаги снова заинтересовали ученых.
У них есть свои недостатки — например, не просто узкий, а суперузкий спектр действия: каждый фаг «умеет» убивать только один штамм бактерий — даже не вид, а штамм. Из-за этого, кстати, и проваливались регулярно попытки повторить эксперименты Д‘Эрреля: дизентерия в двух разных частях армии, идентичная по симптомам и течению, могла быть вызвана разными «вариантами» шигелл.
Однако эту проблему сегодня может решить постепенное распространение такого диагностического метода, как полимеразная цепная реакция (ПЦР), которая точно определит штамм бактерии.
Бактериофаги не могут проникать через стенку клетки, поэтому они пока бессильны против тех возбудителей, которые паразитируют внутриклеточно. «Пока» — потому что активные исследования в этом направлении, возможно, помогут фагам пробираться в самые потаенные места.
А вот среди плюсов бактериофагов с ходу можно выделить два: во-первых, они совершенно безвредны для человека, поскольку вообще никак не взаимодействуют с его организмом — только с бактериями.
И, во-вторых, бактерий они убивают не всех, а значит, не имеют традиционного недостатка применения антибиотиков — возникновения дисбиоза. Так что сегодня бактериофаги стали перспективной областью — и в каком-то смысле новой надеждой человечества.
Товар по теме: [product strict=»(бактериофаг»](бактериофаг)



 Читайте также:
Читайте также: 

