Risdiplam что за препарат
Рисдиплам (Эврисди)
Рисдиплам (Эврисди) – препарат для лечения СМА, разработанный компанией Roche в сотрудничестве с PTC Therapeutics и SMA Foundation.
Рисдиплам является модификатором сплайсинга (генетической модификации) гена SMN2, увеличивающим экспрессию полноразмерных функциональных белков.
Рисдиплам применяется перорально, минует гематоэнцефалический барьер (ГЭБ) и системно воздействует на центральную и периферическую нервную систему.
Регистрация Рисдиплама в России
26 ноября 2020 года Рисдиплам был зарегистрирован и одобрен в России для лечения спинальной мышечной атрофии (СМА) у взрослых и детей с двух месяцев. Таким образом, может применяться без ограничения по типу заболевания в соответствии с назначением врача.
Инструкция к препарату Рисдиплам (Эврисиди)
В целях информирования публикуем официальную инструкцию к препарату на русском языке.
Клинические исследования препарата
Предварительные результаты программы исследований Firefish на детях со СМА 1-го типа (возраста до 6 месяцев)
В конце октября 2020 года на 25 Международном Конгрессе World Muscle Society компания Roche представила обновленные данные результатов 1-ой части программы Firefish. Новые данные, полученные за 2 года исследования части 1 у малышей в возрасте 1-7 месяцев с симптоматической спинальной мышечной атрофией (СМА) 1 типа показали, что младенцы, получавшие терапевтическую дозу рисдиплама (17/21), продолжали улучшать и достигать двигательных вех.
Анализ полученных данных показал, что
Ранее, предварительные результаты 1-ой части программы Firefish исследования препарата рисдиплам (RG7916) на детях со СМА 1-го типа были представлены на прошедшей в июне 2018 года ежегодной конференции Cure SMA.
По данным, представленным Джованни Баранелло, педиатром-неврологом Института Неврологии имени Карло Беста (Милан, Италия), препарат Рисдиплам (RG7916) хорошо переносится во всех использованных в ходе исследования дозировках и побочных эффектов, связанных с приемом препарата, не было выявлено.
Около 90% всех детей на 182-й день приема препарата показали улучшение моторной функции как минимум на 4 пункта по шкале CHOP-INTEND (шкала была специально разработана Детской больницей Филадельфии для оценки двигательных навыков у пациентов со СМА 1-го типа) по сравнению с состоянием на момент начала участия в исследовании. Доктор Баранелло показал видеозаписи, на которых дети-участники исследования демонстрировали антигравитационные движения, способности держать голову, переворачиваться или сидеть, что не свойственно младенцам с 1-м типом СМА.
В исследовании Firefish (часть 1) среднее увеличение по CHOP-INTEND составило 5,5 баллов (n=20) на 56-й день, 12,5 баллов (n=11) на 119-й день, 14 баллов (n=11) на 182-й день лечения соответственно.
Пропорция пациентов, чьи результаты выше, чем 4-х бальное увеличение по CHOP-INTEND, составила 75% (n=20) на 56-й день, 94% (n=16) на 119-й день, 91% (n=11) на 182-й день лечения.
Кроме того, рисдиплам хорошо переносится пациентами вне зависимости от выбранной дозировки и на настоящий момент не было обнаружено ни одного побочного эффекта, связанного с приемом препарата и требующего прекратить его прием.
Ни один ребенок в исследовании не потерял способность глотать, никому из них не потребовалась трахеостомия или постоянная вентиляции легких.
Средний возраст пациентов на начало приема препарата составил 6,7 месяца. Самому старшему пациенту в исследовании на настоящий момент 23.8 месяцев (почти 2 года).
Эврисди ® (Evrisdi)
Владелец регистрационного удостоверения:
Лекарственная форма
Форма выпуска, упаковка и состав препарата Эврисди ®
Порошок для приготовления раствора для приема внутрь от светло-желтого до желтого с сероватым или зеленоватым оттенком или светло-зеленого с желтоватым оттенком цвета.
| 1 фл. | |
| рисдиплам | 60 мг |
Фармакологическое действие
Рисдиплам представляет собой модификатор сплайсинга предшественника матричной рибонуклеиновой кислоты (пре-мРНК) гена выживаемости двигательных нейронов 2 (SMN2), разработанный для лечения спинальной мышечной атрофии (СМА), причиной которой являются мутации в хромосоме 5q, что приводит к недостаточности белка SMN. Недостаточность функционального белка SMN является патофизиологическим механизмом развития СМА всех типов. Рисдиплам корректирует сплайсинг SMN2, сдвигая баланс с исключения экзона 7 на включение экзона 7 в транскрипте мРНК, приводя к образованию функционального и стабильного белка SMN. Таким образом, рисдиплам лечит СМА путем увеличения и сохранения уровней функционального белка SMN.
Рисдиплам равномерно распределяется во всем организме, в т.ч. в ЦНС, проникая через ГЭБ и соответственно приводя к увеличению уровня белка SMN в ЦНС и по всему организму. Концентрации рисдиплама в плазме и белка SMN в крови отражают распределение и фармакодинамические эффекты рисдиплама в тканях, а именно в мышечной ткани и тканях мозга.
Рисдиплам в основном метаболизируется флавин-монооксигеназой 1 и 3 (FMO 1 и 3), а также изоферментами CYP1А1, CYP2J2, CYP3А4 и CYP3А7. Фармакологически неактивный метаболит М1 был определен как основной циркулирующий метаболит.
Рисдиплам
Фармакологическое действие
Рисдиплам — модификатор сплайсинга мРНК, препарат для лечения мышечной атрофии позвоночника (SMA). Увеличивает системную концентрацию функциональной выживаемости белка двигательных нейронов, продуцируемого геном SMN2. Механизм действия аналогичен его предшественнику нусинерсену, наибольшее различие заключается в способе его введения: нусинерсен вводится интратекально, рисдиплам — перорально.
Рисдиплам увеличивает включение экзона 7 в транскрипты рибонуклеиновой кислоты (мРНК) SMN2 и продукцию полноразмерного белка SMN в головном мозге.
Данные in vitro и in vivo показывают, что рисдиплам может также вызывать сплайсинг других генов, включая FOXM1 и MADD, которые участвуют в регуляции клеточного цикла и апоптоза, соответственно, что может объяснять ряд неблагоприятных эффектов, наблюдаемых у животных.
Фармакодинамика
Механизм действия
Рисдиплам представляет собой модификатор сплайсинга предшественника матричной рибонуклеиновой кислоты (пре-мРНК) гена выживаемости двигательных нейронов 2 (SMN2), разработанный для лечения спинальной мышечной атрофии (СМА), причиной которой являются мутации в хромосоме 5q, что приводит к недостаточности белка SMN.
Недостаточность функционального белка SMN является патофизиологическим механизмом развития СМА всех типов. Рисдиплам корректирует сплайсинг SMN2, сдвигая баланс с исключения экзона 7 на включение экзона 7 в транскрипте м-РНК. приводя к образованию функционального и стабильного белка SMN. Таким образом, рисдиплам лечит СМА путём увеличения и сохранения уровней функционального белка SMN.
Рисдиплам равномерно распределяется во всем организме, в том числе в центральной нервной системе (ЦНС), проникая через гематоэнцефалический барьер и соответственно приводя к увеличению уровня белка SMN в ЦНС и по всему организму. Концентрации рисдиплама в плазме и белка SMN в крови отражают распределение и фармакодинамические эффекты рисдиплама в тканях, а именно: мышечных тканях и тканях мозга.
Во всех клинических исследованиях применение рисдиплама приводило к устойчивому и длительному увеличению уровня белка SMN. В течение 4 недель после начала лечения медианный уровень белка SMN был более чем в 2 раза выше по сравнению с исходным значением, согласно измерениям в крови. Повышение уровня белка SMN сохранялось на протяжении периода лечения ≤2 лет у пациентов с манифестацией СМА в младенческом возрасте и у пациентов с поздней манифестацией СМА (см. подраздел «Клиническая эффективность»).
Клиническая эффективность
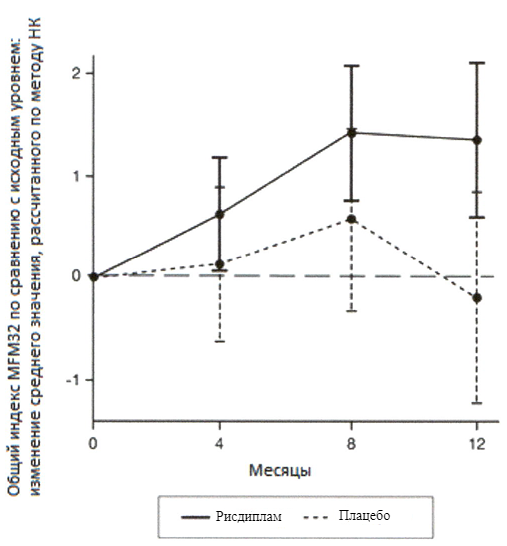
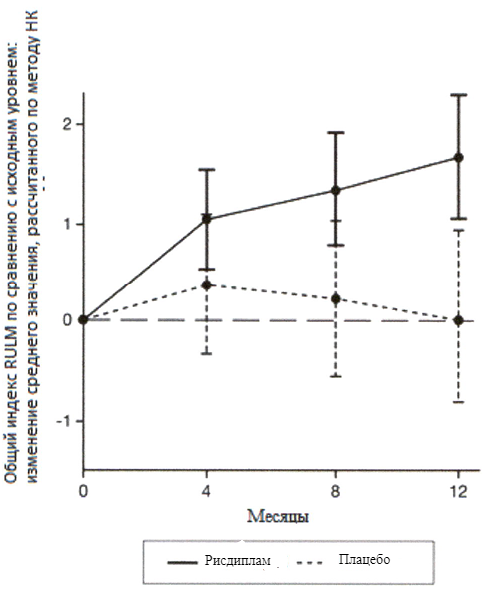
Эффективность рисдиплама для лечения пациентов с манифестацией СМА в младенческом возрасте и пациентов с поздней манифестацией СМА оценивалось в 2 опорных клинических исследованиях FIREFISH и SUNFISH и подтверждено дополнительными данными, полученными в исследовании JEWELFISH. В целом результаты исследований подтверждают эффективность рисдиплама у пациентов со СМА.
Манифестация СМА в младенческом возрасте
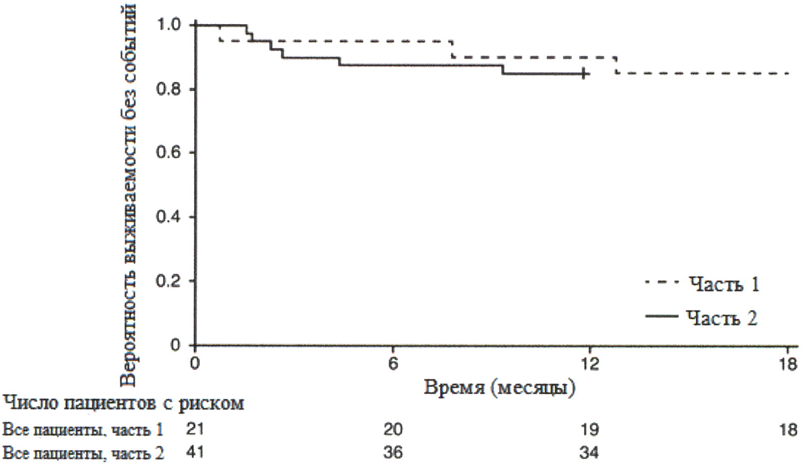
ВР39056 (FIREFISH) представляет собой открытое исследование по изучению эффективности, безопасности, фармакокинетики и фармакодинамики рисдиплама у пациентов с симптоматической СМА 1 типа (у всех пациентов было генетически подтверждено заболевание с двумя копиями гена SMN2). Исследование состоит из двух частей. Часть 1 исследования FIREFISH разработана как часть исследования по подбору дозы. В подтверждающей части 2 исследования FIREFISH оценивалась эффективность рисдиплама в терапевтической дозе, которая была выбрана на основании результатов части 1 исследования. Пациенты из части 1 не принимали участия в части 2.
В частях 1 и 2 ключевой конечной точкой по эффективности была возможность сидеть без поддержки в течение, как минимум, 5 секунд согласно измерениям по пункту 22 шкалы развития младенцев и детей Бейли — 3 издание (Bayley Scales of Infant and Toddler Development, BSID-II1, шкала крупной моторики) после 12 месяцев лечения рисдипламом.
FIREFISH часть 2
В часть 2 исследования FIREFISH был набран 41 пациент со СМА 1 типа.
Медиана возраста возникновения клинических признаков и симптомов СМА 1 типа составила 1.5 месяцев (1.0–3.0 месяцев), 54 % были женского пола, 54 % — представители европеоидной расы и 34 % — представители азиатской расы.
Медиана возраста на момент набора в исследование составила 5.3 месяцев (2.2–6.9 месяцев), медиана времени между возникновением симптомов и приёмом первой дозы составила 3.4 месяцев (1.0–6.0 месяцев).
На исходном уровне средний индекс по результатам теста детской больницы Филадельфии для оценки двигательных функций при нейромышечных заболеваниях у новорождённых (Children’s Hospital of Philadelphia Infant Test of Neuromuscular Disorders, CHOP-INTEND) составил 22 балла (8.0–37.0) и средний индекс по результатам неврологической оценки младенцев по шкале Хаммерсмита, модуль 2 (Module 2 of the Hammersmith Infant Neurological Examination, HINE-2) составил 1.0 (0.0–5.0).
Первичной конечной точкой была доля пациентов с возможностью сидеть без поддержки в течение, как минимум, 5 секунд после 12 месяцев терапии (шкала крупной моторики BS1D-11I, пункт 22). Конечные точки по эффективности у пациентов, получавших рисдиплам, сравнивали с таковыми в аналогичных группах нелеченных пациентов с манифестацией СМА в младенческом возрасте с естественным течением заболевания (критерии функционирования) — см. таблицу 1 ниже.